
探讨颅骨缺损患儿行仿生材料颅骨修补术后并发症的种类及预防方法。
回顾性分析2014年1月至2017年8月清华大学玉泉医院神经外科采用经个性化定制的仿生骨材料(纳米相羟基磷灰石/胶原复合骨)行儿童颅骨修补65例。其中,男36例,女29例;年龄范围为1岁2个月至12岁。外伤致去骨瓣57例,其中闭合性颅脑损伤49例(包括外伤后颅骨凹陷性/粉碎性骨折,硬膜内、外血肿,脑挫裂伤等),开放性颅脑损伤8例(包括车祸伤4例,高空坠物砸伤2例,钝器砸伤1例,锐器砍伤1例),非外伤因素去骨瓣减压8例(包括自发性蛛网膜下腔出血3例,脑肿瘤术后脑水肿2例,颅骨恶性肿瘤2例,颅骨嗜酸性肉芽肿1例)。平均去骨瓣时间为1年5个月,其中最短时间为2个月,最长时间超过4年。所有病例中,59例为单侧颅骨缺损(左侧36例,右侧23例),6例为双侧颅骨缺损;去骨瓣范围中标准或近似标准的单侧额颞大骨瓣减压窗46例,单侧额、颞、顶、枕部分去骨瓣减压13例,分隔的双侧额颞减压窗5例,双额贯通减压窗1例。术后跟踪随访2~5年。
患儿手术过程均顺利,出现各类术后并发症共42例,包括皮下积液27例,仿生材料固定松动8例,仿生材料术后碎裂6例,感染1例,全部行针对性处理后效果满意。
儿童仿生材料颅骨修补术后易出现各类并发症,这与术中仿生材料使用经验不足和儿童依从性差有关。掌握仿生材料的特性和儿童生长发育特点,可明显减少术后并发症的出现。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童颅骨缺损后如能尽快行颅骨缺损修补,不但能保护大脑、改善颅面外观,还能极大促进神经功能恢复。目前人工颅骨修补材料已从传统的金属钛网、硅胶、骨水泥、聚醚醚酮(polyether-ether-ketone,PEEK)等,发展到各类生物活性材料。但运用新材料进行修补,未知因素较多,风险较大。清华大学玉泉医院神经外科自2014年初开始采用个性化定制并3D打印成型的仿生骨材料(biomimetic materials bone),即纳米相羟基磷灰石/胶原复合骨,分别对65例患儿行颅骨缺损修补,术后随访2~5年,总结手术技巧及术后并发症的处理。
颅骨缺损患儿65例,其中男36例,女29例。年龄范围为1岁2个月至12岁。外伤致去骨瓣57例,其中闭合性颅脑损伤49例(包括外伤后颅骨凹陷性/粉碎性骨折,硬膜内、外血肿,脑挫裂伤等),开放性颅脑损伤8例(包括车祸伤4例,高空坠物砸伤2例,钝器砸伤1例,锐器砍伤1例,),非外伤因素去骨瓣减压8例(包括自发性蛛网膜下腔出血3例,脑肿瘤术后脑水肿2例,颅骨恶性肿瘤2例,颅骨嗜酸性肉芽肿1例)。平均去骨瓣时间为1年5个月,其中最短时间为2个月,最长时间超过4年。所有病例中,59例为单侧颅骨缺损(左侧36例,右侧23例),6例为双侧颅骨缺损;去骨瓣范围中标准/近似标准的单侧额颞大骨瓣减压窗46例,单侧额、颞、顶、枕部分去骨瓣减压13例,分隔的双侧额颞减压窗5例,双额贯通减压窗1例。
本研究工作通过医院伦理委员会批准,批注文号:20140005。纳入本研究患儿的家属均签署知情同意书。
51例患儿术前行磁共振成像(magnetic resonance imaging,MRI)检查确认有脑软化并伴有对侧不同程度偏瘫,表现为肢体肌力下降、肌张力增高或降低,精细运动及运动协调能力差。12例患儿术前有严重的脑膜脑膨出表现,其中9例患儿评估为脑积水,先期行(贝朗)可调压分流管侧脑室-腹腔分流术,术后给予缓慢调整分流管压力至骨窗稍凹陷为止,3例患儿在术中切除坏死膨胀的部分脑组织;8例患儿术前有骨窗周围皮下积液;7例患儿术前即有经脑电图证实的癫痫;1例患儿有严重的精神症状;术前患儿原切口甲级愈合39例,乙级愈合25例,丙级愈合1例。
仿生骨修补材料均来自北京奥精医疗科技有限公司,材料面积依照术前CT扫描结果,进行计算机颅骨三维重建并行3D打印。经测量,颅骨平均缺损面积为74 cm2,缺损面积范围为33~126 cm2。按照缺损面积将所有患儿分为3组:<50 cm2(9例);50~100 cm2(45例),>100 cm2(11例)。按照患儿年龄不同,材料内部纳米相羟基磷灰石及胶原成分的比例有所不同,年龄越大,其修补材料内羟基磷灰石的成分比例越高,其硬度增加,韧性下降,具体比例依照术前技师与医生的讨论结果制定。
患儿均采用插管全身麻醉,切皮前在术区用稀释的罗哌卡因匹配0.1%的肾上腺素生理盐水进行浸润麻醉,如患儿有明显皮下积液或脑膜脑膨出的情况应小心,避免药物扩散对脑组织的直接影响。尽可能循原瘢痕切口并在帽状腱膜下游离皮瓣。手术范围涉及颞肌者应区别对待:如颞肌肥厚、血供丰富,应考虑给予颞肌筋膜下游离,后将颞肌置于仿生材料骨瓣外表面;如颞肌萎缩或分离困难,可考虑将颞肌置于骨瓣下,并在骨瓣颞底部预留空间以防止颞肌嵌顿。单极电刀游离骨窗边缘,此过程应避免电热传导伤及硬膜下脑组织或电刀烧透硬膜,硬膜破损时尽量使用自身组织如颞肌筋膜等严密缝合,必要时使用人工硬膜修补。咬骨钳将骨窗边缘增生的骨皮质咬除,露出松质骨,用明胶海绵代替骨蜡止血;在仿生骨瓣预设固定孔对应的骨窗边缘用小磨钻打孔,距边缘约0.5 cm左右。仿生骨瓣中央多处硬膜悬吊,按照手术计划安放仿生骨瓣,孔对孔用双7号丝线固定妥当,将线结压入仿生骨瓣的骨孔中,使其远离切口。2017年后因有术后患儿出现骨瓣松动,固在术中加用PEEK材料颅骨锁固定。合理处置颞肌后,部分大创面病例放置皮下外引流。逐层缝合皮下及皮肤,术后常规运用抗生素防止感染。
所有患儿的手术过程均顺利,术后复查头颅CT并行三维重建,见仿生骨材料与原骨窗弧度贴合好,整体外形满意。所有患儿围手术期内无术区严重出血、癫痫、感染等严重并发症。24例患儿在术后14 d内出现皮下积液,其中12例患儿单纯给予注射器抽吸加压包扎后积液消失,7例给予皮下穿刺持续外引流并加压包扎后积液消失,4例给予持续腰穿置管外引流后皮下积液消失,1例经上述所有治疗均未解决皮下顽固性积液,给予再次开颅手术修补硬膜后皮下积液消失;另3例患儿出院后在半年内再次出现皮下积液,其中1例患儿给予持续腰穿置管外引流并术区局部加压包扎,2周后积液消失,1例患儿经上述处理无效,行脑室-腹腔分流术后积液消失,另1例患儿因已行带脑室-腹腔分流管,最终给予开颅切除部分脑软化灶并严密重建硬膜后,未再有皮下积液出现。有8例患儿术后随访发现仿生骨瓣松动,最短为术后3个月,最长2年1个月,严重者按压仿生骨瓣可活动,并可随脑搏动而搏动;症状轻者仅哭闹时能见骨瓣局部凸起,其中5例患儿行再次手术固定,术中加用PEEK颅骨锁。另3例患儿因症状轻微或因家属对再次手术信心不足未予处理;6例患儿术后2~3年随访出现仿生骨瓣不同程度碎裂,其中3例有明确外伤史,另3例原因不明。所有6例仿生骨瓣碎裂的患儿中,3例给予更换仿生骨瓣,1例用PEEK骨瓣进行再次修补,1例用钛网再次修补,1例未处理。唯一术后感染患儿证实于术后7个月时,家属诉患儿术后切口结痂一直未脱落,并有"流水",但无发热。后回院行植入体去除+清创缝合术,术中脓液培养结果为阴性。
大多数学者认为儿童颅骨缺损必须修补,并应尽快修补[1]。目前,临床用于儿童颅骨修补的材料主要有金属、高分子材料及医学组织工程学材料三种。金属钛网组织相容性可、价格便宜、手术简便,目前使用最广泛,但儿童术后并发症较多。3D打印的高分子材料如PEEK,组织相容性好、强度更高,但其价格昂贵,并和钛网等材料一样,属于异体修补材料。有些学者使用深低温保存自体颅骨行儿童颅骨修补术,但常出现自体修补后骨瓣被吸收,在低龄儿童尤为常见[2]。可吸收材料对患儿颅骨缺损部位及大小限制较多,使用也受到限制[3]。目前,具有生物学活性的组织工程学材料是各国专家研究的热点[4,5]。
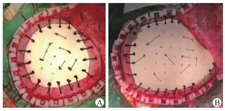
本研究病例中的仿生骨材料(纳米相羟基磷灰石/胶原复合骨)模仿了天然骨成分与其细微结构。其最大的优点是通过新生的血管、骨小管等细微结构构成的骨组织网络通道,进行营养成分与代谢废物的交换与转运,从而参与人体正常的新陈代谢过程。仿生骨在植入人体后,成骨细胞与破骨细胞的协调作用,修补材料与自体组织相交界面始终处于骨溶解与钙质沉积的动态交替过程中,最终有望"爬行替代"为自体骨组织[6]。但在个性化定制骨瓣中,应根据患儿实际情况调整羟基磷灰石与骨胶原的含量比。幼童应使用胶原成分占比较大的材料(图1A)。其表面光滑、色白,韧性高,磨钻打磨易熔化变形,较好地模仿了婴幼儿骨质的韧性。学龄以上患儿应使用羟基磷灰石占比较大的骨瓣较为妥当(图1B),具体配比应参照患儿自身发育情况(如年龄、身高、受伤范围、原骨瓣厚度等)。总体而言,学龄以上患儿的仿生骨材料表面较粗糙、色微黄、硬度较高、脆性明显增大,术中修整、打磨较困难,易"崩裂"。

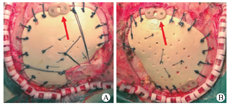
钛网等传统颅骨修补材料术后并发症的发生率为26.4%,其中最常见的是出血,我院无术后出血再手术病例[7,8]。但统计显示不同时期出现皮下积液的发生率为41.5%(27/65),原因可能有:①在大多数学者关于颅骨修补手术并发症的报道中,因皮下积液症状轻微,处理简单,并未纳入;②由于本研究仿生骨修补手术对象为儿童,运用新材料的手术过程十分精细,止血彻底;另外因术后治疗患儿配合度不佳,保留皮下引流管风险较高、护理困难,因此前期大多数手术均没有放置皮下外引流;③仿生材料骨瓣仍为异体材料,表面较光滑,孔洞数量较钛网少、直径小,皮瓣内生肉芽与硬膜表面的外生肉芽之间粘连困难,易形成空腔;④颅骨缺损多为脑外伤导致,患儿术前就有不同程度的脑积水、脑软化或脑肿胀,颅内压较高,术中未处理妥当;⑤手术可能导致小的硬膜破损,导致脑脊液外漏或硬膜悬吊不密,残留有空腔,加之包扎不严密,易产生漏出液及渗出液。除此外,我们发现多数额颞去骨瓣术后的患儿,皮下积液均自较低位颞窝方向。因此,无论是用注射器抽吸皮下积液还是穿刺外引流皮下积液,均应靠近颞底。我们还发现,修补术中颞肌行骨瓣外复位避免颞肌嵌顿,避免颞肌与骨窗缘摩擦,减少组织液渗出(图2A)。但如颞肌萎缩>3/4,就没有必要分离颞肌,可以行颞肌外修补(图2B)。但这需在术中修剪并打磨仿生骨瓣边缘,为颞肌根部预留空间,防止颞肌嵌顿。术后采用皮下外引流管并辅以加压包扎,可使皮瓣紧贴于仿生骨外表面,不留死腔,效果较好。

少部分病例在拔除皮下引流管后的不同时期,仍出现了皮下积液,一旦再次出现皮下积液,我们的处理顺序为:①注射器抽吸后加压包扎;②皮下穿刺持续外引流并加压包扎;③持续腰穿置管外引流并加压包扎;④再次开颅手术修补硬膜。以上每1个步骤都不应超过7~10 d,否则富含蛋白的积液在组织表面一旦形成光滑的假膜,皮瓣就更难与仿生骨外表面相贴合。本研究中1例顽固性积液患儿再次开颅取下仿生骨瓣后未见硬膜有明确的渗漏点,故在硬膜外铺置一层薄明胶海绵,加强硬膜悬吊,剔除硬膜外及皮瓣下光滑的假膜,术后留置皮下引流管7 d,并静脉给予甘露醇点滴降颅压,3周后皮瓣便与仿生骨贴合紧密。因此我们认为,只要将仿生骨瓣外表面制作成"毛玻璃样"粗糙,并增加骨瓣孔洞数量,就能显著降低皮下积液的发生率。
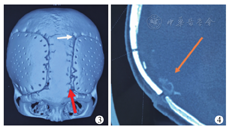
仿生骨瓣松动的原因较复杂,8例全部涉及额部,并且患儿均无脑软化或脑坏死(3例面积为50~100 cm2,5例面积>100 cm2)。可能是处在生长发育期的患儿,额叶的发育速度远大于其他脑叶的发育。一旦脑的膨胀速度快于仿生骨的"延展"速度及仿生骨-自体骨"键合"的速度,脑组织向外的膨胀力使得仿生骨材料四周与自体骨之间缝隙变宽,无法完成"键合"性骨连接[9]。并且在早期手术中,使用双10号线固定骨瓣,其线结本身的高张力对患儿自体骨形成"剪切作用"(图3),导致骨孔周围萎缩退化,线结固定相对"豁脱"[10]。之后均改为双7号丝线固定,线结松紧适度,位置远离切口。同时部分患儿术前脑压较高,脑积水未能解决,脑的搏动性压力传递也加剧了骨瓣松动。因此我们建议,对于有脑积水的患儿应先处理脑积水再行颅骨修补手术。脑膜脑膨出的患儿在修补术中应切除部分坏死的脑软化灶,必要时可做脑室造瘘,促进脑脊液回流。对于处于两个生长发育高峰、脑实质未受大损伤的患儿,术中需在额颞部相应部位加用PEEK颅骨锁固定。如在二次术中见仿生骨材料与自体骨之间已经出现较大缝隙,有结缔组织长入,估计骨"键合"困难者,须在清除结缔组织后(图4),在缝隙间填塞胶原骨泥(奥精医疗科技有限公司,中国),利用其强大的诱导能力促进骨健合。

6例仿生材料骨瓣碎裂的患儿中,2例面积介于50~100 cm2(92 cm2和99 cm2),4例面积>100 cm2,或从侧面说明相同厚度的材料,面积越大,垂直力学性能越差。6例中3例有明确的再次外伤史(图5),另3例原因不明。除家属有可能刻意隐瞒外伤史外,还不能排除仿生材料特殊的理化性质导致的"自动"碎裂,因为早期使用的幼儿型仿生材料骨瓣中胶原成分较多,作为基质的羟基磷灰石成分较少,胶原成分被吸收后因成骨细胞"爬行替代"不充分,导致基质结构"崩塌",受外力后易碎裂。并且在诱导自体骨窗与仿生骨材料相向而行的过程中,张力相对,也有可能导致骨瓣"崩裂",一旦骨瓣碎裂,血供接触面积明显增大,"爬行替代"的生长方式能加速碎裂过程(图6)。
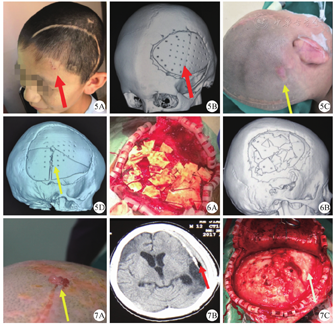

感染是颅骨修补术后最严重的并发症(图7)。我院1例12岁男性患儿,入院后因行为举止怪异,经心理卫生科会诊考虑颅脑外伤性精神障碍,术前及术后均运用奋乃静片控制精神症状。术后有1处结痂至出院未脱落,7个月后患儿因结痂下反复"流水"再次来我院就诊,追问病史,家属诉患儿有不停用手"挠头"的情况。再次入院后给予切口分泌物培养,并行头颅CT检查,发现硬膜外可疑高密度影,立刻给予手术探查。术中见骨瓣下大量黄色脓苔,除抛弃植入骨瓣并清理感染软组织外,更对周围炎性骨组织进行扩大清除。感染原因除患儿有明确精神症状外,我们还考虑患儿为车祸外伤后颅骨缺损,伤情较重,头皮及皮下成分血供差。加之骨瓣固定线结恰巧位于切口下方,反复刺激瘢痕切口,引发患儿瘢痕瘙痒,反复搔抓,最终导致感染。
我院将仿生材料运用于儿童颅骨修补在国内外尚属首次,"不完美"的病例出现总能促进术式的改良与材料的进步。随着病例数量的积累,医生对仿生骨材料各项理化特性的深入了解,使儿童仿生材料颅骨修补技术不断成熟。充足的临床手术经验可以很大程度上消除或避免儿童仿生材料颅骨修补手术并发症的出现,即使有并发症,丰富的临床经验可以迅速补救,但仍有某些因生长发育或未知因素导致的并发症需待我们去探究。
所有作者均声明不存在利益冲突



























