
本研究总结了北京协和医院1987年1月至2017年12月收治的27例Graves病胫前黏液性水肿患者的临床特点,旨在提高对黏液性水肿的认识。Graves病所致胫前黏液性水肿易漏诊、误诊,131I放射治疗可能与发病相关。临床中遇到胫前黏液性水肿,特别是同时有突眼或杵状指的患者,要警惕Graves病可能,需详细询问病史及检测甲状腺功能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胫前黏液性水肿也称为局部性黏液性水肿、甲状腺相关皮肤病或浸润性皮肤病,非Graves病的常见表现。Graves病,即毒性弥漫性甲状腺肿,是一种自身免疫性甲状腺疾病。其典型临床表现包括甲状腺功能亢进(甲亢)、甲状腺肿、眼病。约5%的患者可有皮肤受累,表现为胫前黏液性水肿,为对称性或不对称性,并不局限于胫前区域,可能会延伸至踝和足背,甚至出现在肘、膝、上背和颈部,表现为非凹陷性鳞屑样增厚及硬化[1,2],常有橘皮样外观[3]。部分Graves病患者除胫前黏液性水肿外,还可有突眼。突眼、局限性的胫前黏液性水肿、杵状指/趾(肥大性骨关节病)三联征被称为EMO综合征(exophthalmos pretibial myxedema and hypertrophic osteoarthropathy syndrome),早在1967年由Braun-Falco和Petzoldt提出。因黏液性水肿患者水肿的发生与诊断Graves病相隔时间较长,常会导致误诊、漏诊。本研究回顾性分析北京协和医院1987年1月至2017年12月收治的27例Graves病胫前黏液性水肿患者的临床资料,以提高临床医师对这一疾病的认识。
病例系列研究。通过北京协和医院电子病历查询系统,以"甲状腺功能亢进" + "黏液性水肿"为关键词检索1987年1月至2017年12月于北京协和医院住院的Graves病胫前黏液性水肿患者。Graves病诊断符合2018年欧洲甲状腺协会(European Thyroid Association,ETA)指南标准[4]。Graves眼病符合1997年美国甲状腺学会(American Thyroid Association,ATA)Graves眼病分级标准[5]。黏液性水肿诊断依据病史和皮损的特征性临床表现(部位、非凹陷性质和病变边界清楚)。排除标准:(1)合并系统性硬化症、嗜酸细胞性筋膜炎、淋巴丝虫病等其他导致皮肤肿胀和硬化的疾病。(2)病史、体格检查、实验室检查资料不完整。
收集患者病历资料,包括性别、年龄,出现黏液性水肿时甲状腺功能情况,是否突眼,与确诊Graves病、确诊眼病的相隔时间,治疗方式,吸烟史。实验室检查:血清游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4),促甲状腺激素(thyroid-stimulating hormone,TSH),促甲状腺素受体抗体(thyroid stimulating hormone receptor antibody,TRAb),上述指标1999年以前采用放射免疫法(radioimmunoassay,RIA),1999年1月后采用化学发光免疫分析法(chemiluminescent immunoassay,CLIA)测定。
采用SPSS 22.0统计软件进行数据分析。年龄符合正态分布,采用 ±s表示;出现黏液性水肿与诊断Graves病的间隔时间、黏液性水肿出现症状到确诊时间不符合正态分布,采用M(Q1,Q3)表示;性别、吸烟史等定性资料采用例数和百分比表示。
±s表示;出现黏液性水肿与诊断Graves病的间隔时间、黏液性水肿出现症状到确诊时间不符合正态分布,采用M(Q1,Q3)表示;性别、吸烟史等定性资料采用例数和百分比表示。
共检索出2 854例甲亢患者,其中31例诊断为Graves病胫前黏液性水肿,4例患者临床资料缺失。收集27例患者病历资料,其中男16例,女11例(男女比例1.5∶1)。黏液性水肿发病年龄(50±9)岁,其中30~39岁2例(7.4%),40~49岁8例(29.6%),50~59岁14例(51.9%),60~69岁2例(7.4%),70~79岁1例(3.7%),发病高峰分布在50~59岁年龄段。黏液性水肿是在诊断Graves病3(2,11)年后出现,黏液性水肿出现症状到确诊时间间隔1(1,2)年。15例(56%)患者有吸烟史,其中13例患者有20年以上吸烟史,均为男性。11例(41%)患者出现黏液性水肿前曾接受131I放射治疗,其中7例患者于131I放射治疗后6个月内出现胫前黏液性水肿,2例患者于2年内出现胫前黏液性水肿,2例患者分别于放射治疗后13、23年后出现胫前黏液性水肿。10例接受131I放射治疗的患者治疗后同时伴有眼病的发生。
11例(41%)患者确诊黏液性水肿时无明显症状,2例(5%)患者曾被误诊为"结节性红斑" 。23例(85%)表现为双侧胫前黏液性水肿,其余4例(15%)患者双侧胫前、双手同时受累。6例(22%)患者同时有杵状指。14例患者确诊时具体描述了黏液性水肿的性质,其中5例患者有皮肤增厚,5例患者有色素沉着,7例患者有结节样改变,3例患者有斑块样皮肤病变。图1展示了黏液性水肿患者的临床特征,可见胫前局部皮肤增厚,有隆起的结节,类似于象皮腿样外观,局部有皮肤色素沉着及色素脱失(该患者同时合并白癜风)。双手可见杵状指样改变。影像学检查见黏液性水肿部位局部皮肤软组织水肿(图2)。其中3例患者行黏液性水肿处局部组织活检,病理可见表皮增生肥厚,真皮浅层胶原稀疏,较多黏液样物质沉积,阿辛蓝染色均为阳性(图3)。
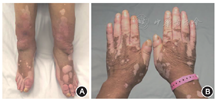

注:双侧胫前橘皮外观,并见散发结节;双手可见杵状指(患者合并白癜风,导致色素脱失)
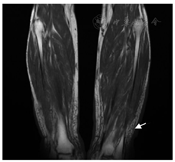

注:箭头示双侧胫前软组织水肿
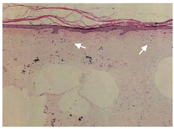

注:箭头示表皮角化过度,棘层萎缩,皮突消失,真皮弥漫黏蛋白沉积,阿辛蓝染色阳性(×100)
27例患者中,21例(78%)有甲状腺肿大,其中10例(37%)为Ⅰ度肿大,4例(15%)为Ⅱ度肿大,7例(26%)为Ⅲ度肿大。14例具体描述黏液性水肿性质的患者中,5例皮肤增厚患者均甲亢;5例色素沉着患者中4例甲亢,1例甲状腺功能正常;7例有结节样改变患者中3例甲亢,2例甲状腺功能减退(甲减),2例甲状腺功能正常;3例斑块样病变患者中1例甲亢,2例甲状腺功能正常。27例患者出现黏液性水肿时均检测了TRAb水平,其中17例(63%)TRAb水平升高。出现黏液性水肿时患者甲状腺功能各异,18例(67%)甲亢,2例(7%)甲减,7例(26%)甲状腺功能正常。
27例患者中,24例(89%)突眼,其中13例(48%)为显著突眼(突眼度>20 mm)。突眼患者的眼部临床表现见表1。24例眼部受累的患者中,1例患者在出现突眼前4个月出现黏液性水肿,12例患者突眼与黏液性水肿同时出现,其余11例患者在出现突眼后出现黏液性水肿。在这11例患者中,时间间隔0~2年9例,6年1例,1例患者出现突眼26年后才出现黏液性水肿。

27例Graves病胫前黏液性水肿患者眼部受累情况
27例Graves病胫前黏液性水肿患者眼部受累情况
| 临床表现 | 例数(例) | 占比(%) |
|---|---|---|
| 突眼 | 24 | 89 |
| 眼征 | 23 | 85 |
| 复视 | 11 | 41 |
| 视物模糊 | 12 | 44 |
| 眼痛 | 10 | 37 |
| 畏光 | 13 | 48 |
| 流泪 | 10 | 37 |
27例患者治疗方法不一,出院后随访3~6个月。所有患者诊断为Graves病后均使用抗甲状腺药物。除此以外,11例(41%)患者出现黏液性水肿前曾接受131I放射治疗;2例患者甲状腺切除;1例使用环孢素;1例使用环磷酰胺;1例使用依托考昔。
7例患者局部使用+口服糖皮质激素,其中5例患者黏液性水肿好转。2例患者局部使用+口服糖皮质激素联合维生素D3制剂,2例患者单用维生素D3制剂,黏液性水肿均有好转。
突眼患者中,6例患者行球后放疗,其中3例突眼好转;2例患者行眶减压术,1例突眼有好转。
胫前黏液性水肿是Graves病的少见表现,本研究结果显示,出现胫前黏液性水肿患者占Graves病患者的1%。本研究只纳入了住院患者,门诊患者并未纳入,发病率较文献报道的5%低[1,2]。研究还发现胫前黏液性水肿发病年龄较晚,男性比例高,有别于Graves病[4]。因黏液性水肿本身发病率较低,且部分黏液性水肿患者水肿的发生与诊断Graves病相隔时间较长,常会导致误诊、漏诊。本研究中11例患者在确诊时并无相关主诉,且有2例误诊。因此在临床中遇到胫前黏液性水肿,特别是同时有突眼或杵状指的患者,要警惕Graves病可能,需详细询问病史及检测甲状腺功能。Graves病患者随访时也应注意行全身查体,警惕胫前黏液性水肿。
黏液性水肿的明确诊断需要根据病史以及皮损的典型表现。如果有明确的甲状腺疾病相关病史以及突眼,常不需要皮肤活检即可确诊。若既往没有甲状腺疾病病史,皮肤活检则比较重要。通过苏木精-伊红染色检测糖胺聚糖,阿辛蓝、胶体铁或甲苯胺蓝检测糖胺聚糖,都提示黏液性水肿。鉴别诊断方面,需除外其他炎症性皮肤病所致的皮损,比如腿部慢性淋巴管或者静脉阻塞引起的淤积性皮炎、慢性皮炎。部分免疫性疾病患者,如红斑狼疮、皮肌炎和硬皮病患者可合并皮肤黏蛋白病。其他类似皮肤病变还有苔藓样皮肤淀粉样变、肥厚性扁平苔藓以及糖尿病脂性渐进性坏死。
目前认为胫前黏液性水肿的发生与TRAb关系密切,而与三碘甲状腺原氨酸(T3)、甲状腺素(T4)关系不大,甲状腺功能正常或异常的患者均可发病。其发生机制可能是局部表达TSH受体,该受体由正常真皮成纤维细胞表达,与甲亢时升高的TRAb结合,刺激T淋巴细胞激活,释放肿瘤坏死因子α和干扰素γ等细胞因子,诱导纤维母细胞分泌大量糖胺聚糖,尤其是透明质酸,透明质酸和硫酸化的黏多糖沉淀到真皮乳头层和网状真皮层,形成局部不可凹陷的水肿[6]。此机制和浸润性突眼的发病机制相似,因此浸润性突眼与黏液性水肿常相伴出现。本研究中24例(89%)患者存在突眼,6例(22%)患者同时存在胫前黏液性水肿、突眼、杵状指,与文献报道一致。
烟草使用、创伤、手术和放射性131I治疗可能是导致TRAb进一步升高的诱因,进而使突眼和黏液性水肿加重[7]。本研究中17例(63%)患者TRAb水平升高,而出现黏液性水肿时甲状腺功能状态不同。其中超过半数的患者有多年吸烟史,超过1/3的患者有131I治疗史,与既往报道一致。提示使用131I治疗后需监测TRAb水平,对可能出现的皮肤病变早干预,早治疗。
对于胫前黏液性水肿,世界范围内目前无公认的最佳治疗手段,总体治疗效果不佳。既往经验表明,甲状腺功能控制好,不吸烟的患者更易得到恢复。手术治疗也可为一种选择。非手术治疗方法包括尽量降低TRAb水平,口服或局部应用糖皮质激素[8]和维生素D3制剂,血浆置换等。活性维生素D除影响钙磷代谢外,具有一定的免疫调节作用,可用于胫前黏液性水肿的治疗。血浆置换在短期内有一定效果,但复发率高。也有研究发现己酮可可碱可通过抑制促炎细胞因子和成纤维细胞增殖来改善黏液性水肿[9]。也有文献报道部分患者突眼和黏液性水肿局部淋巴细胞生长抑素受体显像阳性,给予局部注射奥曲肽治疗后效果显著[10]。但其临床经验较少,费用昂贵,部分患者收效甚微[11]。国外曾报道使用利妥昔单抗联合血浆置换治疗严重胫前黏液性水肿者[12,13],但也仅为个案报道。本研究中病例随访时间较短,仅观察到短期内糖皮质激素、维生素D制剂可缓解黏液性水肿症状,其长期治疗效果以及其他药物的疗效仍需要更长时间的随访以及更深入的研究。
所有作者均声明不存在利益冲突



























