
临时性造口可降低吻合口漏的发生率,改善直肠癌患者的预后。然而,如果造口超过1年未能还纳,易转变为永久性造口,影响患者生活质量和心理健康。为提高造口还纳率,本研究探讨经腹直肠癌前切除术临时性造口成为永久性造口的相关危险因素。
采用病例对照研究方法,分析2008年6月至2018年6月期间,在中南大学湘雅医院普通外科接受经腹直肠癌前切除术并临时性造口、术后完成随访的直肠癌病例资料。本研究中,临时性造口包括预防性造口(即经腹直肠癌前切除术的同时行造口手术)和挽救性造口(即经腹直肠癌前切除术时未造口,但术后1个月内因出现吻合口漏或其他严重并发症需再次行造口手术)。共308例直肠癌患者被纳入研究,其中男性198例,女性110例,中位年龄56(48~65)岁。94例接受术中腹腔化疗,高位、中位和低位直肠肿瘤患者分别为64例、89例和155例。20例接受横结肠造口,288例接受回肠末端造口。2019年8—9月集中进行电话随访,详细了解患者造口还纳和未能还纳原因、肿瘤是否复发等情况。造口永久化定义为患者在最后一次随访时造口仍无还纳。使用χ2检验或Fisher确切概率法对临时性造口永久化相关的临床特征进行单因素分析,并将其中P<0.10的因素纳入非条件logistic逐步回归分析模型,进行多因素分析。
中位随访54.3(32.4~73.8)个月,局部复发8例,远处转移37例。308例临时性造口患者中有247例(80.2%)还纳,还纳时间距造口手术时间中位数为4.5(3.5~6.1)个月。预防性造口患者还纳182例,还纳时间为4.2(3.4~5.5)个月;挽救性造口患者还纳65例,还纳时间为5.5(4.3~7.5)个月,两组还纳时间差异有统计学意义(Z=-4.387,P<0.001)。61例(19.8%)转变为永久性造口,其中预防性造口者45例,挽救性造口者16例。单因素分析显示,导致临时性造口永久化的危险因素包括术前贫血、术中腹腔化疗、中位直肠肿瘤、横结肠造口、肿瘤病理分期、术后有局部复发及术后远处转移(均P<0.10)。多因素分析显示,术中腹腔化疗(OR=1.961,95% CI:1.029~3.738,P=0.041),中位直肠肿瘤(OR=2.401,95% CI:1.195~4.826,P=0.014),横结肠造口(OR=3.433,95% CI:1.234~9.553,P=0.018)和术后远处转移(OR=8.282,95% CI:3.820~17.954,P<0.001)是临时性造口永久化的独立危险因素。
对于术中腹腔化疗、中位直肠肿瘤、横结肠造口和术后远处转移的患者,经腹直肠癌前切除术临时性造口存在造口永久化的风险,外科医师需谨慎考量以减少临时性造口永久化的风险,并充分告知患者以减少潜在的医疗隐患。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
为了降低吻合口漏的发生率,避免吻合口漏导致严重腹盆腔污染和全身感染,以改善低位直肠癌前切除术后患者的预后,很多术者选择行预防性造口或挽救性造口[1,2]。其决策初衷往往是临时性造口,计划在度过吻合口漏风险期后再行造口还纳手术。但并不是所有的临时性造口能够按计划还纳。据研究报道,临时性造口最终转变为永久性造口的概率高达6%~23.2%[3,4,5]。den Dulk等[6]研究表明,预防性造口术后1年内选择造口还纳的患者占97%;而如果造口超过1年未能还纳,大部分造口将不再还纳而转变为永久性造口。对于这些患者而言,临时造口转永久化不但使其生活质量受影响,还可能造成其长期心理负担。因此,外科医师在决策是否进行临时性造口时,除了考虑到适应证外,还需要谨慎考虑患者临时性造口的可能结果和影响还纳的相关因素,这对提高造口还纳率、改善患者术后生活质量十分关键。本研究回顾性分析了2008年6月至2018年6月期间在中南大学湘雅医院行经腹直肠癌前切除术并临时性造口手术患者的临床资料,探究临时性造口转变为永久性造口的危险因素,以期为临床手术决策提供参考。
本研究中,临时性造口包括预防性造口(即经腹直肠癌前切除术的同时行造口手术)和挽救性造口(即经腹直肠癌前切除术时未造口,但术后1个月内因出现吻合口漏或其他严重并发症需再次行造口手术)。
本文采用病例对照研究方法,分析2008年6月至2018年6月期间,在中南大学湘雅医院普通外科接受经腹直肠癌前切除术并临时性造口的直肠癌病例资料。纳入标准:(1)经病理检查证实为直肠恶性肿瘤;(2)在本中心行经腹直肠癌前切除术和临时性造口术;(3)术后完成随访。排除肠道多发肿瘤者。
根据上述标准,共308例直肠癌患者被纳入研究,其中男性198例,女性110例,中位年龄56(48~65)岁。全组预防性造口227例(73.7%),挽救性造口81例(26.3%)。64例(20.8%)为高位直肠肿瘤(肿瘤远端距肛缘超过8 cm和肿瘤远端位于腹膜反折之上),89例(28.9%)为中位直肠肿瘤(肿瘤远端距肛缘4~8 cm和肿瘤跨越腹膜反折),155例(50.3%)为低位直肠肿瘤(肿瘤远端距肛缘<4 cm或肿瘤近端位于腹膜反折之下)。高位、中位和低位直肠肿瘤患者中,分别有19例(29.7%)、30例(33.7%)和32例(20.6%)行挽救性造口。本研究经医院伦理委员会审核批准后开始实施(审批号2018121153)。
按照全直肠系膜切除原则,在传统开放或者腹腔镜下行经腹直肠癌前切除术,距肿瘤下缘2 cm、上缘8~10 cm切除肿瘤,应用吻合器完成乙状结肠直肠吻合。全组患者均接受临时性造口,造口部位包括回肠末端造口和横结肠造口,造口方式包括袢式双造口、袢式uncut和单造口。
造口还纳标准:(1)直肠指检示吻合口通畅、无狭窄;(2)直肠指检提示肛门括约肌无明显的松弛,收缩功能基本正常;(3)经肛门碘水造影,未发现吻合口漏及吻合口狭窄,或者吻合口漏已愈合,无直肠肛门狭窄;(4)肠镜检查,吻合口通畅;(5)无肠梗阻以及其他手术禁忌证。
本研究随访由经过培训的课题组成员从湘雅医院病案信息科调阅相关患者详细病例资料。收集资料包括患者人口学信息、实验室检查、辅助检查、手术记录等信息。对数据资料进行双人独立录入,并逐一校对。并于2019年8—9月集中进行电话随访,详细了解患者造口还纳和未能还纳原因、肿瘤是否复发等情况。随访截至2019年9月26日。
患者在最后一次随访时造口仍未还纳,定义为造口永久化。分析临床指标与造口永久化的关系,纳入观察指标除患者人口学信息外,还包括与吻合口漏相关的数据,如术前基础疾病、腹部手术史、吸烟史、家族史、新辅助放化疗、术前贫血(轻度:血红蛋白男性为90~120 g/L,女性为90~110 g/L;中度:血红蛋白为60~90 g/L)、全血血红蛋白值和白蛋白比值、美国麻醉医师协会分级、手术方式、肿瘤位置、术中腹腔化疗、造口部位、造口方式、病理分期[7]、术后吻合口漏(参照国际直肠癌研究组吻合口漏严重程度分级定义标准[8])、术后辅助化疗、局部复发和远处转移情况等。
应用SPSS 22.0软件进行统计分析。正态分布的计量资料用 ±s表示,组间比较采用独立样本t检验;非正态分布的计量资料用M(范围)表示,组间比较用Mann-Whitney U秩和检验。分类变量用例(%)表示,组间比较及临时性造口永久化的单因素分析使用χ2检验或Fisher确切概率法,单因素分析中P<0.10的因素,纳入非条件logistic逐步回归分析模型中进行多因素分析。按检验水准α=0.05,P<0.05表示差异有统计学意义。
±s表示,组间比较采用独立样本t检验;非正态分布的计量资料用M(范围)表示,组间比较用Mann-Whitney U秩和检验。分类变量用例(%)表示,组间比较及临时性造口永久化的单因素分析使用χ2检验或Fisher确切概率法,单因素分析中P<0.10的因素,纳入非条件logistic逐步回归分析模型中进行多因素分析。按检验水准α=0.05,P<0.05表示差异有统计学意义。
308例临时性造口患者中位随访54.3(32.4~73.8)个月,有247例(80.2%)成功还纳,造口还纳时间距造口手术时间中位数为4.5(3.5~6.1)个月;预防性造口患者成功还纳182例(80.2%),还纳时间为4.2(3.4~5.5)个月;挽救性造口患者成功还纳65例(80.2%),还纳时间为5.5(4.3~7.5)个月,两组还纳时间差异有统计学意义(Z=-4.387,P<0.001)。61例(19.8%)转变为永久性造口。
单因素分析显示,导致临时性造口永久化的可能因素包括术前贫血、术中腹腔化疗、中位直肠肿瘤、横结肠造口、肿瘤病理分期、术后有局部复发及术后远处转移(均P<0.10)。见表1。多因素分析结果显示,术中腹腔化疗,中位直肠肿瘤,横结肠造口和术后远处转移是临时性造口永久化的独立危险因素,见表2。
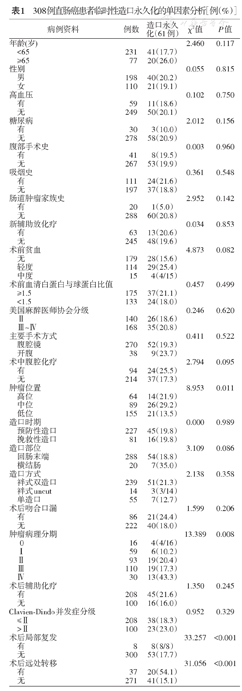
308例直肠癌患者临时性造口永久化的单因素分析[例(%)]
308例直肠癌患者临时性造口永久化的单因素分析[例(%)]
| 病例资料 | 例数 | 造口永久化(61例) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁) | 2.460 | 0.117 | |||
| <65 | 231 | 41(17.7) | |||
| ≥65 | 77 | 20(26.0) | |||
| 性别 | 0.055 | 0.815 | |||
| 男 | 198 | 40(20.2) | |||
| 女 | 110 | 21(19.1) | |||
| 高血压 | 0.102 | 0.750 | |||
| 有 | 59 | 11(18.6) | |||
| 无 | 249 | 50(20.1) | |||
| 糖尿病 | 2.012 | 0.156 | |||
| 有 | 30 | 3(10.0) | |||
| 无 | 278 | 58(20.9) | |||
| 腹部手术史 | 0.003 | 0.960 | |||
| 有 | 41 | 8(19.5) | |||
| 无 | 267 | 53(19.9) | |||
| 吸烟史 | 0.361 | 0.548 | |||
| 有 | 111 | 24(21.6) | |||
| 无 | 197 | 37(18.8) | |||
| 肠道肿瘤家族史 | 2.952 | 0.142 | |||
| 有 | 20 | 1(5.0) | |||
| 无 | 288 | 60(20.8) | |||
| 新辅助放化疗 | 0.034 | 0.853 | |||
| 有 | 63 | 13(20.6) | |||
| 无 | 245 | 48(19.6) | |||
| 术前贫血 | 4.873 | 0.082 | |||
| 无 | 179 | 28(15.6) | |||
| 轻度 | 114 | 29(25.4) | |||
| 中度 | 15 | 4(4/15) | |||
| 术前血清白蛋白与球蛋白比值 | 0.457 | 0.499 | |||
| ≥1.5 | 175 | 37(21.1) | |||
| <1.5 | 133 | 24(18.0) | |||
| 美国麻醉医师协会分级 | 0.246 | 0.620 | |||
| Ⅱ | 140 | 26(18.6) | |||
| Ⅲ~Ⅳ | 168 | 35(20.8) | |||
| 主要手术方式 | 0.411 | 0.522 | |||
| 腹腔镜 | 270 | 52(19.3) | |||
| 开腹 | 38 | 9(23.7) | |||
| 术中腹腔化疗 | 2.794 | 0.095 | |||
| 有 | 94 | 24(25.5) | |||
| 无 | 214 | 37(17.3) | |||
| 肿瘤位置 | 8.953 | 0.011 | |||
| 高位 | 64 | 14(21.9) | |||
| 中位 | 89 | 26(29.2) | |||
| 低位 | 155 | 21(13.5) | |||
| 造口时期 | 0.000 | 0.989 | |||
| 预防性造口 | 227 | 45(19.8) | |||
| 挽救性造口 | 81 | 16(19.8) | |||
| 造口部位 | 3.109 | 0.086 | |||
| 回肠末端 | 288 | 54(18.8) | |||
| 横结肠 | 20 | 7(35.0) | |||
| 造口方式 | 2.138 | 0.358 | |||
| 袢式双造口 | 239 | 51(21.3) | |||
| 袢式uncut | 14 | 3(3/14) | |||
| 单造口 | 55 | 7(12.7) | |||
| 术后吻合口漏 | 1.599 | 0.206 | |||
| 有 | 86 | 21(24.4) | |||
| 无 | 222 | 40(18.0) | |||
| 肿 | 瘤病理分期 | 13.389 | 0.008 | ||
| 0 | 16 | 4(4/16) | |||
| Ⅰ | 59 | 6(10.2) | |||
| Ⅱ | 93 | 19(20.4) | |||
| Ⅲ | 110 | 19(17.3) | |||
| Ⅳ | 30 | 13(43.3) | |||
| 术后辅助化疗 | 1.350 | 0.245 | |||
| 有 | 208 | 45(21.6) | |||
| 无 | 100 | 16(16.0) | |||
| Clavien-Dindo并发症分级 | 0.952 | 0.329 | |||
| ≤Ⅱ | 208 | 38(18.3) | |||
| >Ⅱ | 100 | 23(23.0) | |||
| 术后局部复发 | 33.257 | <0.001 | |||
| 有 | 8 | 8(8/8) | |||
| 无 | 300 | 53(17.7) | |||
| 术后远处转移 | 31.056 | <0.001 | |||
| 有 | 37 | 20(54.1) | |||
| 无 | 271 | 41(15.1) | |||
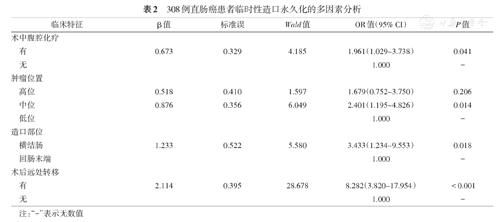
308例直肠癌患者临时性造口永久化的多因素分析
308例直肠癌患者临时性造口永久化的多因素分析
| 临床特征 | β值 | 标准误 | Wald值 | OR值(95% CI) | P值 | |
|---|---|---|---|---|---|---|
| 术中腹腔化疗 | ||||||
| 有 | 0.673 | 0.329 | 4.185 | 1.961(1.029~3.738) | 0.041 | |
| 无 | 1.000 | - | ||||
| 肿瘤位置 | ||||||
| 高位 | 0.518 | 0.410 | 1.597 | 1.679(0.752~3.750) | 0.206 | |
| 中位 | 0.876 | 0.356 | 6.049 | 2.401(1.195~4.826) | 0.014 | |
| 低位 | 1.000 | - | ||||
| 造口部位 | ||||||
| 横结肠 | 1.233 | 0.522 | 5.580 | 3.433(1.234~9.553) | 0.018 | |
| 回肠末端 | 1.000 | - | ||||
| 术后远处转移 | ||||||
| 有 | 2.114 | 0.395 | 28.678 | 8.282(3.820~17.954) | <0.001 | |
| 无 | 1.000 | - | ||||
注:"-"表示无数值
直肠癌根治术中往往倾向选择使用临时性造口、尤其是预防性造口,但却往往忽略临时性造口不能如期还纳、甚至转变为永久性造口的问题[9,10]。国外有研究者关注到,高龄、男性、术后吻合口漏、远处转移、局部复发以及新辅助放化疗等因素均可能与造口永久化有关[11,12,13]。但国内目前尚缺乏直肠癌根治性手术后临时性造口永久化的相关研究。
本研究对接受经腹直肠癌前切除术并临时性造口手术患者的临床资料进行多因素分析,结果显示,术中腹腔化疗是临时性造口永久化的独立危险因素。这与腹腔化疗影响吻合口愈合有关。有研究表明,直肠癌根治术后将化疗药物置入腹腔,可抑制残留肿瘤细胞的增殖和扩散、延长局部晚期直肠癌患者的无瘤生存期,但同时会增加直肠癌前切除术后吻合口漏的发生率(OR=5.386,95% CI:1.808~16.042,P=0.002)[14]。腹腔化疗药物对吻合口有直接的影响,腹腔内化疗药物会抑制直肠吻合口愈合过程中再生细胞增殖,从而增加吻合口漏发生率[15]。同时,腹腔化疗可通过增加炎性反应、促进氧化应激和减少吻合口处新生血管的生成,对吻合口愈合产生不利影响[16,17,18]。
本研究发现,29.2%的中位直肠肿瘤患者临时造口无法还纳,造口永久化比例高于高位(21.9%)和低位(13.5%)直肠肿瘤患者。推测这与本组中位直肠肿瘤患者中挽救性造口比例为33.7%,高于高位(29.7%)和低位(20.6%)直肠肿瘤患者有关。虽然本组患者的预防性造口与挽救性造口永久性造口的整体发生率差异没有统计学意义(P=0.989),但挽救性造口还纳的中位时间明显长于预防性造口(5.5个月比4.2个月,P<0.001)。相比于预防性造口患者,挽救性造口患者因为经历了痛苦的术后并发症,从而更加愿意接受造口,对于还纳手术存在犹豫,从而容易错过造口还纳时机。
回肠末端造口和横结肠造口是使用最为广泛的预防性造口方式,两种造口方式各有利弊,但由于回肠末端造口手术和还纳手术相对容易和并发症少,更多的术者推荐优选预防性回肠末端造口[19,20]。本研究发现,横结肠临时性造口永久化发生率明显高于回肠末端临时性造口,推测其原因与回肠末端造口排出物较稀且量多、富含消化酶类,易出现水电解质失衡和腐蚀造口周围正常皮肤有关。对于造口还纳可能性低、预期造口留置时间可能较长的患者,术者更倾向于做横结肠造口。因此,横结肠临时性造口患者术后永久性造口发生率较高。
已有研究认为,直肠癌根治术后出现远处转移是临时性造口永久化的危险因素[21,22]。本研究中,54.1%肿瘤远处转移的患者发生造口永久化,明显高于没有远处转移者的15.1%。多因素分析也提示,术后远处转移是临时性造口永久化的危险因素之一。直肠癌根治术后发生肿瘤远处转移预测长期生存率低,必然影响临时性造口按期还纳。因此,对于术前存在肿瘤远处转移或者有术后发生远处转移的高危患者,需要谨慎考虑造口的选择。此外,有研究报道,局部复发也是导致临时性造口永久化的危险因素之一[12,13]。而本研究未发现此高危因素,这可能与本研究随访时间较短、术后局部复发病例数量相对较少有关。仍需进一步延长随访时间,进行多中心、大样本研究。
经腹直肠癌前切除术后临时性造口的还纳时间一般选择在首次手术后8~12周。此时大多数患者基本上从初次手术后恢复,腹腔内粘连逐渐减轻,造口周围感染和黏膜水肿已明显消退,为造口还纳术提供了有利条件。但有研究表明,造口还纳时间通常会因为术后造口相关并发症及术后化疗而推迟[23]。本研究临时性造口还纳时间中位数为4.5个月,造口还纳时间偏长,推测与本组患者多选择术后辅助化疗有关。
总而言之,经腹直肠癌前切除术预防性造口和挽救性造口存在造口永久化的风险。局部进展期或合并远处转移的直肠恶性肿瘤手术,常因需要术后辅助化疗,造口还纳时间延长,尤其是挽救性造口患者的造口还纳时间更长。外科医师在手术决策时需要谨慎考量临时性造口的可能结果和相关影响因素,以减少临时性造口转为永久性造口的风险。同时,外科医师与患者和家属沟通临时性造口时,需要充分告知临时性造口不能如期还纳的风险和影响造口还纳的危险因素,以减少潜在的医疗隐患。
所有作者均声明不存在利益冲突



























