
探讨胃黏膜相关淋巴组织淋巴瘤的临床特征及预后。
收集2000—2019年北京大学肿瘤医院诊治的胃黏膜相关淋巴组织淋巴瘤患者资料,对其临床特征、治疗方案及效果、预后转归进行回顾性分析。
68例患者的中位年龄为56岁,男女比例为0.6∶1.0。早期患者约占76%(52/68)。最常用的治疗方案为根除幽门螺杆菌治疗,其次为放疗和化疗。总有效率为94%(60/64),其中完全缓解率为72%(46/64)。中位随访44个月,5年无进展生存(PFS)率为73%,总生存(OS)率为83%。预后因素分析显示,白蛋白水平(P=0.011)和国际预后指数(IPI)(P=0.017)是PFS的独立预后指标,白蛋白正常和降低患者的5年PFS率分别为77%和50%,IPI评分<2分和IPI≥2分患者的5年PFS率分别为80%和48%;乳酸脱氢酶(LDH)水平(P=0.016)和白蛋白水平(P=0.025)是OS的独立预后指标,LDH正常和升高患者的5年OS率分别为87%和67%。白蛋白正常和降低患者的5年OS率分别为92%和73%。
胃黏膜相关淋巴组织淋巴瘤对治疗敏感,预后佳,患者白蛋白及LDH水平是独立预后指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
黏膜相关淋巴组织(MALT)淋巴瘤是边缘区B细胞淋巴瘤中最常见的类型,具有特殊的临床、病理、免疫组化及遗传学特征,原发胃肠道MALT最为常见,约占MALT的50%,其中以胃MALT为主,约占85%。本研究对68例原发胃MALT淋巴瘤患者的临床特征及预后进行回顾性分析。
本研究符合《赫尔辛基宣言》原则及相关伦理要求。收集2000年9月至2019年3月在北京肿瘤医院住院诊治的72例胃MALT淋巴瘤患者临床资料,分析临床预后因素。本研究为回顾性队列研究,最终因失访共纳入68例患者。所有病例均经北京大学肿瘤医院病理科明确诊断。
按照2008年世界卫生组织(WHO)淋巴造血组织分型标准[1]。排除首次诊断时病理伴大B细胞转化的患者。胃MALT淋巴瘤分期采用Lugano分期(共分为Ⅰ、Ⅱ、Ⅳ期)[2]。收集的临床资料项目包括:性别,年龄,美国东部肿瘤协作组(ECOG)评分,分期,淋巴瘤国际预后指数(IPI)评分,B症状(发热、盗汗、体重减轻),结外器官累及,幽门螺杆菌(H.pylori)感染,血红蛋白,白蛋白,乳酸脱氢酶(LDH)水平,治疗方案等。以电话访问和门诊复查的方式进行随访,随访截至2019年8月。中位随访时间44个月。按照2014版国际淋巴瘤疗效评价标准[3],分为完全缓解(CR),部分缓解(PR),无反应或疾病稳定(SD)和疾病进展(PD)四种。总生存(OS)期定义为从初诊时间至死亡或末次随访时间。无进展生存(PFS)期定义为从初诊时间至疾病第一次进展/复发或死亡。
数据录入采用Epidata3.0软件,应用SPSS 22.0软件进行分析,采用GraphPad Prism5软件制作生存图。采用独立样本t检验进行两组间比较,两组样本之间率的比较用χ2检验,采用率和频数描述性别、年龄、分期、淋巴结受累情况、生存率等定性资料。生存情况采用Kaplan-Meier方法,预后相关因素用Cox比例-风险模型进行分析。双侧检验,检验水准α=0.05。
纳入原发胃MALT淋巴瘤患者共68例,年龄26~79岁,中位年龄56岁。其中男26例,女42例,男女比例为0.6∶1.0。临床分期Ⅰ~Ⅱ期52例,Ⅳ期16例,早期(Ⅰ~Ⅱ期)患者约占76%(52/68)。43例同时存在淋巴结侵犯,15例有≥2个结外器官累及。15例有B症状。43例H.pylori阳性,3例有LDH升高,5例β2微球蛋白升高。27例合并贫血,其中2例为中度贫血。3例有骨髓侵犯,均无中枢浸润。按照是否H.pylori感染分组,两组在临床特征上差异无统计学意义(表1)。
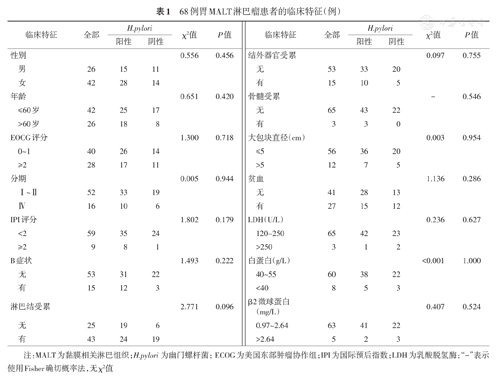
68例胃MALT淋巴瘤患者的临床特征(例)
68例胃MALT淋巴瘤患者的临床特征(例)
| 临床特征 | 全部 | H.pylori | χ2值 | P值 | 临床特征 | 全部 | H.pylori | χ2值 | P值 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 阳性 | 阴性 | 阳性 | 阴性 | ||||||||||
| 性别 | 0.556 | 0.456 | 结外器官受累 | 0.097 | 0.755 | ||||||||
| 男 | 26 | 15 | 11 | 无 | 53 | 33 | 20 | ||||||
| 女 | 42 | 28 | 14 | 有 | 15 | 10 | 5 | ||||||
| 年龄 | 0.651 | 0.420 | 骨髓受累 | - | 0.546 | ||||||||
| ≤60岁 | 42 | 25 | 17 | 无 | 65 | 43 | 22 | ||||||
| >60岁 | 26 | 18 | 8 | 有 | 3 | 3 | 0 | ||||||
| EOCG评分 | 1.300 | 0.718 | 大包块直径(cm) | 0.003 | 0.954 | ||||||||
| 0~1 | 40 | 26 | 14 | ≤5 | 56 | 36 | 20 | ||||||
| ≥2 | 28 | 17 | 11 | >5 | 12 | 7 | 5 | ||||||
| 分期 | 0.005 | 0.944 | 贫血 | 1.136 | 0.286 | ||||||||
| Ⅰ~Ⅱ | 52 | 33 | 19 | 无 | 41 | 28 | 13 | ||||||
| Ⅳ | 16 | 10 | 6 | 有 | 27 | 15 | 12 | ||||||
| IPI评分 | 1.802 | 0.179 | LDH(U/L) | 0.236 | 0.627 | ||||||||
| <2 | 59 | 35 | 24 | 120~250 | 65 | 42 | 23 | ||||||
| ≥2 | 9 | 8 | 1 | >250 | 3 | 1 | 2 | ||||||
| B症状 | 1.493 | 0.222 | 白蛋白(g/L) | <0.001 | 1.000 | ||||||||
| 无 | 53 | 31 | 22 | 40~55 | 60 | 38 | 22 | ||||||
| 有 | 15 | 12 | 3 | <40 | 8 | 5 | 3 | ||||||
| 淋巴结受累 | 2.771 | 0.096 | β2微球蛋白(mg/L) | 0.407 | 0.524 | ||||||||
| 无 | 25 | 19 | 6 | 0.97~2.64 | 63 | 41 | 22 | ||||||
| 有 | 43 | 24 | 19 | >2.64 | 5 | 2 | 3 | ||||||
注:MALT为黏膜相关淋巴组织;H.pylori为幽门螺杆菌;ECOG为美国东部肿瘤协作组;IPI为国际预后指数;LDH为乳酸脱氢酶;"-"表示使用Fisher确切概率法,无χ2值
初始治疗有4例选择观察,10例行单纯H.pylori根除治疗(2例术后患者),51例患者选择含有化疗药物的系统治疗,3例单纯放疗治疗。68例患者中共有43例伴有H.pylori感染,其中5例以消化道并发症起病,治疗方式选择含化疗的系统治疗。68例患者中共有40例进行了H.pylori根除治疗,其中包括2例H.pylori感染情况不详患者。初治治疗疗效如下:总有效率为94%(60/64),其中CR率为72%(46/64)。
H.pylori阴性患者共25例,其中5例患者以消化道并发症起病(上消化道出血4例、肠梗阻1例)、7例患者既往服用过质子泵抑制剂药物治疗(表2)。
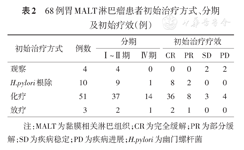
68例胃MALT淋巴瘤患者初始治疗方式、分期及初始疗效(例)
68例胃MALT淋巴瘤患者初始治疗方式、分期及初始疗效(例)
| 初始治疗方式 | 例数 | 分期 | 初始治疗疗效 | ||||
|---|---|---|---|---|---|---|---|
| Ⅰ~Ⅱ期 | Ⅳ期 | CR | PR | SD | PD | ||
| 观察 | 4 | 4 | 0 | 0 | 0 | 2 | 2 |
| H.pylori根除 | 10 | 9 | 1 | 8 | 2 | 0 | 0 |
| 化疗 | 51 | 37 | 14 | 36 | 8 | 3 | 4 |
| 放疗 | 3 | 2 | 1 | 2 | 1 | 0 | 0 |
注:MALT为黏膜相关淋巴组织;CR为完全缓解;PR为部分缓解;SD为疾病稳定;PD为疾病进展;H.pylori为幽门螺杆菌
截至2019年8月,68例患者中有17例出现进展或复发,其中4例一线治疗中出现病情进展,总进展/复发率为25%(17/68)。8例患者死亡,死因均与疾病相关。68例患者的中位PFS和中位OS均未达到,5年PFS率为73%,OS率为83%(图1)。H.pylori阳性患者有43例,H.pylori阳性与阴性者5年PFS率分别为72.9%、73.0%(P=0.624)。H.pylori阳性与阴性者5年OS率分别为82.2%、81.8%(P=0.631)(图2)。H.pylori阳性者行根除治疗与未行根除治疗者比较(分别是38例和5例患者),两组5年OS率分别为82%和80%,差异无统计意义(P=0.655)。H.pylori根除治疗者共40例,与未行H.pylori根除治疗患者相比,5年OS率分别为80%和88%(P=0.483)。
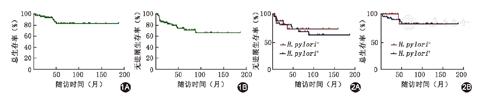

疾病诊断时为早期(Ⅰ~Ⅱ期)的患者52例,占76%(52/68),早期(Ⅰ~Ⅱ期)与晚期(Ⅳ期)患者的5年PFS率分别为83%和39%(P<0.001)。早期患者的中位PFS未达到,晚期患者的中位PFS为48个月。早期和晚期患者的5年OS率分别为82%和88%(P=0.709)。中位OS均未达到。
不同治疗方式比较,患者的OS差异无统计学意义,是否选择含有化疗的方案,患者的5年的PFS率(69%比86%)和OS率(82%比86%)差异无统计学意义(P=0.070、0.600)。分析化疗组患者共51例,比较H.pylori阳性和阴性者,5年的PFS率(68%比69%)和OS率(80%比81%)差异无统计学意义(P=0.430、0.610)。
将以下因素纳入单因素生存分析:年龄、性别、大包块、B症状、IPI评分、分期、淋巴结受累、骨髓受累、LDH水平、β微球蛋白水平、贫血情况、白蛋白水平、是否有H.pylori感染、是否H.pylori根除治疗、初始疗效、是否使用利妥昔单抗、是否结外器官累及、是否放疗及是否手术治疗。单因素生存分析显示:IPI评分、分期、淋巴结受累情况、白蛋白水平、初始治疗疗效及LDH水平对PFS或OS的影响差异有统计学意义(表3)。

68例胃MALT淋巴瘤患者不同单因素组的生存分析比较
68例胃MALT淋巴瘤患者不同单因素组的生存分析比较
| 相关因素 | 例数 | PFS | OS | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 5年PFS(%) | χ2值 | P值 | 5年OS(%) | χ2值 | P值 | |||||
| 年龄(岁) | 0.620 | 0.431 | 1.623 | 0.203 | ||||||
| <60 | 42 | 72 | 90 | |||||||
| ≥60 | 26 | 79 | 74 | |||||||
| 性别 | 0.095 | 0.758 | 0.580 | 0.446 | ||||||
| 男 | 26 | 76 | 89 | |||||||
| 女 | 42 | 72 | 80 | |||||||
| 大包块(cm) | 2.030 | 0.154 | 0.223 | 0.637 | ||||||
| <5 | 56 | 71 | 82 | |||||||
| ≥5 | 12 | 86 | 86 | |||||||
| B症状 | 0.067 | 0.795 | 1.164 | 0.281 | ||||||
| 无 | 53 | 63 | 85 | |||||||
| 有 | 15 | 73 | 76 | |||||||
| IPI评分 | 12.103 | 0.001 | 1.260 | 0.262 | ||||||
| <2 | 59 | 77 | 84 | |||||||
| ≥2 | 9 | 44 | 78 | |||||||
| 分期 | 14.670 | <0.001 | 1.400 | 0.709 | ||||||
| Ⅰ~Ⅱ期 | 52 | 83 | 82 | |||||||
| Ⅳ期 | 16 | 39 | 88 | |||||||
| 淋巴结受累 | 5.810 | 0.016 | 2.074 | 0.150 | ||||||
| 无 | 25 | 96 | 96 | |||||||
| 有 | 43 | 64 | 76 | |||||||
| 骨髓受累 | 0.137 | 0.711 | 0.311 | 0.577 | ||||||
| 无 | 65 | 74 | 82 | |||||||
| 有 | 3 | 67 | - | |||||||
| LDH(U/L) | 2.685 | 0.101 | 9.633 | 0.002 | ||||||
| 120~250 | 65 | 76 | 86 | |||||||
| >250 | 3 | 33 | 33 | |||||||
| β微球蛋白(mg/L) | 0.100 | 0.754 | 0.255 | 0.613 | ||||||
| 0.97~2.64 | 63 | 73 | 83 | |||||||
| >2.64 | 5 | 80 | - | |||||||
| 贫血 | 0.212 | 0.645 | 2.771 | 0.096 | ||||||
| 无 | 41 | 72 | 87 | |||||||
| 有 | 27 | 77 | 76 | |||||||
| 白蛋白(g/L) | 9.018 | 0.003 | 13.422 | <0.001 | ||||||
| 40~55 | 60 | 77 | 88 | |||||||
| <40 | 8 | 50 | - | |||||||
| H.pylori | 0.241 | 0.624 | 0.230 | 0.631 | ||||||
| 阴性 | 25 | 76 | 82 | |||||||
| 阳性 | 43 | 70 | 84 | |||||||
| H.pylori根除治疗 | 0.132 | 0.716 | 0.492 | 0.483 | ||||||
| 无 | 28 | 80 | 87 | |||||||
| 有 | 49 | 67 | 79 | |||||||
| 初始疗效 | 5.543 | 0.019 | 4.635 | 0.031 | ||||||
| 达到CR | 46 | 82 | 89 | |||||||
| 未达CR | 22 | 54 | 71 | |||||||
| 使用利妥昔单抗 | 0.411 | 0.522 | 1.964 | 0.161 | ||||||
| 无 | 44 | 71 | 88 | |||||||
| 有 | 24 | 79 | 71 | |||||||
| 结外器官累及 | 3.686 | 0.055 | 0.374 | 0.541 | ||||||
| 无 | 53 | 72 | 83 | |||||||
| 有 | 15 | 66 | 87 | |||||||
| 放疗 | 0.002 | 0.965 | 0.677 | 0.411 | ||||||
| 无 | 62 | 65 | 84 | |||||||
| 有 | 6 | 80 | 80 | |||||||
| 手术 | 2.608 | 0.106 | 1.132 | 0.287 | ||||||
| 无 | 61 | 79 | 80 | |||||||
| 有 | 7 | 60 | - | |||||||
注:MALT为黏膜相关淋巴组织;PFS为无进展生存率;OS为总生存率;H.pylori为幽门螺杆菌;IPI为国际预后指数;LDH为乳酸脱氢酶;CR为完全缓解;"-"表示因病例数少未统计出具体数值
因分期为IPI组成部分,故将IPI评分、是否有淋巴结受累、白蛋白水平及初始治疗疗效纳入PFS的Cox分析。结果显示,白蛋白水平(P=0.011,HR=5.201)和IPI评分(P=0.017,HR=3.901)是PFS的独立预后指标(图3A、图3B)。白蛋白水平正常患者和白蛋白降低患者,两组的中位PFS分别为42.5个月和11个月,两组5年PFS率分别为77%和50%。IPI评分<2分和IPI≥2分患者,两组的中位PFS分别为36和9个月,两组的5年PFS率分别为80%和48%。将LDH水平、白蛋白水平及初始治疗疗效纳入OS的Cox分析,结果显示LDH水平(P=0.016,HR=9.936)和白蛋白水平(P=0.025,HR=9.591)是OS的独立预后指标(图3C、图3D)。LDH正常和升高患者,两组的中位OS分别为45和42个月,两组的5年OS率分别为87%和67%。白蛋白水平正常患者和白蛋白降低患者,两组的中位OS分别为50.5和28个月,两组的5年OS率分别为92%和73%。
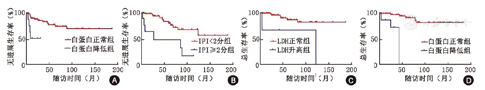

注:IPI为国际预后指数;LDH为乳酸脱氢酶;白蛋白参考值为40~55 g/L;LDH参考值为120~250 U/L
MALT淋巴瘤是一种惰性淋巴瘤,2011至2012年间美国MALT淋巴瘤的发病率约为1.1/10万[4]。MALT淋巴瘤来源于成熟B淋巴细胞,可能累及每个器官[5],MALT淋巴瘤也是原发胃的淋巴瘤的最常见的病理类型[6]。
MALT淋巴瘤多见于中老年人,临床表现常以消化道症状多见[7]。本研究中,患者中位年龄56岁,多数处于疾病早期。目前认为H.pylori感染和胃MALT淋巴瘤密切相关,胃部黏膜经历慢性炎症、基因易位、转录因子的改变[8],从开始依赖H.pylori产生细胞学改变,到基因遗传学改变后形成不依赖于H.pylori的淋巴瘤[9]。因此欧洲肿瘤内科学会(ESMO)推荐诊断胃部MALT淋巴瘤需进行H.pylori检测,若无胃镜组织学确定,需通过13C或14C尿素呼气试验、H.pylori血清学抗体或粪便H.pylori抗原检测来排除[10]。本研究中H.pylori感染率为63%(43/68),H.pylori阴性组患者比例较高,追溯病史发现该组有32%(7/25)患者既往使用过质子泵抑制剂治疗,同时发现该组与H.pylori阳性组相比临床特征差异无统计学意义。这个结果与部分研究数据相符,考虑与前期药物应用相关[11],或者是因为细菌感染量低或感染其他病原体。
治疗MALT淋巴瘤的方式有H.pylori根除治疗、放疗、手术、化疗及免疫治疗。本研究中88%(38/43)H.pylori阳性患者均进行了H.pylori根除治疗,总生存无明显区别,其中74%(28/38)患者进行了含化疗的联合治疗,可能与以下因素相关[12]:疾病分期晚、病灶位于胃部远端或浸润胃壁较深、合并染色体易位。既往研究[13]显示在根除H.pylori后5和10年的无病生存率分别为90.5%和79.1%。因此一线推荐H.pylori阳性患者行H.pylori根除治疗[14]。有研究发现,中药在H.pylori根除治疗中有一定疗效[15]。手术治疗与否在本组患者中总体生存差异无统计学意义,与既往研究相同,手术不能改善胃MALT淋巴瘤患者的预后[16],胃MALT淋巴瘤患者的OS不能从手术中获益。当合并消化道出血、幽门狭窄或穿孔等并发症时,通常手术是必要的,单纯手术已不是胃MALT淋巴瘤的一线治疗方法[17]。
对于早期患者,行H.pylori根除治疗失败或H.pylori感染阴性者,推荐局部放疗,德国胃肠道淋巴瘤研究小组发现,早期(Ⅰ~Ⅱ期)胃MALT淋巴瘤局部放疗,5年OS率为92.7%[18]。一项对于27例Ⅰ期患者给予局部放疗治疗的研究[19],中位随访121个月,10年OS率为87%,说明对于局限性胃MALT淋巴瘤可以得到良好的长期局部控制,后需密切随访,警惕远处转移。本组患者中仅有3例患者选择了放疗治疗,放疗患者比例较低,大部分与患者合并远处淋巴结转移相关,少部分患者考虑放疗局部不良反应选择化疗及免疫治疗。晚期患者或一线治疗失败早期患者的治疗方案更注重个体化,尚无诊疗共识,缺乏最佳治疗方案,利妥昔单抗联合化疗是最常用的治疗模式。在本组研究中共有52例患者选择了化疗或联合化疗的综合方案,但是否化疗、是否选择利妥昔单抗及不同化疗方案之间比较,患者的长期生存差异无统计学意义,化疗组患者与其他患者比较,5年PFS和5年OS有较低的趋势,可能与化疗组晚期患者比例较高相关(14/51,2/16)。
惰性淋巴瘤进入了无化疗时代,本研究中,仅有2例患者单药利妥昔单抗治疗,均获得CR,一项Ⅱ期临床试验显示,依布替尼单药对于复发难治MALT淋巴瘤有一定效果,总体缓解率48%,中位PFS为14.2个月[20]。其他免疫制剂也显示出一定的疗效[21]。一项长期随访数据显示[22]:中位随访时间68个月,单药来那度胺最多6个周期或联合利妥昔单抗最多8个周期,对于MALT淋巴瘤整体总体反应率为74%,PFS为72个月,5年OS率为92%,并且发现部分病例开始为PR,12至32个月后也达到了CR。因此,随着对于MALT淋巴瘤病因病理及分子免疫更深入的探索,未来有更多的靶向治疗,从而减少化疗的不良反应。
国际结外淋巴瘤研究小组(IELSG)使用一项大型前瞻性随机试验的400多例患者的数据,开发了结外MALT淋巴瘤的特异性预后指数,称为MALT-IPI,包含3个临床参数:年龄≥70岁、分期为晚期、LDH升高[23]。本研究显示,多个因素中,白蛋白水平和IPI评分是PFS的独立预后指标,白蛋白水平和LDH水平是OS的独立预后指标。该结论与前期报道的MALT淋巴瘤患者的预后分析相同,对于低蛋白患者给予更好的营养支持可能会改善患者生存[24]。国内有研究报道,初始治疗疗效也是OS的独立预后指标[25]。对于首次治疗疗效未达到CR的患者应给予更积极的治疗。在胃MALT淋巴瘤,一线治疗后缓解的深度是PFS的独立预后指标[26]。因此在初始治疗时,建议进行更多危险分层评估预后,对于合并不良预后因素患者给予更积极个体化治疗,以提高疗效。
所有作者均声明不存在利益冲突



























