
目前,新型冠状病毒肺炎的主要治疗手段虽然仍是传统的抗病毒、抗炎、对症和支持治疗等,但是多种针对机体过度炎症反应的免疫治疗研究也都在积极进行中。其中间充质干细胞作为重要的免疫调节效应细胞,有助于减轻肺脏炎症,促进肺组织修复,有望在新型冠状病毒肺炎救治中发挥重要作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新型冠状病毒肺炎(COVID-19)传染性强,临床表现有较大差异,根据疾病的严重程度分为轻型、普通型、重型和危重型,主要临床表现为发热、咳嗽、乏力、肌肉疼痛和腹泻,尤其是重型和危重型患者的影像学检查显示肺部病变明显,严重时可导致呼吸窘迫,甚至是多脏器功能衰竭[1]。试行新版诊疗指南推荐的抗病毒、抗炎、对症和支持治疗仍是临床应对COVID-19的主要方案[2]。就抗炎治疗而言,对于多数因错过最佳救治时机而进展为重症肺炎的患者,糖皮质激素治疗是实现有效控制肺部炎性渗出的方案之一。但大剂量、长时间糖皮质激素使用后的不良反应(如股骨头坏死等)通常对患者的长期预后产生不可逆的影响。此外,即使重症患者得到成功救治,肺部炎性损伤后期也会被纤维组织修复,如何减轻肺脏的炎性损伤、降低肺部纤维化程度、改善肺功能和患者的长期预后是临床关注的又一问题。国内外研究表明,间充质干细胞(mesenchymal stem cells, MSC)能有效调节机体免疫应答,减轻重要脏器(包括肝脏、肺等)的炎症和损伤,促进内皮细胞修复,抑制纤维化形成,有望成为治疗COVID-19的重要手段[3,4]。现将有关进展和问题进行综述。
随着对COVID-19认识的深入,病毒感染引起重症肺损伤的病理学变化正在被不断揭示。最新研究显示,病毒感染后的肺部病变主要由两部分原因造成:一是病毒复制直接导致的弥漫性肺泡损伤,肺泡细胞肿胀、坏死、脱落,导致肺泡上皮细胞损伤[5,6];二是机体免疫系统的抗病毒免疫反应,主要表现为肺泡腔内纤维素性渗出物聚集、巨噬细胞和淋巴细胞浸润,肺泡间质淋巴细胞浸润,导致肺泡间隔毛细血管通透性增加,肺透明膜形成,肺泡壁和呼吸性细支气管管壁纤维素性坏死[5]。临床表现为肺泡气体交换障碍、氧分压降低、急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)等。除肺的局部性病理改变外,COVID-19患者尤其是重症患者外周血中淋巴细胞亚群及血浆细胞因子水平也发生了显著性的变化[7]。表现为白细胞、中性粒细胞、IL-6、IL-10、IL-2、IL-4、TNF-α、γ干扰素水平持续升高,而淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、B淋巴细胞、自然杀伤细胞数量显著减少。中性粒细胞/CD8+T淋巴细胞比值和中性粒细胞/淋巴细胞比值对患者是否向重症发展有重要的预测价值。另外,与健康对照者相比,来自COVID-19患者的T淋巴细胞表面程序性死亡蛋白-1(programmed death-1,PD-1)分子水平明显更高,随着患者从窗口期向明显症状期发展,T淋巴细胞表面PD-1和T细胞免疫球蛋白功能区-3(T cell immunoglobulin domain, Tim-3)分子表达显著增加,且随着疾病进程的发展,患者机体T淋巴细胞耗竭进一步加剧[8]。综上所述,COVID-19患者不仅存在局部肺的炎性损伤,而且机体过度的免疫活化和免疫耗竭也参与了疾病的重症化进程。
2019新型冠状病毒(2019 novel coronavirus,2019-nCoV)感染人体后主要存在3个方面的问题:一是病毒持续存在,二是免疫系统失衡,三是肺部组织损伤。针对这3个问题,临床治疗的主要方法是抗病毒治疗、免疫调节治疗和对症支持治疗。
在抗病毒治疗方面,由于2019-nCoV属于新发病毒,目前尚无特效的抗病毒药物,根据以往严重急性呼吸综合征和中东呼吸综合征的临床研究结果来看,可能的抗病毒药物包括洛匹那韦(lopinavir)/利托那韦(ritonavir)、NAs、干扰素等[9,10]。洛匹那韦/利托那韦是一种蛋白酶抑制剂,常用于治疗HIV-1感染。临床研究发现,洛匹那韦/利托那韦能一定程度抑制2019-nCoV的复制[11]。其他的抗病毒药物如法匹拉韦、瑞德西韦、利巴韦林、β干扰素、阿比多尔、特力阿扎维林等的临床研究也正在进行中。另外,传统的抗疟药物磷酸氯喹也显示出对2019-nCoV的良好抑制效果[12]。
在免疫调节治疗方面,如何恢复免疫系统平衡、遏制炎症细胞的聚集性浸润、减少细胞因子风暴效应的发生率、缓解细胞因子风暴的强度是治疗的重点和难点。主要的治疗手段包括:①临床上多采用糖皮质激素来减轻炎症反应和肺部损伤。但最新研究表明,在中东呼吸综合征和严重急性呼吸综合征的治疗过程中,糖皮质激素的冲击治疗对因病毒复制导致的弥漫性肺泡损伤并未显示出良好的控制效果,且大剂量、长时间应用存在加重感染、股骨头坏死等药物不良反应[13]。目前,关于糖皮质激素的应用窗口期、剂量、时长等仍在优化中。②针对炎性因子风暴效应[14,15,16],IL-1家族阻断剂、抗IL-6抗体、抗TNF-α和核苷酸寡聚化结构域样受体家族3(nucleotide binding oligomerization domain-like receptors 3, NLRP3)通路抑制剂等也正在被尝试应用于COVID-19的临床治疗,但是临床疗效还不确定。③针对系统性免疫耗竭与紊乱,也有临床研究利用抗PD-1单克隆抗体等免疫检查点抑制剂来逆转COVID-19的免疫耗竭,以实现免疫重建[17]。但因存在间接诱发细胞因子风暴发生和直接诱发致命性肺损伤的风险,大大降低了临床应用的安全性。④基于已治愈患者的血浆被动性转移治疗也成为目前有效控制病毒复制、短期内迅速改善症状的重要手段。另外,大剂量的维生素C对提高机体抗感染能力也有一定促进效果。
在对症支持治疗方面,COVID-19从轻型到重型,再到危重型,都有可能快速进展,对于重型和危重型患者,基于肺脏组织的病理改变,应尽快清理气道、呼吸性细支气管和肺泡内坏死、渗出物,从而直接改善患者的通气功能,有助于肺功能的重建恢复,缓解患者ARDS的症状,缩短病程。但目前最大的困难是无法确定不清楚患者病情何时会突然恶化,也无成熟的针对性治疗方法。
值得一提的是,传统的中医和中药治疗在此次COVID-19的预防和救治环节中发挥了重要作用。前期研究显示,以扶正为本的中医药合理应用有助于减轻咳嗽、乏力等症状,缩短发热时间,降低从普通型肺炎向重型和危重型转化的比例[18]。
MSC是一群起源于中胚层的多能干细胞,具有自我更新、多向分化和免疫调控潜能。自1966年被发现后,因其多潜能和可扩增性对再生医学产生了不可估量的影响。传统理论认为,这群细胞在特定诱导条件下可向3种组织细胞即骨、软骨和脂肪细胞分化,然而目前发现,MSC具有向多种细胞包括肌腱、韧带、肝细胞、心肌细胞和骨髓基质等分化发育的潜能。在细胞治疗、组织工程和再生医学领域内,MSC作为种子细胞可用于修复/替代受伤或病变的多种组织器官,为一些无法有效治愈的重大疾病如急性移植物抗宿主病、多发性硬化、阿尔茨海默病、帕金森病等提供新的治疗方案[19]。MSC具有低免疫原性,以及显著和广泛的免疫调节功能。因其不表达CD40、CD80、CD86等共刺激分子和主要组织相容性复合体(major histocompatibility complex, MHC)Ⅱ类分子,故引起免疫排斥反应的可能性极小,同时其对免疫细胞的调节效应不受MHC分子的限制,即对自体和异体的免疫细胞都可发挥免疫调节效应[20]。MSC作为一种新型的免疫治疗方案,还具有良好的免疫调节作用和强大的抗炎特性,其可通过感知炎症信号(细胞因子/趋化因子受体和整合素的表达)迁移至炎症部位,通过直接接触和旁分泌效应发挥作用。如MSC可依赖细胞间的直接接触或细胞因子的依赖方式,对T淋巴细胞、B淋巴细胞、自然杀伤细胞、DC等的增殖、分化和抗体产生等发挥调控效应。表现为抑制T淋巴细胞的活化增殖,抑制B淋巴细胞的抗体分泌,抑制DC的成熟,抑制自然杀伤细胞的杀伤功能,促进Treg的转化和增殖等[21,22]。在MSC进入机体被免疫细胞吞噬清除后,仍具有诱发吞噬细胞分泌IL-10、TGF-β、IDO等免疫调控效应分子的能力。提示其从进入机体到被机体清除的过程中,分别以"主动"和"被动"的方式全程参与对免疫反应的调控。
2019-nCoV感染导致肺上皮细胞和内皮细胞凋亡,且诱导免疫细胞在肺部聚集和过度活化。MSC向肺损伤部位迁移,分化为正常的肺泡上皮细胞修复屏障功能,调节上皮细胞功能以促进肺泡内液体的清除,发挥免疫调节功能以抑制炎性因子风暴,最终促进损伤肺组织的修复,见图1[23,24,25,26]。
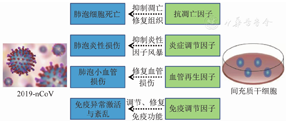

注:2019-nCoV为2019新型冠状病毒
研究显示外周静脉输入MSC后,短期内大部分MSC滞留于肺部,表现为注射1 h后50%~60%的MSC滞留于肺部,3 h后降至30%,并可维持96 h[27],后期会随着血流分布到肝脏、肾脏、脾脏等器官。MSC的肺部潴留特性为其在肺局部短期内迅速发挥免疫调控功能提供了时间和空间上的便利。MSC在多种肺损伤和ARDS动物模型(化学药物、感染、机械性和放射性损伤等)中显示出减轻肺部炎症、减轻肺水肿、减少肺损伤和降低动物死亡率的治疗效果。表现为:①在大肠埃希菌诱导的急性肺损伤(acute lung injury,ALI)模型中,不论在早期还是晚期进行MSC干预,均显示出提高氧合指数、减轻炎症和组织损伤、降低细菌浓度的效果[28]。②在内毒素致小鼠ALI模型中,MSC可向肺损伤部位迁移,分化为正常的肺泡上皮细胞及肺毛细血管内皮细胞,恢复其完整的屏障功能,终止肺部结构改变,磷酸肌醇3-激酶(phosphatidylinositide 3-kinase, PI-3K)途径诱导DC向耐受性DC分化是MSC减轻肺部炎性损伤的重要机制[29,30]。③在博来霉素诱发的肺纤维化模型中,MSC显示出比吡非尼酮更好的抗纤维化效果,MSC的抗纤维化效应与有效降低半胱氨酸蛋白酶-3诱导的肺泡细胞凋亡密切相关[31]。④在高氧诱导的支气管肺发育不良模型中,MSC来源的外泌体能有效改善肺泡结构的单一性和纤维化,促进呼吸血管的重塑[32]。
目前,全世界已开展多项MSC临床研究用于治疗病毒、细菌等原因诱发的ALI、重症肺炎、ARDS、呼吸衰竭等呼吸系统疾病。其中MSC治疗ARDS的临床研究项目最多,入组患者多为危重型呼吸衰竭患者,需要机械辅助通气[33,34,35]。MSC来源包括骨髓、脐带、脂肪和功能性子宫出血组织等,输注的剂量从5×105/kg至4×108/kg不等,输注途径以外周静脉为主,入组患者最少9例,最多120例[36]。初步结果显示安全性良好,无明显不良反应,在肺部炎性渗出极其明显的阶段,MSC治疗在一定程度上改善了患者的氧合指数,降低了肺部的炎性损伤,提示其对ARDS有一定的控制作用(表1)。如将MSC的临床介入时间点前移,在肺泡上皮细胞及肺毛细血管内皮细胞尚未完全被破坏,炎性渗出的面积尚未严重影响到肺部呼吸功能时,MSC与常规内科治疗的联合应用是否有助于有效控制肺部炎症反应,改善肺泡的物理结构和通气功能,还需要大量的临床研究加以证实。

间充质干细胞治疗急性呼吸窘迫综合征的临床试验项目
间充质干细胞治疗急性呼吸窘迫综合征的临床试验项目
| 临床注册编号 | 国家 | 细胞类型 | 剂量 | 回输途径 | 随访时间 | 患者例数 |
|---|---|---|---|---|---|---|
| NCT01902082 | 中国 | 脂肪间充质干细胞 | 1×106/kg | 静脉回输 | 7 d | 12 |
| NCT01775774 | 美国 | 骨髓间充质干细胞 | 1×106/kg,5×106/kg,10×106/kg | 静脉回输 | 12个月 | 9 |
| NCT02097641 | 美国 | 骨髓间充质干细胞 | 1×107/kg | 静脉回输 | 12个月 | 60 |
| NCT02444455 | 中国 | 脐带间充质干细胞 | 每天5×105/kg | 静脉回输 | 14 d | 20 |
| NCT02112500 | 韩国 | 骨髓间充质干细胞 | 未报道 | 静脉回输 | 28 d | 10 |
| NCT02215811 | 瑞典 | 骨髓间充质干细胞 | 未报道 | 未报道 | 12个月 | 10 |
| NCT02095444 | 中国 | 功能性子宫出血间充质干细胞 | 每周1×107/kg | 静脉回输 | 14 d | 20 |
| NCT02611609 | 英国 | MultiStem® | 未报道 | 未报道 | 12个月 | 36 |
| NCT03042143 | 英国 | CD362富集的脐带间充质干细胞 | 1×108/kg,2×108/kg,4×108/kg | 静脉回输 | 14 d | 75 |
| NCT02804945 | 美国 | 骨髓间充质干细胞 | 3×106/kg | 静脉回输 | 60 d | 50 |
| NCT03608592 | 中国 | 脐带间充质干细胞 | 60×106/kg | 静脉回输 | 28 d | 12 |
| NCT03818854 | 美国 | 骨髓间充质干细胞 | 1×107/kg | 静脉回输 | 60 d | 120 |
除ARDS外,已开展了多项MSC用于特发性和放射性损伤原因引起肺纤维化的临床研究(ClinicalTrail注册项目)[37](表2)。其中MSC来源包括骨髓、脐带、脂肪和胎盘组织,输注途径同样以外周静脉为主,入组患者最少8例,最多60例,随访时间为6~12个月不等[3]。肺纤维化被称为"不是癌症的癌症",病情不断恶化后会危及患者生命。目前还无特异性的治疗药物。虽然氧疗、机械通气、肺康复等有助于缓解因肺功能损伤导致的呼吸窘迫症状,但是对于急性进展期的肺纤维化患者,肺移植是唯一有效的备选方案。而肺移植1年生存率为70%, 5年生存率仅20%[38,39]。MSC治疗肺纤维化的初步结果显示:患者的耐受性良好,细胞治疗未加重纤维化进程,6个月后各项肺功能指标较为稳定,无明显进展。

间充质干细胞治疗肺纤维化的临床试验项目
间充质干细胞治疗肺纤维化的临床试验项目
| 临床注册编号 | 国家 | 细胞来源 | 剂量 | 回输途径 | 随访时间(月) | 患者例数 |
|---|---|---|---|---|---|---|
| NCT01385644 | 澳大利亚 | 胎盘 | 1×106/kg,2×106/kg | 静脉 | 6 | 8 |
| NCT02135380 | 印度 | 脂肪 | 2×106/kg | 静脉 | 9 | 60 |
| NCT02277145 | 中国 | 脐带 | 1×106/kg | 经纤维支气管镜注射 | 6 | 10 |
| NCT01919827 | 西班牙 | 骨髓 | 未报道 | 静脉回输 | 12 | 17 |
| NCT02594839 | 俄罗斯 | 骨髓 | 每次2×108/kg | 静脉回输 | 12 | 20 |
| NCT03187431 | 埃及 | 骨髓 | 未报道 | 未报道 | 12 | 12 |
在此次应对COVID-19疫情过程中,由王福生院士和周琪院士领衔的"干细胞治疗COVID-19的临床研究"项目得到了国家"公共安全风险防控与应急技术装备"重点专项的支持。在疾病的应急治疗上,干细胞被赋予了希望。但是关于干细胞治疗介入的时间窗口期、回输剂量和疗程、后期疗效的评价指标,目前还无统一的标准,因此所有的项目都处于临床研究阶段。另外,因MSC来源(脐带、骨髓、脐血、脂肪、牙髓、功能性子宫出血等)广泛,剂型(冻存、新鲜)多样,且输注途径(外周血静脉输注、局部注射等)不同,与糖皮质激素等其他药物的联合使用是否存在禁忌等,以上多个环节都不完全清楚[40,41]。因此,如何在肺部炎性渗出明显的阶段保证治疗的安全性是关注的重点。虽然前期国家卫生健康委员会对备案项目中涉及的相关内容进行了详细的情况说明,但是在临床注册网站上仍能看到一些不具备临床研究资质的项目在申请过程中,说明在监管层面上,在哪些临床机构开展、如何监管等问题同样不容忽视。
目前,COVID-19是严重影响我国国民健康和经济发展的突发性公共卫生事件,由于缺乏有效的抗病毒药物,以及现有治疗手段的局限与不良反应,所以危重型COVID-19患者的治疗仍充满挑战,亟需探索新的有效治疗方法以提高临床危重型患者的救治率,减少其病死率,改善其长期预后。在COVID-19重症化的进程中,除了肺部的局部炎性损伤外,机体的系统性免疫活化、T淋巴细胞的过度消耗、炎性因子风暴效应的产生同时存在,提示COVID-19不仅仅是病毒感染性疾病,而且同时是免疫系统疾病,在疾病的治疗策略上应包括靶向抗病毒治疗和靶向宿主免疫系统的治疗。截至投稿日期,有近200项临床研究在中国临床研究网站上进行了注册,包括多种抗病毒药物、免疫调节药物,以及中医、中药的治疗方案正在积极推进中,临床疗效尚需要验证。现阶段如何在有限的时间窗口内,对有重症化倾向、高死亡风险的病例及时进行免疫干预也是关注的重点。MSC的免疫调控效应具有普适性,不论是细菌感染还是甲型H1N1流行性感冒,或是H5N1、H7N9禽流感,MSC均可发挥免疫调控效应。表现为抑制免疫反应,消除炎症,潜在地保护肺支气管上皮细胞和内皮细胞以避免凋亡,稳定肺微血管和肺泡上皮细胞屏障,减轻肺组织纤维化等,因此MSC有望成为COVID-19诱发重症肺部炎症和纤维化损伤的重要治疗手段。
所有作者均声明不存在利益冲突



























