
评估肿瘤细胞减灭术(CRS)联合腹腔热灌注化疗(HIPEC)作为首选方案治疗晚期卵巢癌的临床疗效和安全性。
回顾性分析2007年12月至2019年11月首都医科大学附属北京世纪坛医院收治的国际妇产科协会(FIGO)ⅢC~Ⅳ期卵巢癌、以CRS+HIPEC作为首选治疗方案并具有完整临床资料的患者。采用Kaplan-Meier法分析生存情况,Cox回归模型分析预后因素,主要终点为中位总生存(mOS)时间和中位无进展生存(mPFS),次要终点为围术期安全性。
100例晚期卵巢癌患者入组,中位随访时间18.4个月,生存75例(75.0%),死亡25例(25.0%),mOS时间为87.6个月(95% CI 72.1~103.1个月),1、2、3、4、5年生存率分别为94.1%、77.2%、68.2%、64.2%和64.2%。单因素分析显示,年龄≤58岁(P=0.023)、Karnofsky评分≥80分(P=0.026)、腹腔积液量≤1 000 ml(P=0.041)、腹膜癌指数(PCI)评分<19分(P=0.044)和肿瘤细胞减灭程度(CC)评分0~1分(P=0.001)者预后较好。多因素分析显示,CC评分0~1分为独立预后因素,CC评分2~3分者死亡风险为CC评分0~1分者的3.2倍(HR=3.2,95% CI 1.4~7.6,P=0.008);CC评分0~1分者mPFS时间为23.3个月(95% CI 0~50.7个月)。围术期Ⅲ~Ⅳ级不良事件发生率和死亡率分别为4.0%(4/100)和2.0%(2/100)。
CRS+HIPEC可有效延长晚期卵巢癌患者生存期,且安全性较好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
80%卵巢癌患者初诊时已合并腹膜转移[1],表现为大网膜、腹膜及肠系膜表面弥漫分布大小不等的肿瘤结节,导致难治性腹腔积液、进行性肠梗阻和顽固性腹痛[2]。减瘤术联合铂类加紫杉烷类辅助化疗为传统治疗模式,5年生存率不足30%[3,4]。肿瘤细胞减灭术(CRS)加腹腔热灌注化疗(HIPEC)可以尽可能切除腹盆腔内所有肉眼可见病灶,同时利用HIPEC、大容量液体灌洗作用,以及热疗和化疗的协同作用清除微癌灶和游离癌细胞[5],为国际妇产科协会(FIGO)Ⅲ期卵巢癌推荐治疗方案[6]。但其疗效、安全性、患者选择和规范化操作仍需进一步明确。本研究旨在分析100例接受CRS+HIPEC作为一线方案治疗的晚期卵巢癌患者的临床疗效和安全性。
回顾性分析2007年12月至2019年11月在我院以CRS+HIPEC作为一线治疗方案、有完整随访信息的100例FIGOⅢC~Ⅳ期卵巢癌患者的临床资料。所有患者均签署知情同意书,研究方案获我院伦理委员会批准[批准文号:2019年科研伦审第(73)号]。
纳入标准:(1)术前无腹膜癌相关手术史;(2)外周血白细胞计数≥3.5×109/L,血小板计数≥125×109/L;(3)血清胆红素、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)水平<2×正常上限(ULN);(4)心肺功能可耐受手术;(5)Karnofsky评分≥50分。排除标准:(1)有腹膜癌相关手术史;(2)血清胆红素、AST、ALT≥2×ULN;(3)血肌酐≥1.2×ULN;(4)影像学检查显示肠系膜明显挛缩;(5)Karnofsky评分<50分;(6)未达到FIGO ⅢC~Ⅳ期。
患者评估根据CRS+HIPEC专家共识:(1)肿瘤标志物,如癌胚抗原、糖类抗原(CA)199、CA125;(2)胸腹盆腔CT增强扫描+三维重建明确肿瘤分布情况,胃肠道造影明确小肠运动及肠系膜受累情况;(3)腹腔积液或腹腔冲洗液脱落细胞学病理检查[7]。
CRS+HIPEC由包括麻醉医师、肿瘤外科医师、手术室护理人员的腹膜癌治疗专科团队实施。患者取大字平卧位,取剑突至耻骨联合的长正中切口,自膈肌腹膜到盆腔腹膜全面探查肿瘤侵袭程度及腹膜癌范围,记录腹腔积液量、原发瘤和(或)转移瘤大小、部位,进行腹膜癌指数(PCI)评分[5]。行最大程度CRS,包括原发肿瘤的根治性或姑息性切除,受侵组织的切除,淋巴结清扫,腹膜剥除,并行肿瘤细胞减灭程度(CC)评分[5]。
CRS结束后行开放式HIPEC,每种药物加入3 L 0.9% NaCl溶液,加热至(43±0.5)℃,以400 ml/min的流速,每种药物持续循环灌注30 min。HIPEC药物方案包括:顺铂120 mg+丝裂霉素C 30 mg、多西他赛120 mg+顺铂120 mg,具有肾损伤高危因素的患者多选择多西他赛120 mg+丝裂霉素C 30 mg,单肾损伤或实验室检查证实存在可接受范围肾损伤患者仅选择多西他赛120 mg。HIPEC结束后进行消化道、泌尿系等重建,术后返回重症病房。
术后患者完成6~8个周期全身联合腹腔化疗,方案为铂类联合紫杉烷类药物为主;靶向治疗药物主要是抗肿瘤血管生成药物如贝伐珠单抗、阿帕替尼、雷珠单抗等;伴有淋巴结转移或盆腔残余瘤较大者可行盆腔放疗。
所有患者均行门诊或电话随访,前2年每3个月复查1次,2~5年每半年复查1次,5年后每年复查1次。随访截至2019年11月17日,随访率为100%。
(1)不良事件:Ⅲ~Ⅴ级为严重不良事件(SAE);(2)中位总生存(mOS)时间:确诊为FIGO ⅢC~Ⅳ期卵巢癌至卵巢癌相关死亡或随访截止时间;(3)中位无进展生存(mPFS)时间:行CRS+HIPEC当日至疾病进展,包括临床症状复现或加重和(或)CA125升高和(或)影像学显示转移灶和(或)病理学诊断复发。(4)围术期:CRS+HIPEC手术当日至术后30 d;(5)PCI评分:将腹部分成13个区,包括腹腔9个区及回肠上段、回肠下段、空肠上段和空肠下段4个区。对每个区的肿瘤负荷进行评分,0分为无可见癌组织,1分为肿瘤长径<0.5 cm,2分为肿瘤长径0.5~5.0 cm,3分为肿瘤长径>5.0 cm或融合,总分39分[5]。(6)CC评分:0分为无残余瘤;1分为残余肿瘤长径<2.5 mm,2分为残余肿瘤长径2.5~25.0 mm,3分为残余肿瘤长径>25.0 mm或残留无法切除或姑息切除病灶;CC评分0~1分为肿瘤细胞减灭满意,CC评分2~3分为肿瘤细胞减灭不满意[5]。
采用SPSS 24.0软件进行统计学分析。非正态分布的计量资料以中位数(范围)表示;采用Kaplan-Meier法进行生存分析;采用Cox回归模型分析预后影响因素,单因素分析结果提示P<0.10的因素纳入多因素分析模型。以P<0.05为差异有统计学意义。
100例FIGO ⅢC~Ⅳ期卵巢癌患者共行106次CRS+HIPEC,其中6例因复发接受二次CRS+HIPEC。中位年龄58.5岁(28~87岁),中位Karnofsky评分为80分(50~100分),病理类型为浆液性癌91例(91.0%),其他类型9例(9.0%),腹腔积液量270 ml(0~8 000 ml),中位PCI评分19分(3~39分),中位CC评分1分(0~3分),中位脏器切除区域数4个(3~9个),中位腹膜切除区域数4个(1~9个),吻合数1个(0~4个)。术前行系统化疗者48例(48.0%)、腹腔化疗者16例(16.0%),术后行系统化疗者76例(76.0%)、腹腔化疗者46例(46.0%),术后系统化疗中位周期数4个(1~26个),术后腹腔化疗中位周期数0个(0~8个),CRS+HIPEC中位手术时间600 min(80~910 min),住院天数27 d(0~120 d)。
中位随访18.4个月(0.8~147.7个月),25例(25.0%)死亡,75例(75.0%)生存,mOS时间87.6个月(95%CI 65.7~109.5个月),1、2、3、4、5年生存率分别为94.1%、77.2%、68.2%、64.2%和64.2%(图1A)。
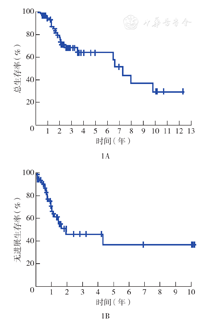

79例(79.0%)患者CC评分达0~1分,mOS时间为95.2个月(95%CI 44.4~146.0个月),1、2、3、4、5年生存率分别为95.4%、84.1%、78.7%、73.8%和73.8%;mPFS时间为23.3个月(95%CI 0~50.7个月)(图1B)。4例(4.0%)患者OS时间超过10年,术后无复发,生存期分别为147.7、128.5、121.5、120.8个月。
单因素分析结果显示,年龄、Karnofsky评分、腹腔积液量、PCI评分、CC评分均与患者预后相关(均P<0.05)(表1)。多因素分析结果显示,CC评分0~1分为独立预后因素,CC评分2~3分者死亡风险为CC评分0~1分者的3.2倍(HR=3.2,95%CI 1.4~7.6,P=0.008)。

100例晚期卵巢癌患者预后影响因素Cox单因素分析结果
100例晚期卵巢癌患者预后影响因素Cox单因素分析结果
| 变量 | HR(95%CI) | P值 |
|---|---|---|
| CC评分(0~1分比2~3分) | 3.2(1.8~9.8) | 0.001 |
| 年龄(≤58岁比>58岁) | 2.7(1.1~6.5) | 0.023 |
| Karnofsky评分(<80分比≥80分) | 0.3(0.1~0.9) | 0.026 |
| PCI评分(≤19分比>19分) | 2.5(1.0~6.0) | 0.044 |
| 腹腔积液量(≤1 000 ml比>1 000 ml) | 2.3(1.0~5.0) | 0.041 |
注:CC为肿瘤细胞减灭程度;PCI为腹膜癌指数
围术期共31例(31.0%)发生Ⅰ~Ⅴ级不良事件,其中贫血5例(5.0%),呼吸系统感染4例(4.0%),尿漏4例(4.0%),肠梗阻4例(4.0%),静脉血栓形成3例(3.0%),切口感染3例(3.0%),肾功能不全2例(2.0%),泌尿系统感染2例(2.0%)。发生Ⅲ~Ⅴ级不良事件的4例(4.0%)患者中,术后30 d内因肾衰竭死亡2例(2.0%),出血1例,肠漏1例。
腹膜转移是晚期卵巢癌的自然病程结局,以满意减瘤术辅以铂类加紫杉烷类为主的系统化疗治疗后复发率高、预后差。国内外研究显示,部分腹膜转移是区域癌转移,因此发展了以CRS+HIPEC为核心的治疗新策略,已成为腹膜恶性间皮瘤、腹膜假黏液瘤、结直肠癌腹膜转移的标准治疗策略[8,9],近年来CRS+HIPEC在晚期卵巢癌中的临床疗效亦取得了高级别循证医学证据支持[10,11],并于2019年被纳入FIGO Ⅲ期卵巢癌的推荐治疗。本研究中以CRS+HIPEC作为首选治疗方式的100例FIGO ⅢC~Ⅳ期晚期卵巢癌患者,2007年至2010年收治12例,2011年至2015年收治23例,2016年至2019年收治65例。对于患者选择、化疗方案制订、手术操作规范和安全性,尚需更多临床研究证据。
本研究结果示,100例FIGO ⅢC~Ⅳ期卵巢癌患者mOS时间为87.6个月,1、3、5年生存率分别为94.1%、68.2%和64.2%。79.0%的患者可达到完全CRS,mPFS时间为23.3个月。值得注意的是,4.0%患者术后无瘤生存超过10年。而在传统治疗模式下,晚期卵巢癌自然病程约50个月,5年生存率30.0%,75%患者5年内复发,mPFS时间仅为3~4个月[12,13,14,15]。本研究显示CRS+HIPEC方案明显延长了FIGO ⅢC~Ⅳ期卵巢癌患者生存期。
van Driel等[11]纳入了245例FIGO Ⅲ期卵巢癌、输卵管癌、原发性腹膜癌患者,接受CRS+HIPEC(顺铂100 mg,40 ℃,90 min)治疗,达到完全CRS者106例(87%),mOS时间为45.7个月,显著长于单纯手术组(33.9个月),两组Ⅲ~Ⅳ级不良事件发生率分别为25%和27%(P>0.05)。本研究中患者生存期显著优于上述文献,可能原因包括,本中心CRS手术更彻底,为同一手术组的系统病例,采用顺铂联合多西他赛进行HIPEC,更加充分发挥了CRS+HIPEC的协同治疗效应。
CC评分是影响晚期卵巢癌患者生存的独立预后因素[16]。既往文献报道,接受CRS+HIPEC治疗的晚期卵巢癌患者mOS时间为22.0~64.0个月,CC评分0~1分者mOS时间为32.9~79.5个月,3年生存率为35.0%~63.0%,5年生存率为12.0%~66.0%[10,17,18,19,20,21]。本研究中达到CC评分0~1分者mOS时间为95.2个月,1、3、5年生存率分别为95.4%、78.7%和73.8%,结果优于文献报道。多因素分析显示CC评分为晚期卵巢癌的独立预后因素,不完全CRS者死亡风险为完全CRS者的3.2倍,因此,彻底CRS是晚期卵巢癌患者生存获益的关键。
CRS+HIPEC治疗晚期卵巢癌患者的安全性已得到充分验证。本研究结果中SAE发生率为4.0%,围术期死亡率为2.0%,与文献[11,22,23]报道的22.0%~28.0%和0~10.0%结果相近。本研究回顾性分析了CRS+HIPEC作为一线手术方案可帮助患者长期临床获益,为临床治疗晚期卵巢癌提供了新思路。不足之处在于没有进行对照研究,今后仍需要大量多中心Ⅲ期临床研究行进一步分析,为治疗提供更高级别临床证据。
综上所述,本研究以CRS+HIPEC作为首选治疗方式,可延长FIGO ⅢC~Ⅳ期晚期卵巢癌患者生存期,尤其是Karnofsky评分>80分、低PCI且达到完全CRS的患者。因此,专业化的腹膜癌治疗中心要严格筛选病例、彻底CRS,是晚期卵巢癌患者获益的关键。
所有作者均声明不存在利益冲突



























