
抗中性粒细胞胞质抗体(ANCA)相关性血管炎(AAV)是一组寡或无免疫复合物沉积的坏死性血管炎,主要累及小血管,常累及全身多个脏器系统。儿童AAV罕见,肾脏受累程度较成人更严重。肾脏病变严重程度和疾病严重活动程度是影响儿童AAV长期预后的重要决定因素。近年来新型免疫抑制剂的使用和血浆置换极大地提高了AAV患儿的预后。早期诊断、准确评估病情以及制定合理的个体化治疗,对改善AAV患儿的预后具有重要临床意义。现就儿童AAV的发病机制、临床表现、诊断和治疗进行阐述,旨在提高临床医师对儿童AAV的诊治水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗中性粒细胞胞质抗体(ANCA)相关性血管炎(AAV)是一组寡或无免疫复合物沉积的坏死性血管炎,主要累及中小血管,可累及全身多器官系统。2012年Chapel Hill共识会议(CHCC)首次提出ANCA用于定义血管炎,根据疾病特点将AAV分为显微镜下多血管炎(MPA)、肉芽肿性多血管炎[GPA(既往称韦格纳肉芽肿,WG)]、嗜酸性肉芽肿性多血管炎[EGPA(既往称Churg-Strauss综合征,CSS)][1]。儿童AAV罕见,文献报道的儿童GPA年发病率在欧洲低于0.5/100万人[2],而加拿大稍高,达6.39/100万人[3],目前暂无儿童MPA和EGPA发病率报道[4],亚洲缺乏儿童AAV的流行病学资料。儿童AAV以MPA和GPA亚型为主,好发年龄11~14岁,女童多见,肾脏受累程度较成人更严重[5]。该病具有起病突然、临床表现多样、进展迅猛,可出现肺出血、急进性肾炎(RPGN)等危及生命的严重症状,早期诊断困难,治疗停药后易复发等特点。肾脏受累程度和疾病活动程度是影响儿童AAV的重要决定因素[5]。目前发病机制尚不明确,近年来新型免疫抑制剂和血浆置换极大地提高了AAV患儿的预后。早期诊断、准确全面的病情评估及制定合理有效的个体化治疗方案,对改善AAV患儿的预后具有重要的临床意义。现就儿童AAV的发病机制、临床表现、诊断和治疗进行阐述,旨在提高临床医师对儿童AAV的诊治水平。
目前AAV的病因和发病机制尚不完全明确。ANCA诱导中性粒细胞活化是AAV发病机制中最主要特点和关键中心环节[6]。在感染、药物(最常见是丙硫氧嘧啶)等环境因素刺激下,促炎性反应因子,如细菌脂多糖、肿瘤坏死因子(TNF)、补体C5a、白细胞介素(IL)-1β等动员中性粒细胞,导致中性粒细胞表面ANCA自身抗原——髓过氧化物酶(MPO)和蛋白酶3(PR3)表达增加,并与ANCAs结合,完全活化中性粒细胞。活化的中性粒细胞释放异常细胞因子、活性氧自由基和溶壁酶,损伤血管内皮细胞[7]。
目前研究显示,活化的中性粒细胞主要通过以下途径参与AAV的发病机制:(1)中性粒细胞外诱捕网(NETs)形成是中性粒细胞活化后重要的杀菌方式之一,同时自身抗原的暴露导致NETs和ANCAs相互刺激的恶性循环,加重血管内皮损伤,参与AAV发病机制[8];(2)补体系统激活是AAV发病的重要机制之一[9],有学者在AAV患者肾脏组织中发现C3c、C3d、C4d和C5b-9等补体沉积,浸润的中性粒细胞发现补体受体表达增加,提示补体途径参与了AAV的发病[10];(3)细胞免疫调节也参与AAV的发病机制。中性粒细胞产生的B淋巴细胞活化因子(BAFF)在B淋巴细胞活化方面起重要作用,活化的B淋巴细胞可分化为浆细胞产生ANCAs,向T淋巴细胞呈递抗原刺激T淋巴细胞活化,同时分泌促炎性因子如IL-6、TNF等,降低调节型T淋巴细胞活性,促进效应T淋巴细胞的分化,T淋巴细胞免疫紊乱在AAV的起病、进展和复发过程中均起重要的作用[11]。
此外,遗传易感性在AAV发病中的作用越来越受到重视。研究发现ANCA种类和AAV亚型具有种族特点,PR3和GPA多见于西方人种,MPO和MPA常见于亚洲人种[12]。我国以MPA为主(占80%)[13],考虑与遗传易感性有关。来自英国和北欧的一项全基因组关联研究(GWAS)研究发现,遗传易感性与不同ANCA抗原相关,GPA的PR3-ANCA与编码人类白细胞抗原DP区域(HLA-DP)、α1-抗胰蛋白酶基因(SERPINA1)、PR3基因(PRTN3)有关,MPA的MPO-ANCA与HLA-DQ有关[14]。
综上,AAV的发病与遗传背景、环境因素有关,ANCA诱导中性粒细胞活化是AAV发病机制中关键中心环节,活化的中性粒细胞通过NETs、补体途径、细胞免疫等多种途径参与AAV的发生发展。
儿童AAV临床表现多样,可累及多器官系统,以GPA和MPA亚型为主。儿童患者临床表现与成人存在差异,肾脏受累程度较成人更严重,部分患儿可仅有肾脏受累,无其他肾外表现。部分患儿出现RPGN、严重肺出血及脑血管炎等严重脏器损害表现,威胁生命。AAV是一种复发率高的慢性自身免疫性疾病,儿童AAV复发率的报道较少,成人资料显示GPA或PR3-ANCA阳性者复发率高于MPA或MPO-ANCA阳性者,法国一项回顾性分析纳入35例AAV患者,随访8年,GPA复发率高达83%,MPA和EGPA复发率分别为33%和50%[15]。
GPA指一组坏死性肉芽肿性炎症的自身免疫性疾病,主要累及中小血管,常累及上下呼吸道,常伴少或寡免疫复合物沉积的坏死性肾小球肾炎。儿童GPA好发年龄为6.0~16.5岁,女童多见,男女比例为1∶1~1∶4[16]。
儿童GPA临床表现与成人存在差异,非典型症状如发热、畏食、消瘦和贫血等较成人多见,病变累及多器官系统,依次为呼吸道(80.0%)、肺(80.0%)、肾脏(75.4%)、肌肉骨骼(57.0%)、胃肠道(42.0%)、眼睛(37.0%)、皮肤(35.0%)和神经系统(25.0%)[17]。首发症状常累及呼吸道,主要为反复鼻出血或鼻窦炎、鼻中隔穿孔或鞍鼻畸形,声门下狭窄发生率(50%)高于成人,可出现声音嘶哑、慢性咳嗽、呼吸困难、喘息甚至咯血等症状,16%~20%的患儿出现需要呼吸机支持的严重肺出血[17]。儿童GPA肾脏受累主要表现为尿检异常和不同程度肾功能损伤,约57%的患儿出现严重急性肾损伤(AKI)或肾病水平蛋白尿,肾脏受累较成人严重,严重者需要肾脏替代治疗。无尿、肾小球滤过率(GFR)明显下降、肾病水平蛋白尿和肾脏病理改变呈慢性化提示预后不良[18]。关节痛和肌痛也是常见首发症状之一。儿童眼部受累较成人多见,表现为突眼、结膜炎、巩膜炎和葡萄膜炎,偶有听力下降。皮肤受累常表现为紫癜样皮疹、瘀点或皮下结节。神经系统较少累及,可表现为头痛、惊厥或单神经炎。
儿童MPA是指一组无或寡免疫复合物沉积为特点的坏死性小血管炎,可累及多器官系统,不伴肉芽肿性炎症。与儿童GPA相比,发病年龄更早(9.5~12.0岁),女童更为多见,男女比例为1∶1.5~1∶6.8[17]。
儿童MPA肾脏受累最常见(75%~90%),且程度较GPA严重,表现为蛋白尿、镜下血尿和中重度肾功能损伤,AKI发生率为48%~60%,25%~50%需要肾脏替代治疗,33%~83%伴高血压,进展至终末期肾病(ESRD)比例高;神经系统受累(21%~86%)较GPA多见,表现为癫痫、视神经炎和外周多发神经炎;约44%的患儿肺部受累,较GPA少且症状较轻,可表现为咳嗽、咯血和呼吸困难等;58%的患儿可有慢性呕吐、非特异性腹痛;紫癜样皮疹仍较常见,但可出现坏死性血管炎皮损和脓皮病等其他皮肤表现[18,19]。
准确的ANCAs检测对AAV诊断、治疗和预后判断具有重要意义。ANCA分胞质型(C-ANCA)和核周型(P-ANCA),其靶抗原分别为PR3和MPO。目前采用ELISA法检测PR3和MPO抗体滴度,间接免疫荧光法检测C-ANCA和P-ANCA,其在儿童AAV诊断的敏感度和特异度分别为93%和90%[22]。GPA多出现PR3-ANCA抗体滴度升高和C-ANCA阳性,MPA多出现MPO-ANCA抗体滴度升高和P-ANCA阳性。研究表明MPO-ANCA和P-ANCA同时阳性,诊断MPA特异度可达99%,且与肾脏受累严重程度有关[23]。PR3-AAV的复发率高于MPO-AAV,高滴度ANCA者疾病复发率高[24]。注意ANCA阴性并不能排除AAV,应结合临床和病理结果全面评估。
儿童AAV的诊断需要排除其他系统性血管炎,为准确诊断和全面评估病情,临床怀疑AAV患儿,除ANCAs测定外,实验室、影像学和病理学检查的参考建议,见表1。

疑诊AAV患儿实验室、影像学和病理学检查的参考建议
Suggestions for laboratory, imaging and pathological examination in children with suspected AAV
疑诊AAV患儿实验室、影像学和病理学检查的参考建议
Suggestions for laboratory, imaging and pathological examination in children with suspected AAV
| 检查项目 | 具体检查内容 |
|---|---|
| 常规检查 | 血常规(嗜酸性粒细胞、淋巴细胞和血小板计数)、尿常规、尿蛋白肌酐比、电解质、肝肾功能(肾小球滤过率估算值)、出凝血功能、红细胞沉降率、甲状腺功能 |
| 免疫功能评估 | 淋巴细胞亚群,各类免疫球蛋白、补体C3和C4 |
| 使用利妥昔单抗前和治疗后需动态监测CD19和免疫球蛋白水平 | |
| ANCAs检测 | 蛋白酶3-ANCA、髓过氧化物酶-ANCA、胞质型-ANCA和核周型-ANCA |
| 病原学检查 | 血或尿培养、肺炎支原体抗体、抗链球菌溶血素O、抗DNase B、结核菌素试验、干扰素释放试验、乙肝五项、甲肝和丙肝抗体、人类免疫缺陷病毒抗体、梅毒抗体、EB病毒-DNA、巨细胞病毒-DNA、微小病毒B19、JC病毒、腺病毒和肠道病毒等 |
| 排其他免疫性疾病检查 | 抗核抗体、抗双链DNA抗体、类风湿因子、抗肾小球基底膜抗体、抗心磷脂抗体、狼疮抗凝物质 |
| 影像学检查 | 胸片、心电图、心脏彩超、泌尿系B超,注意以下特殊情况:(1)临床有咯血、呼吸困难者,首选胸部CT或CTA;(2)有神经体统症状体征者,首选头颅MRI和磁共振血管造影,其次头颅CT或CTA,有癫痫者行脑电图检查;(3)病变累及鼻咽喉者,可行鼻窦或咽喉部CT或MRI检查 |
| 病理组织学检查 | 累及肾脏且无禁忌者应尽快行肾穿刺活检术,累及肺、鼻咽喉、皮肤等其他部位者,条件允许可行病理组织活检术。高度怀疑AAV但ANCAs阴性者,病理组织学检查对明确诊断至关重要 |
| 其他检查 | 眼科和耳鼻喉科检查协助发现眼部病变和听力异常;高血压者可行24 h动态血压检测 |
注:ANCA:抗中性粒细胞胞质抗体;AAV:抗中性粒细胞胞质抗体相关性血管炎;CTA:CT血管造影术;MRI:磁共振成像 ANCA:anti-neutrophil cytoplasmic antibodies;AAV:ANCA-associated vasculitis;CTA:CT angiography;MRI:magnetic resonance imaging
肾脏病理组织学检查是诊断ANCA相关性肾炎(AAGN)的金标准。患儿符合以下5种情况之一且无禁忌证均应积极行肾穿刺活检术,强调RPGN患儿应尽早予初始诱导治疗,不必等肾穿刺结果,条件允许时,尽快行肾穿刺活检术[25]。(1)临床怀疑AAV伴PR3-ANCA或MPO-ANCA阳性,继发性血管炎可能性不大,出现血尿、蛋白尿或急进性肾炎或肾功能短时间内迅速下降;(2)临床高度怀疑原发性小血管炎但PR3-ANCA或MPO-ANCA阴性;(3)AAV初始治疗效果欠佳;(4)AAV复发累及肾脏;(5)AAV患儿肾移植术后复发累及肾脏。
AAGN主要病理特点为少或寡免疫复合物沉积的坏死性肾小球肾炎。EPGA罕见肾脏累及,MPA和GPA的肾组织病理特点如下:(1)MPA:多为Ⅲ型新月体肾炎,表现为肾小球出现节段性纤维蛋白样坏死,伴大小不一、新旧不一的新月体,肾间质可见中性粒细胞、淋巴细胞和单核细胞润,可有不同程度肾小管萎缩和肾间质纤维化,常无免疫复合物沉积,近年来研究发现有补体成分在肾脏组织沉积[10]。(2)GPA:多为入球动脉和毛细血管襻的纤维蛋白样坏死,肾间质以单核巨噬细胞浸润为主,并可形成肉芽肿。
Berden等[26]基于100例AAGN患者肾穿病理的数据,提出AAGN新的病理学分型,见表2。该分型将AAGN分为局灶型、新月体型、混合型和硬化型4个病理类型,能较好地预测AAGN的预后和指导治疗方案选择。

抗中性粒细胞胞质抗体相关性肾小球肾炎的Berden病理分类[26]
Berden′s histopathologic classification of anti-neutrophil cytoplasmic antibodies -associated glomerulonephritis[26]
| 分类 | 纳入标准a |
|---|---|
| 局灶型 | ≥50%正常肾小球 |
| 新月体型 | ≥50%肾小球含细胞性新月体 |
| 混合型 | <50%正常肾小球,或<50%肾小球含细胞新月体,或<50%肾小球发生球性硬化 |
| 硬化型 | ≥50%肾小球发生球性硬化 |
注:a光镜下≥1个肾小球出现坏死性或新月体性病变,免疫荧光表现为寡免疫染色 aNecrotizing or crescentic lesions occur in ≥1 glomerulus under light microscopy and is characterized by pauci-immune immunofluorescence
成人AAV患者中应用较广的疾病活动度评估量表为伯明翰血管炎活动评分(BVAS)、血管炎损害指数(VDI)和WG专用的BVAS-WG量表。在BVAS的基础上结合儿童血管炎特点,Dolezalova等[27]提出适用于儿童的儿童血管炎活动评分量表(PVAS),评估内容包括一般情况、皮肤、黏膜/眼、耳鼻喉、胸部、心血管系统、腹部、肾脏、神经系统和其他等10部分内容,对持续存在、新发或恶化的临床表现有不同的评分分值,累及肾脏、肺和神经系统等重要脏器者分值更高。PVAS在儿童血管炎中应用广泛,对全面评估病情、判断疗效具有重要指导意义。
由于AAV临床表现复杂多样,准确诊断和分型是对临床医师很大的挑战。血清ANCAs阳性是临床疑诊AAV的血清学诊断标准。2012年CHCC血管炎分类标准是近年来应用最广泛的血管炎分类方法,首次将AAV分为MPA、GPA、EGPA 3个亚型[1]。参考成人AAV诊断和分类标准的基础上,结合儿童数据,先后制定了2006年欧洲抗风湿联盟-欧洲儿童风湿病协会(EULAR-PReS)血管炎分类标准和2008年EULAR-PReS-国际儿童风湿病学试验组织(PRINTO)标准[28,29]。2017年EULAR-美国风湿病协会(ACR)临时分类标准首次明确提出MPA、GPA和EGPA 3个亚型的诊断标准,标准涉及临床表现、影像学、病理学和血清学等多个特征,为血管炎提供更有力的分类标准,但需要进一步验证,见表3[4]。虽然AAV分类标准不断更新,仍存在一定不足,强调ANCA阴性不能排除AAV诊断,临床医师应灵活应用,结合病史、临床表现、实验室及影像学检查及组织病理结果综合判断,提高AAV的诊断率,减少误诊。

ANCA相关性血管炎主要诊断和分类标准一览表
Important diagnostic and classification criterias for ANCA-associated vasculitis
ANCA相关性血管炎主要诊断和分类标准一览表
Important diagnostic and classification criterias for ANCA-associated vasculitis
| AAV分类标准 | 具体诊断和分类标准 |
|---|---|
| 2006年EULAR/PReS标准[28](儿童) | 1.MPA定义:一组以寡免疫复合物沉积为特点的坏死性小血管炎,常累及肾和肺,伴MPO-ANCA或P-ANCA阳性 |
| 2.儿童WG符合以下6条中3条可诊断:(1)尿检异常;(2)活检提示肉芽肿性炎症;(3)鼻窦炎症;(4)声门下、气管或气管内狭窄;(5)胸部X线或CT异常;(6)PR3-ANCA或C-ANCA阳性 | |
| 2008年EULAR/PReS/ PRINTO标准[29](儿童) | 儿童GPA符合以下6条中3条可诊断:(1)组织病理学提示动脉壁、动脉周围或血管外部位有肉芽肿性炎症;(2)上呼吸道受累:慢性脓肿或血性鼻腔分泌物、或反复鼻出血、肉芽肿、鼻中隔穿孔或鞍鼻畸形、慢性或反复鼻窦炎;(3)声门下、气管或支气管狭窄;(4)肺部受累:胸部X线或CT提示结节、空洞或固定浸润;(5)肾脏受累:晨尿尿蛋白2+或24 h尿蛋白>0.3 g或尿蛋白/肌酐>30 mg/mg;尿沉渣提示血尿、红细胞管型;肾脏病理提示少或寡免疫复合物沉积的坏死性肾小球肾炎;(6)免疫荧光或酶联免疫吸附试验提示ANCA阳性,包括MPO-ANCA、PR3-ANCA、C-ANCA和P-ANCA |
| 2012年CHCC标准[1] | 首次提出ANCA用于定义血管炎,将小血管炎分为AAV和免疫复合物型,AAV分为MPA、GPA和EGPA 3个亚型,但ANCA阴性不能排除AAV |
| 1.MPA:一组以少或寡免疫复合物沉积为特点的坏死性血管炎,累及中小血管,常累及肾和肺,肾脏累及常表现为坏死性肾小球肾炎;2.GPA:坏死性肉芽肿性炎症,主要累及中小血管,常累及上下呼吸道,常伴少或寡免疫复合物沉积的坏死性肾小球肾炎;3.EGPA:嗜酸性粒细胞浸润的坏死性肉芽肿性炎症,累及中小血管,主要表现为呼吸道受累,常伴哮喘和嗜酸性粒细胞增多症 | |
| 2017年EULAR/ACR临时分类标准[30] | 1.MPA:6项总分≥5分可诊断:(1)鼻腔血性分泌物、溃疡、鼻痂、或鼻窦-鼻腔充血或不通畅(-3分);(2)P-ANCA、MPO-ANCA抗体阳性(6分);(3)嗜酸性粒细胞计数≥1×109/L(4分);(4)极少或寡免疫复合物沉积性肾炎(1分);(5)胸部影像学提示纤维化或间质性病变(5分);(6)C-ANCA、PR3-ANCA抗体阳性(-1分) |
| 2.GPA:9项总分≥5分可诊断:(1)鼻腔血性分泌物、溃疡、鼻痂、或鼻窦-鼻腔充血或不通畅(3分);(2)鼻息肉(-4分);(3)听力丧失或下降(1分);(4)软骨受累(2分);(5)咽红或眼痛(1分);(6)C-ANCA、PR3-ANCA抗体阳性(5分);(7)嗜酸性粒细胞计数≥1×109/L(-3分);(8)胸部影像学提示结节、包块或空洞形成(2分);(9)活检见到肉芽肿表现(3分) | |
| 3.EGPA:7项总分≥6分即可诊断:(1)阻塞性气道疾病(3分);(2)鼻息肉(3分);(3)多发性神经炎或运动神经病(1分);(4)嗜酸性粒细胞计数≥1×109/L(5分);(5)血管外嗜酸性粒细胞浸润或骨髓内嗜酸性粒细胞增高(2分);(6)镜下血尿(-1分);(7)C-ANCA、PR3-ANCA抗体阳性(-3分) |
注:ANCA:抗中性粒细胞胞质抗体;AAV:抗中性粒细胞胞质抗体相关性血管炎;MPA:显微镜下多血管炎;GPA:肉芽肿性多血管炎;EPGA:嗜酸性肉芽肿性多血管炎;PR3:蛋白酶3;MPO:髓过氧化物酶;C-ANCA:胞质型抗中性粒细胞胞质抗体;P-ANCA:核周型抗中性粒细胞胞质抗体;EULAR:欧洲抗风湿联盟;PReS:欧洲儿童风湿病协会;PRINTO:国际儿童风湿病学试验组织;ACR:美国风湿病协会;CHCC:Chapel Hill共识会议 ANCA:anti-neutrophil cytoplasmic antibodies;AAV:ANCA-associated vasculitis;MPA:microscopic polyangiitis;GPA:microscopic polyangiitis;EPGA:eosinophilic granulomatosis with polyangiitis;PR3:proteinase 3;MPO:myeloperoxidase;C-ANCA:cytoplasmic ANCA;P-ANCA:perinuclear ANCA;EULAR:European League Against Rheumatism;PReS:Pediatric Rheumatology European Society;PRINTO:Pediatric Rheumatology International Trials Organisation;ACR:American College of Rheumatology;CHCC:Chapel Hill Consensus Conference
AAV的完整诊断思路:(1)首先明确AAV的诊断和分型(排除其他系统性血管炎);(2)其次需要了解是否有药物、感染或肿瘤等引起AAV的继发性因素;(3)全面评估受累器官系统和疾病活动度程度,注意有无RPGN、严重肺出血等严重器官脏器受累;(4)积极进行病理组织学检查:累及肾脏者应积极肾穿刺活检术明确肾脏病理,累及肺部、皮肤黏膜、耳鼻喉等部位,条件允许应积极行相应部位病理组织学检查。
AAV临床表现复杂多样,呈慢性病程,易复发,部分患儿出现肾功能进行性恶化、严重肺出血及脑血管炎等严重脏器损害表现。制定AAV治疗方案不能仅依靠ANCAs水平,应结合疾病本身病程特点、疾病活动程度、受累器官系统及其严重程度、合并症等情况充分平衡获益和风险,制定最佳的个体化治疗方案[25]。
AAV的治疗策略包括诱导缓解治疗和维持期治疗,糖皮质激素联合环磷酰胺(CYC)管儿童治疗缓解率可达70%~100%,仍有41%出现1次以上复发[16]。长期重复使用CYC,出血性膀胱炎和性腺毒性发生率较高,分别为43%和57%,感染和恶性肿瘤风险增加2.4倍[30]。随着AAV发病机制研究的深入,利妥昔单抗(RTX)、霉酚酸酯(MMF)和血浆置换在AAV中的应用进一步提高了AAV的治疗效果。靶向作用于B淋巴细胞的RTX成为AAV诱导缓解策略的新补充,用于有器官威胁性的儿童难治性或复发性AAV的一线诱导治疗[31];研究证实MMF在AAV诱导治疗和维持缓解中占据越来越重要的地位,近年来AAV诊疗指南推荐MMF用于非器官威胁性AAV的诱导治疗[31];血浆置换能够快速去除患者血浆中的抗体及炎性因子等,有助于缓解急性期病情,但在儿童AAV中经验有限[32]。
儿童AAV的治疗尚缺乏高质量的随机对照试验研究,主要参考成人数据和经验。根据2016年EULAR/欧洲透析和移植协会(ERA-EDTA)联合发布的AAV诊治推荐意见[31]和2012年改善全球肾脏病预后组织(KDIGO)中有关AAV诊治的临床实践指南[25],结合儿童治疗进展[16],儿童AAV推荐治疗策略,见图1,具体治疗方案如下:
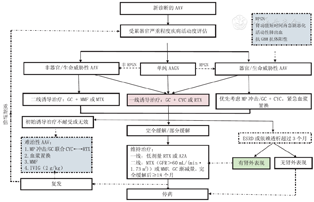

注:ANCA:抗中性粒细胞胞质抗体;AAV:ANCA相关性血管炎;AAGN:ANCA相关性肾炎;RPGN:急进性肾炎;GBM:肾小球基底膜;GC:糖皮质激素;MP:甲泼尼龙;MMF:霉酚酸酯;MTX:甲氨蝶呤;CYC:环磷酰胺;RTX:利妥昔单抗;AZA:唑嘌呤;IVIG:静脉滴注丙种球蛋白;ESRD:终末期肾病 ANCA:anti-neutrophil cytoplasmic antibodies;AAV:ANCA-associated vasculitis;AAGN:ANCA-associated glomerulonephritis;RPGN:rapidly progressive glomerulonephritis;GBM:glomerular basement membrane;GC:glucocorticoid;MP:Methylprednisolone;MMF:Mycophenolate mofetil;MTX:Methotrexate;CYC:Cyclophosphamide;RTX:Rituximab;AZA:Azathioprine;IVIG:intravenous immunoglobulin;ESRD:end stage renal disease
(1)甲泼尼松冲击:适用于伴RPGN、活动性肺出血且无激素使用禁忌的AAV患儿。甲泼尼松每次剂量15~30 mg/kg(最大剂量1 g),每疗程3次,每日1次或隔日1次,1~3个疗程,视病情和患儿耐受程度决定。(2)口服激素:AAV患儿最主要的一线用药。常用甲泼尼松,起始剂量1~2 mg/(kg·d),4~8周后(视病情缓解情况)逐渐减量。甲泼尼松冲击者,冲击结束开始口服激素。联合CYC诱导治疗,甲泼尼松在诱导治疗6个月时减至隔天0.5 mg/kg,完全缓解后继续减量,至少维持18个月;联合RTX诱导治疗者,甲泼尼松在诱导治疗期间逐渐减量,6个月时可考虑撤激素。
CYC主要用于AAV诱导期治疗或难治性AAV的治疗。(1) CYC冲击:剂量每次8~12 mg/kg,每日1次,连用2 d,每2周1次或每次0.5~1.0 g/m2,每月1次,疗程6个月,CYC累积剂量<150~200 mg/kg。使用CYC时应注意水化碱化尿液,可予美司钠预防出血性膀胱炎。(2) CYC口服:剂量每天2~3 mg/kg,疗程2~3个月,CYC累积剂量<150~200 mg/kg,避免重复使用减少不良反应。
RTX可用于AAV诱导期、维持期和难治性AAV的治疗。(1)诱导治疗:剂量每次375 mg/m2,静脉滴注,每周1次,疗程1~2次,注意监测CD19水平和免疫球蛋白水平。(2)维持治疗:可予低剂量维持,每次剂量100~150 mg/m2,静脉滴注,使用频率根据CD19水平决定,维持治疗至少18个月。
MTX适用于非器官/生命威胁性AAV的诱导治疗和AAV的维持缓解治疗。MTX剂量每次10~15 mg/m2,每周1次,口服或皮下注射给药,疗程至少1年,注意GFR<60 mL/(min·1.73 m2)者慎用。
MMF适用于非器官/生命威胁性AAV的诱导治疗和AAV的维持治疗。MMF 20~30 mg/(kg·d)(最大量2 g/d),q12h,疗程2年。使用MMF需要定期监测酶酚酸总浓度,治疗窗酶酚酸总浓度(用0~12 h曲线下面积表示)为30~60 μg/(h·mL)。
AZA主要用于AAV的维持治疗。剂量0.5~2.5 mg/(kg·d),口服给药,每日1次,疗程至少1年。
血浆置换能快速去除AAV患者血浆中的抗体及炎性因子等,有助于缓解急性期病情。(1)适应证:AAV伴RPGN或肾功能短时间内迅速恶化;活动性肺出血;抗肾小球基底膜抗体阳性。(2)置换液剂量和种类:2倍血浆容量的新鲜冷冻血浆或50 g/L人血清清蛋白溶液。有活动性肺出血或其他出血倾向者,置换液应全部用新鲜冷冻血浆。(3)治疗频率和次数:每天1次,连续3~5 d,其后再进行病情评估,可延长间隔时间,确定治疗次数[32]。
随着AAV发病机制研究的深入,近年来针对发病机制的各个环节出现了一些新的治疗方法,包括以下几个方面:(1)针对B淋巴细胞的治疗:除了RTX外,BAFF拮抗剂(Blisibimod)能抑制中性粒细胞产生BAFF,减少B淋巴细胞活化,而蛋白酶体抑制剂硼替佐米消耗浆细胞,均能抑制ANCAs产生,在AAV治疗中取得较好疗效[11];(2)针对补体的治疗:有临床研究证实C5a抑制剂(Avacopan)治疗AAV患者有效[33];(3)针对细胞因子的治疗:Berti等[34]报道用IL-6受体抑制剂Tocilizumab治疗难治性AAV患者可获长期缓解。上述治疗方法仅在少数临床研究中观察到对AAV患者有一定的疗效,仍需进一步的多中心、大样本和长期随访的临床试验进一步评估验证,在临床上使用应慎重斟酌利弊。
AAV在免疫抑制剂使用之前预后差,CYC的使用极大改善了AAV的预后,近年来RTX、MMF和血浆置换的使用进一步提高了AAV的长期生存率。一项纳入10项研究、3 338例AAV患者的荟萃分析提示AAV患者死亡风险为健康人群的2.7倍[35]。目前文献报道儿童AAV病死率为5%~10%[15],但EGPA因心脏受累比例高导致病死率高达15%~18%[21]。儿童AAV肾脏受累程度较成人严重,MPA患儿中29%~40%、GPA患儿中约10%进展至ESRD[36]。无尿、GFR下降、肾病水平蛋白尿、硬化型AAGN及补体C3消耗均提示AAV预后不良[9,18]。尽管AAV患儿肾移植后复发率为2.0%/人年~2.8%/人年[37,38],肾移植仍是治疗AAV伴ESRD最有效的肾脏替代治疗方案,但应在肾外症状完全缓解至少12个月以上进行手术,完全缓解但ANCA抗体阳性者不应推迟移植[25,39]。
综上,儿童AAV罕见,临床表现复杂多样,复发率高,肾脏受累程度较成人更严重,病程中可能出现RPGN和肺出血等威胁器官或生命的严重症状,对临床医师早期诊断和治疗提出较大的挑战。血清ANCA阳性是临床疑诊AAV的血清学诊断标准,病理学检查尤其是肾组织病理活检仍是诊断AAV的金标准,可明确AAV的诊断和分型,排除其他系统性疾病及继发因素,全面评估受累器官系统和疾病活动度程度至关重要。AAV主要的诱导缓解治疗方案仍是激素联合CYC,但RTX、MMF逐渐成为重要的一线治疗方案之一,血浆置换对缓解器官/生命威胁性AAV的急性期症状具有重要作用。早期诊断、准确全面评估病情和制定合理有效的个体化治疗,对提高AAV诊治水平具有重要意义。
所有作者均声明不存在利益冲突































