
膜性肾病(MN)是一种免疫复合物介导的疾病,各年龄均可发病。原发膜性肾病(PMN)在儿童并不常见,但为导致儿童终末期肾病的原因之一。针对M型磷脂酶A2受体和1型血小板反应蛋白7A域的抗体不仅见于成人PMN,亦可见于儿童和青少年PMN,为诊断和监测儿童PMN的有用指标。利妥昔单克隆抗体已成功用于治疗成人PMN,还可能对儿童PMN有效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
膜性肾病(MN)是一种免疫复合物介导的疾病,婴儿到老年均可发病[1]。其病理特点为免疫荧光染色示颗粒状显著的免疫球蛋白G(IgG)沿肾小球毛细血管襻分布,伴程度不一的C3沉积及上皮下电子致密物沉积[2]。自身免疫性疾病(如系统性红斑狼疮、甲状腺炎、糖尿病、类风湿性关节炎等),药物或毒物(如非甾体类抗炎药、青霉胺、环境空气污染等),感染(如乙型肝炎病毒感染、丙型肝炎病毒感染、梅毒等),恶性肿瘤,移植物抗宿主病和肾移植后的新发MN等均可导致继发膜性肾病(SMN)[2]。临床实践中诊断为MN的患者如果除外了继发因素,便可诊断为原发膜性肾病(PMN)。
PMN是导致非糖尿病成人中原发肾病综合征最常见的原因,未治疗者可在其后的10年进展至终末期肾病[2],且肾移植后PMN复发常见[2],进而导致肾移植失败。然而该病在儿童并不常见。来自欧洲、南北美洲、加拿大、澳大利亚和中东的资料显示,每年儿童PMN的发生率约为0.1/10万[3]。来自国内的一项研究显示,7 962例进行肾活检的儿童患者中,MN仅有12例(0.15%)[4]。尽管如此,儿童PMN是导致儿童终末期肾病的原因之一。美国Renal Data System 2017年年度数据报告显示,0.5%的终末期肾病儿童病因为MN,其进展至终末期肾病的中位数年龄为19岁[5]。鉴于此,及时诊断儿童PMN进而予以合理管理以改善其长期预后至关重要。
虽然依据临床表现,多数MN患儿的病因可以找到,即因系统性红斑狼疮和慢性乙型肝炎病毒感染所致。极为少见的新生儿和婴幼儿MN分别为抗中性内肽酶(NEP)抗体介导(患儿母亲存在NEP基因缺陷)和抗牛血清清蛋白(BSA)抗体介导[6,7]。但部分MN儿童仅根据临床表现并不能清楚区分为PMN和SMN,且加上儿童MN病理特征与成人患者并不完全相同,根据肾活检电镜和免疫荧光检查中的某些表现(如系膜和/或内皮下电子致密物沉积、肾活检组织免疫荧光染色显示IgA、IgM和C1q沉积-满堂亮者)亦不能区分为PMN和SMN,因此明确此类患儿的病因意义重大。
近10年来关于成人PMN的认识取得了里程碑式的进展,该病多为M型磷脂酶A2受体(PLA2R)抗体介导,少数为1型血小板反应蛋白7A域(THSD7A)介导(表1、表2)。且循环中M型PLA2R抗体阳性可作为一种用于诊断PMN的有用的非创伤性方法[8]。此外,肾组织IgG亚型染色亦有助于区别PMN和SMN:PMN以IgG1和IgG4为主,V型狼疮性肾炎以IgG1、IgG2和IgG3为主,肿瘤相关MN则以IgG1和IgG2为主。
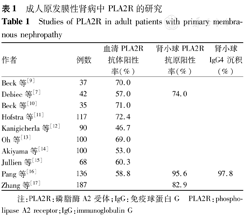
成人原发膜性肾病中PLA2R的研究
Studies of PLA2R in adult patients with primary membranous nephropathy
成人原发膜性肾病中PLA2R的研究
Studies of PLA2R in adult patients with primary membranous nephropathy
| 作者 | 例数 | 血清PLA2R抗体阳性率(%) | 肾小球PLA2R抗原阳性率(%) | 肾小球IgG4沉积(%) |
|---|---|---|---|---|
| Beck等[9] | 37 | 70.0 | ||
| Debiec等[7] | 42 | 57.0 | 74.0 | |
| Beck等[10] | 35 | 71.0 | ||
| Hofstra等[11] | 117 | 72.4 | ||
| Kanigicherla等[12] | 90 | 46.7 | ||
| Oh等[13] | 100 | 69.0 | ||
| Akiyama等[14] | 100 | 53.0 | ||
| Jullien等[15] | 68 | 60.3 | ||
| Pang等[16] | 136 | 58.8 | 95.6 | 97.8 |
| Zhang等[17] | 187 | 82.9 |
注:PLA2R:磷脂酶A2受体;IgG:免疫球蛋白G PLA2R:phospholipase A2 receptor;IgG:immunoglobulin G
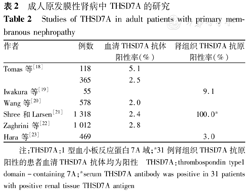
成人原发膜性肾病中THSD7A的研究
Studies of THSD7A in adult patients with primary membranous nephropathy
成人原发膜性肾病中THSD7A的研究
Studies of THSD7A in adult patients with primary membranous nephropathy
| 作者 | 例数 | 血清THSD7A抗体阳性率(%) | 肾组织THSD7A抗原阳性率(%) |
|---|---|---|---|
| Tomas等[18] | 118 | 5.1 | |
| 365 | 2.5 | ||
| Iwakura等[19] | 55 | 9.1 | |
| Wang等[20] | 578 | 2.0 | |
| Shree和Larsen[21] | 1 318 | 2.4 | 100.0a |
| Zaghrini等[22] | 1 012 | 2.8 | |
| Hara等[23] | 469 | 3.0 |
注:THSD7A:1型血小板反应蛋白7A域;a31例肾组织THSD7A抗原阳性的患者血清THSD7A抗体均为阳性 THSD7A:thrombospondin type1 domain-containing 7A;aserum THSD7A antibody was positive in 31 patients with positive renal tissue THSD7A antigen
有限的研究显示,PLA2R为部分儿童PMN患者涉及到的抗原,然而这样的患儿肾组织沉积的IgG亚型并不像成人患者那样多为IgG4。Cossey等[24]的研究纳入了22例PMN儿童,在10例(45%)患儿的肾组织中检测到抗M型PLA2R抗原,4例肾组织以IgG1和IgG4沉积为主的患儿肾组织PLA2R抗原阳性和阴性各2例,1例肾组织以IgG1沉积为主,1例肾组织以IgG3沉积为主以及1例肾组织以IgG1和IgG3沉积为主的患儿其肾组织PLA2R抗原均阴性。Kumar等[25]对5例经肾活检诊断为PMN、临床表现为激素耐药肾病综合征的儿童检测分析了血清抗PLA2R抗体和肾组织PLA2R抗原染色。结果显示,3例患儿血清抗PLA2R抗体阳性,所有患儿肾组织PLA2R抗原染色阳性(100%)。在2例患儿尚观察到尿蛋白的减少与血清抗PLA2R抗体滴度下降相平行。Kanda等[26]报道了34例PMN儿童肾组织PLA2R抗原沉积情况。在该研究中,仅2例(5.9%)儿童检测到肾组织PLA2R抗原阳性,且其免疫荧光染色强度较PMN成人患者弱。32例肾组织PLA2R抗原阴性儿童肾组织未检测到血清清蛋白抗原沉积。Kumar等[27]的研究显示,18例10~19岁起病的PMN儿童中,13例(72.23%)肾组织PLA2R抗原阳性,14例(77.78%)血清中抗PLA2R抗体阳性。其中12例患儿同时表现为肾组织PLA2R抗原阳性和血清中抗PLA2R抗体阳性,1例为肾组织PLA2R抗原阳性而血清中抗PLA2R抗体阴性,2例为肾组织PLA2R抗原阴性而血清中抗PLA2R抗体阳性,3例为肾组织PLA2R抗原和血清中抗PLA2R抗体均阴性。Dettmar等[28]对12例儿童及青少年期起病的PMN患儿检测分析了血中抗PLA2R抗体、抗THSD7A抗体、抗NEP抗体和抗BSA抗体。结果显示,6例患儿血中抗PLA2R抗体阳性(50%),所有患儿血中未检测到抗THSD7A抗体、抗NEP抗体和抗BSA抗体。8例患儿进行了肾组织PLA2R抗原染色,阳性(50%)和阴性各4例。其中4例肾组织PLA2R抗原阳性的儿童血中抗PLA2R亦阳性,肾组织检测到IgG2和IgG4的沉积;4例肾组织PLA2R抗原阴性的儿童肾组织未检测到IgG2和IgG4的沉积,且1例患儿仅检测到IgG3在肾组织的沉积。另有4例患儿肾组织检测到IgG1和IgG3的沉积。在6例血中抗PLA2R抗体阳性的儿童中观察到该抗体水平与患儿尿蛋白情况密切相关。
国内关于M型PLA2R与儿童PMN的关系的报道少见。在杨晓青等[29]的研究中,儿童PMN肾组织PLA2R抗原染色阳性率可达87.50%(14/16例),5例肾组织PLA2R抗原染色阳性的患儿肾组织IgG4染色阳性。16例患儿肾组织均未检测到阳离子牛血清清蛋白沉积。董燕飞等[30]的研究显示,22例起病年龄为2~14岁的PMN儿童中,肾组织PLA2R抗原的阳性率为31.8%(7/22例患儿)。Zhang等[17]的研究显示,38例17岁起病的PMN儿童中,16例儿童肾组织PLA2R抗原染色阳性(42.1%),为MN Ⅰ期和Ⅲ期;22例肾组织PLA2R抗原染色阴性的儿童肾组织未检测到THSD7A沉积。
对PMN病因认识的提高使得成人此类疾病的治疗模式发生了改变,特别是利妥昔单克隆抗体可作为一线治疗药物应用于具有至少一个疾病进展风险的成人PMN患者[31]。然而,因儿童PMN很少见,且未经治疗预后相对较好,目前尚无治疗方面的随机对照研究。而关于儿童PMN自然病史、治疗措施和长远预后的大部分认识源自小样本、非对照观察性研究[32]。如Malatesta-Muncher等[33]报道了2例表现为肾病水平蛋白尿、激素治疗无效的MN青少年经利妥昔单克隆抗体治疗后蛋白尿获得缓解,Zahgrini等[22]报道了利妥昔单克隆抗体成功治疗了1例4岁THSD7A相关MN患儿。因此儿童PMN管理缺乏高质量的研究证据。
综上,PLA2R和THSD7A抗体一方面可用于区分PMN和SMN,另一方面可用于监测疾病活动。利妥昔单克隆抗体具有治疗MN的潜力,且耐受性良好。
所有作者均声明不存在利益冲突



























