
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
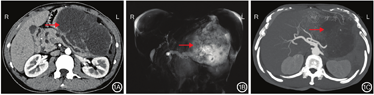
患者男,50岁。因腹上区胀痛3 d于2018年12月20日入院。患者4年前曾出现腹上区阵发性绞痛,向右侧腰背部放射,伴恶心呕吐,呕吐物为胃内容物。发作时至当地医院行CT检查示急性胰腺炎,血淀粉酶>正常值上限3倍,行胃肠减压及抑制胰酶等治疗,疼痛消失后出院。其后胰腺炎未复发。此次入院前3 d患者再次出现腹上区疼痛,伴腹胀,无恶心呕吐、发热等不适。遂至我院检查,门诊行腹上区CT检查平扫示:主胰管扩张,胰腺体尾部囊性病灶。患者自发病以来,精神、饮食一般,大、小便正常,体质量无明显下降。患者否认肝炎病史,2017年8月17日因脑血管瘤破裂行相关手术,具体不详。入院体格检查:一般情况尚可,皮肤、巩膜无黄染,浅表淋巴结未触及肿大,心肺未见明显异常,腹软,腹上区饱满,有压痛,无反跳痛,未见明显包块,肝脾肋下均未触及,肝区无叩击痛,墨菲征阴性,双肾区无叩击痛。患者入院后积极完善相关检查,血常规、血生化、凝血功能未见明显异常,HBsAg 0.14 IU/mL,HBV-DNA阴性,Alb 34.6 g/L。肿瘤标志物:CEA 475.50 μg/L、CA19-9>1 000 U/mL及CA125 54.61 U/mL,AFP 2.38 μg/L。血淀粉酶115 U/L。腹部CT检查增强扫描示:胰头饱满,主胰管扩张,于胰腺体尾部变细,胰体尾旁可见类圆形低密度影,边界清晰,壁较厚,其内可见分隔,局部见斑片状钙化,大小约14.4 cm×8.4 cm,囊性部分未见明显强化,分隔可见强化。未见累及脾脏。考虑假性囊肿(图1A)。MRCP检查结果示:胰腺体尾部可见不规则形巨块长T2信号影,内信号欠均匀,较大层面约为12.4 cm×14.8 cm,与胰腺分界不清晰,其内可见絮状分隔及小结节状壁结节影,病灶与胰管似相通,邻近胃及脾脏受压移位改变,边界清晰。结合病史及相关实验室检查结果,考虑胰腺导管内乳头状黏液癌,低度恶性(图1B)。三维重建示:胰腺体尾部后缘巨块状囊实性病灶,其内片絮状分隔及小结节状壁结节影,病灶与胰管似相通,大小约14.3 cm×10.5 cm×11.8 cm,CT检查增强扫描囊性部分未见明显强化,结合病史及相关实验室检查,考虑胰腺导管内乳头状黏液癌,低度恶性(图1C)。术前EUS检查结果示:胰腺体尾部可见一巨大的囊实性混杂偏高回声团块,边界不清晰,内部回声欠均匀,胰管全程明显扩张、不规整,最大直径约0.74 cm,内未见强回声。胆总管无扩张,未见异常回声。胆囊未探及。采用穿刺针对胰腺体尾部病灶穿刺3次,抽出淡黄色黏液,病理学检查结果示:黏液性囊腺癌待排。结合病理学检查结果、影像学及实验室检查结果诊断为胰腺导管内乳头状黏液癌,行手术治疗。

文武住院医师:中老年男性患者,主诉腹上区胀痛3 d,无恶心呕吐,体格检查腹软,腹上区饱满,有压痛,无反跳痛,无腹部手术外伤史,实验室检查结果示:CEA、CA19-9及CA125均明显升高,影像学检查结果示:胰腺体尾部占位性病变。
单人锋副主任医师:根据患者病史、体格检查以及影像学检查结果,考虑诊断为胰腺黏液性囊腺癌,有明确手术适应证,术前需告知患者手术必要性及相关风险。
万仁华主任医师:该患者目前诊断综合考虑为胰腺黏液性囊腺癌,需行早期手术治疗,考虑胰腺体尾部占位性病变与脾脏分界不清晰,有侵犯可能,建议在全身麻醉下行胰体尾切除+脾切除术,术中视病变情况决定具体手术方式。
患者及家属均签署知情同意书。
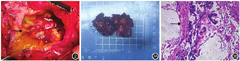
患者于2019年1月4日行胰体尾切除+脾切除术。术中可见:胰腺体尾部可及一囊实性肿瘤,壁厚约1 cm,肿瘤大小约14 cm×10 cm,内充满胶冻样坏死物质(图2)。肿瘤不规则,侵及胃后壁、脾门、横结肠及其系膜,异常致密。腹膜后多发肿大淋巴结。术中送检胰腺肿瘤,快速冷冻切片病理学检查结果示胰腺肿瘤镜下为胰腺组织,导管上皮增生,细胞复层排列,核大、深染,异型明显,并见大量的黏液湖形成,考虑导管来源腺癌。术后病理学检查结果示胰体尾黏液性囊腺癌。肿瘤大体标本呈灰白灰红黏冻样,表面粗糙不平呈菜花状(图3A);肿瘤镜检示肿瘤呈多房囊状,内衬单层或复层黏液上皮;细胞核增大,排列紊乱,具异型,并浸润生长;另见囊腔破裂,多层黏液溢出形成纤维间质反应(图3B)。脾脏局灶区缺血性梗死。患者术后第8天出院,门诊随访至2019年2月,恢复良好。

胰腺黏液性囊性肿瘤(mucious cystic neoplasm,MCN)是一类少见的胰腺原发性囊性上皮样肿瘤,多见于胰腺体尾部,有恶变倾向[1,2]。瘤体中含有卵巢样间质是MCN的重要病理学特征[3]。WHO将MCN分为侵袭性与非侵袭性,将非侵袭性囊腺癌定义为重度不典型性增生,轻-中度不典型性增生的MCN则定义为癌前病变[4]。MCN多发于中老年女性,本例患者为老年男性,较为少见,容易误诊为胰腺导管内乳头状黏液肿瘤(intraductal papillary mucinous neoplasm,IPMN)。胰腺MCN进展比较缓慢,临床症状无特异性,30%患者无明显临床症状,恶心、呕吐、腹上区隐痛、饱胀感、腹部包块为常见症状,有时可伴有黄疸、发热和体质量下降等[5]。本例患者主要表现为腹上区疼痛和腹胀。
血清CEA、CA19-9检测有一定诊断价值。胰腺MCN检查CEA和CA19-9可升高且提示病期较晚,肿瘤侵犯血管或已有转移[6]。本例患者血清CEA、CA19-9均升高。胰腺MCN CT平扫检查结果示:囊壁厚薄不均,囊内少量分隔,有时见乳头状结节突入腔内,恶性者囊壁和分隔常较厚。CT增强检查示黏液性囊性肿瘤的不规则厚壁、间隔和附壁结节强化。MCN MRI检查示体积大,壁较厚,囊内信号T2加权成像可低可高,T2加权成像可高或稍高[7]。有时胰腺MCN影像表现为单房、囊壁无增生结节的病灶,容易误诊为胰腺假性囊肿[8]。通常结合病史(排除胰腺炎和胰腺外伤史)能明确诊断。MCN与分支导管导管内乳头状黏液性肿瘤有相似的影像学表现,判断瘤体与胰管的关系是诊断的关键,MCN与胰管不相通,而IPMN及胰腺假性囊肿多与胰管相通[9]。MRI和ERCP检查有助于鉴别诊断[10]。
鉴于MCN生物学特性多应尽早行手术治疗。侵袭和非侵袭性MCN建议行胰腺切除及淋巴结清扫术,切除范围根据肿瘤位置和肿瘤大小确定,切缘距肿瘤距离>1 cm[11,12,13]。胰腺囊性肿瘤性质未明确前切忌盲目行"囊肿"内引流。黏液性囊肿为多房性囊肿,囊肿壁有乳头状、菜花样结节者常提示MCN,必要时术中行快速冷冻切片病理学检查以明确诊断。本例患者肿瘤大体标本呈灰白灰红黏冻样,表面粗糙不平呈菜花状,镜检示肿瘤呈多房囊状,病理学诊断为胰腺黏液性囊腺癌(侵袭性MCN)。有学者提出激素替代疗法治疗MCN,还有待于临床进一步验证,手术切除仍是最合理的治疗方法[14]。MCN伴轻-中度不典型性增生患者术后5年生存率可达100%,重度不典型性增生及侵袭性MCN患者术后2年和5年生存率分别为67%和50%[15]。
综上,CT和MRI检查是胰腺MCN主要的检查手段,影像学检查结果结合CA19-9检测可以作为术前判断的重要指标,早期手术治疗是患者获得满意预后的合理选择。
所有作者均声明不存在利益冲突


























