
总结19家移植中心已开展ABO血型不相容亲属活体肾移植(ABOi-KT)的临床效果,为临床开展ABOi-KT提供可借鉴经验。
收集2006年12月至2019年12月各中心已开展ABOi-KT和同期ABO血型相容亲属活体肾移植(ABOc-KT)的临床资料,从组织配型、术前处理方案、术后并发症、移植物及受者存活率方面进行统计分析,评估国内现阶段ABOi-KT的效果。
342例ABOi组和779例ABOc组供、受者相比,(1)年龄、体重指数、供受者关系及术前透析等待时间等没有显著差别;(2)ABO血型:各移植中心O型受者等待名单最长,实施O型受者ABOi-KT,特别是A型给O型的比例最高;(3)HLA配型:两种手术在错配率、群体反应性抗体(PRA)I类、PAR Ⅱ类的阳性率无明显差异;(4)术前抗CD20单抗的使用根据不同时期应用方案不同;(5)外科并发症:开展ABOi-KT的早期以出血最为常见,现阶段可见血管内微血栓形成,与ABOc-KT相比,并发症发生率并无显著性差异;(6)术后1、3、5、10年移植肾存活率和受者存活率均较高,1年内急性排斥反应(AR)发生率和血肌酐水平较低,与ABOc-KT相当。
ABOi-KT技术成熟、安全有效,各移植中心可根据需要开展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
ABO血型不相容肾移植(ABOi-KT)是扩大肾源的有效方法之一。特别是近十多年,欧美及亚洲许多国家相继报道,ABOi-KT术后远期受者/移植肾存活率与ABO血型相容肾移植(ABOc-KT)相当甚至更高,这极大地激发了移植专家对ABOi-KT技术的研究热情[1]。我国自2006年12月开始引进此项技术[2],现结合前期临床资料和相关文献,我们总结了14年来全国19家移植中心已开展ABOi-KT的治疗效果,为临床开展ABOi-KT提供可借鉴经验。现总结如下。
收集2006年12月至2019年12月间全国19家已开展ABOi-KT单位共计342例ABOi-KT(ABOi组)及同期779例ABOc-KT(ABOc组)的相关资料进行回顾性分析。所有病例均通过了各移植单位的伦理委员会审批。
342例ABOi组供者中,男性103例,女性239例,年龄(47.22±8.23)岁,体重指数(23.19±1.53)kg/m2;779例ABOc组供者中,男性246例,女性533例,年龄(51.36±7.46)岁,体重指数(24.01±2.04)kg/m2。
342例ABOi组受者中,男性257例,女性85例,年龄(34.45±7.36)岁,体重指数(24.56±4.31)kg/m2,术前接受透析时间(29.00±16.31)个月;779例ABOc组受者中,男性637例,女性142例,年龄(32.75±5.69)岁,体重指数(22.17±3.80)kg/m2,术前接受透析时间(23.44±16.74)个月。
ABOi组父母供子女253例,兄弟姐妹间供肾21例,姑舅供侄甥9例;ABOc组父母供子女614例,兄弟姐妹间供肾63例,姑舅供侄甥9例。
各中心实施的ABOi-KT中O型血受者比例较高,具体血型分布情况见表1。ABOi组供、受者ABO血型匹配情况:A型供B型56例(16.4 %),B型供A型76例(22.2 %),AB型供A型13例(3.8 %),AB型供B型10例(2.9 %),A型供O型123例(36.0 %),B型供O型21例(6.1 %),AB型供O型43例(12.6 %)。
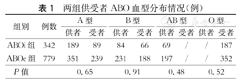
两组供受者ABO血型分布情况(例)
两组供受者ABO血型分布情况(例)
| 组别 | 例数 | A型 | B型 | AB型 | O型 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 供者 | 受者 | 供者 | 受者 | 供者 | 受者 | 供者 | 受者 | ||
| ABOi组 | 342 | 189 | 89 | 84 | 66 | 69 | / | / | 187 |
| ABOc组 | 779 | 351 | 239 | 231 | 188 | 197 | / | / | 352 |
| P值 | 0.65 | 0.91 | 0.48 | 0.52 | |||||
两组间不论是HLA错配率还是PRA Ⅰ类、Ⅱ类阳性率相比,差异均无统计学意义(P>0.05,表2)。
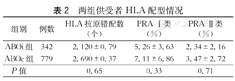
两组供受者HLA配型情况
两组供受者HLA配型情况
| 组别 | 例数 | HLA抗原错配数(个) | PRA Ⅰ类(%) | PRA Ⅱ类(%) |
|---|---|---|---|---|
| ABOi组 | 342 | 2.120±0.79 | 5.26±3.63 | 2.34±2.16 |
| ABOc组 | 779 | 2.690±0.37 | 7.11±6.86 | 3.47±2.72 |
| P值 | 0.65 | 0.33 | 0.71 |
所有供、受者进行术前常规检查和肾移植配型检测,所有结果符合肾移植要求后进行预处理。目前,术前免疫诱导主要根据外周血CD19+B细胞的比例来选择不同方案,并在使用过程中根据比例变化做动态调整。具体如下:(1)CD19+B细胞比例在10 %~15 %之间者,按受者体表面积1.73 m2计算,术前4周、术前24 h分别使用利妥昔单抗100 mg和100 mg;(2)CD19+B细胞比例≥15 %者,按体表面积1.73 m2计算,术前4周、术前24 h分别使用利妥昔单抗200 mg和100 mg;(3)CD19+B细胞比例≤10 %者,按体表面积1.73 m2计算,仅术前4周使用利妥昔单抗100 mg即可。
对于群体反应性抗体(PRA)阳性受者,联合使用利妥昔单抗、血浆双重滤过(DFPP)或(和)血浆置换(PE)。各大移植中心普遍采用在抗CD20单抗基础上,应用钙调磷酸酶抑制剂联合1种抗增殖类药物加糖皮质激素的三联免疫抑制方案作为免疫诱导方案,但剂量较维持量低。对存在高危或高致敏因素的受者(如PRA水平高、再次移植等)常规使用抗人胸腺免疫球蛋白(ATG)等多克隆抗体进行免疫诱导。
临床上常见的血型抗体处理方案包括:(1)单用PE;(2)单用DFPP;(3)单用IA;(4)PE+DFPP;(5)PE/DFPP+静注免疫球蛋白(IVIG);(6)移植前2~4周,初始血型抗体(IgG和IgM)效价≤1:8(凝胶法重复检测)的受者仅口服免疫抑制剂进行预处理,不使用利妥昔单抗抑制新的血型抗体产生,也不使用PE或DFPP清除已产生的血型抗体。
受者术前1周予以甲泼尼龙80 mg行免疫诱导治疗,术前6 d起隔日行DFPP和PE以去除血浆中的血型抗体,手术当日静脉滴注抗CD20单抗500 mg。术后行免疫抑制治疗,第2天起给予他克莫司注射液1 mg·kg-1·d-1;静脉输注吗替麦考酚酯(MMF)2.0 g/d,6 d后改为口服,1.5 g/d,2周后改为1 g/d;甲泼尼龙500 mg静脉滴注,以后每日递减80 mg,1周后改为20 mg/d,3周后用5 mg/d维持(图1)。同时输注血液、血浆、白蛋白等对症支持治疗及抗凝治疗。
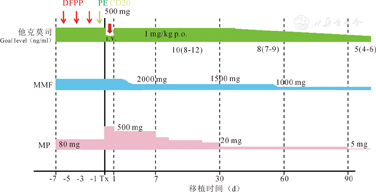

即在术前28 d开始使用利妥昔单抗,剂量为100或200 mg。
受者基础血型抗体(IgG)滴度为1∶64(1∶1~1∶2048),经血浆处理4次(2~6次)后,术前血型抗体(IgG)滴度降至1∶4(0~1∶32),手术当天可追加利妥昔单抗100 mg。免疫抑制剂的诱导与治疗和之前基本相同。术后很长一段时间,持续监测血型抗体滴度,使其维持在低水平。
新的围手术期方案,出血已不是最大风险,防治血栓性微血管病更为重要。由于供、受者间ABO血型不相容,移植肾血管内皮细胞和肾小管上皮细胞表面表达的血型抗原可与受者血浆中的预存血型抗体相结合,促发凝血反应,致使移植肾血管内微血栓形成。要保证术后不出现移植肾血管内微血栓形成,需进行有效的抗凝治疗。
ABOi-KT实施时出现的凝血功能紊乱,多由血浆处理时凝血因素大量丢失而为纠正所致。具体止血途径包括:(1)外科性术后出血,行手术止血;(2)凝血因子丢失所致出血,则输入新鲜AB型血浆、冷沉淀,使用止血药物,同时使用肝素抗凝;(3)低温可加重凝血功能障碍,整个围手术期建议使用电热毯等保温措施,维持体温在36 ℃以上;(4)酸中毒可加重凝血功能障碍,维持内环境酸碱平衡十分必要;(5)如受者术后因低凝所致局部血肿,可不积极清除血肿。
应用SPSS(22.0版)软件进行统计处理,等级变量的比较采用卡方检验;连续性变量用均数±标准差( ±s)表示。连续变量间的比较采用独立样本Student'st检验。P<0.05认为差异具有统计学意义。
±s)表示。连续变量间的比较采用独立样本Student'st检验。P<0.05认为差异具有统计学意义。
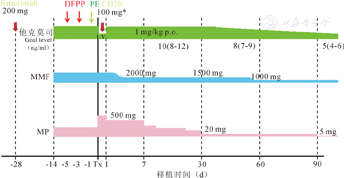

两组间供、受者资料及供受者关系的比较,差异均无统计学意义(P>0.05)。
据统计,ABOi-KT组常见外科并发症包括出血、血栓形成、移植肾动脉狭窄等;与ABOc-KT组并发症的发生率相比,差异并无统计学意义(P>0.05,表3)。
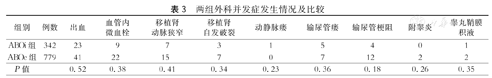
两组外科并发症发生情况及比较
两组外科并发症发生情况及比较
| 组别 | 例数 | 出血 | 血管内微血栓 | 移植肾动脉狭窄 | 移植肾自发破裂 | 动静脉瘘 | 输尿管瘘 | 输尿管梗阻 | 附睾炎 | 睾丸鞘膜积液 |
|---|---|---|---|---|---|---|---|---|---|---|
| ABOi组 | 342 | 23 | 9 | 7 | 3 | 1 | 5 | 4 | 0 | 1 |
| ABOc组 | 779 | 41 | 22 | 15 | 7 | 0 | 7 | 12 | 2 | 2 |
| P值 | 0.52 | 0.38 | 0.41 | 0.34 | 0.23 | 0.36 | 0.18 | 0.26 | 0.35 |
各中心反馈的数据表明,ABOi-KT术后1、3、5、10年的受者存活率和移植肾存活率均较高,1年内急性排斥反应(AR)发生率较低,出院时和1年时的血肌酐水平较低,与ABOc-KT受者相比并无明显差异,治疗效果较好(表4)。
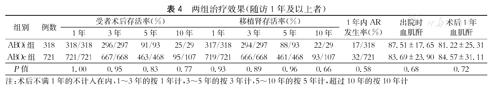
两组治疗效果(随访1年及以上者)
两组治疗效果(随访1年及以上者)
| 组别 | 例数 | 受者术后存活率(%) | 移植肾存活率(%) | 1年内AR发生率(%) | 出院时血肌酐 | 术后1年血肌酐 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1年 | 3年 | 5年 | 10年 | 1年 | 3年 | 5年 | 10年 | |||||
| ABOi组 | 318 | 318/318 | 296/297 | 91/93 | 25/29 | 317/318 | 294/297 | 88/93 | 22/29 | 17/318 | 87.51±17.65 | 81.22±25.31 |
| ABOc组 | 721 | 721/721 | 667/668 | 463/468 | 95/107 | 719/721 | 666/668 | 461/468 | 93/107 | 32/721 | 83.69±23.90 | 84.57±31.11 |
| P值 | 1.00 | 0.95 | 0.83 | 0.77 | 0.93 | 0.89 | 0.96 | 0.66 | 0.58 | 0.68 | 0.72 | |
注:术后不满1年的不计入在内,1~3年的按1年计,3~5年的按3年计,5~10年的按5年计,超过10年的按10年计
自Alexandre等[3]利用PE和脾切除术完成全球首例ABOi-KT以来,经过50余载的发展,ABOi-KT技术已成为治疗终末肾病患者的有效途径。特别是随着新型免疫抑制剂的广泛应用,如利妥昔单抗、他克莫司和吗替麦考酚类等,ABOi-KT术后5年移植肾存活率和受者存活率均显著延长,甚至比ABOc-KT更高。
利妥昔单抗是一种嵌合型人抗鼠CD20单抗,它可以特异性地与B淋巴细胞表面的CD20抗原结合,清除致病性B淋巴细胞。近来有较多文献报告,利妥昔单抗可有效抑制移植后体液性排斥反应和自身免疫病[4]。抗CD20单抗在ABOi-KT中的应用可大致分为三个阶段:(1)大剂量使用阶段:2006年12月至2011年12月;(2)减量使用阶段:2012年1月至2016年12月;(3)低剂量使用阶段:2017年1月至今。我们的研究表明,围手术期使用低剂量(100或200 mg)利妥昔单抗可以使ABOi-KT受者的血型抗体滴度显著降低,术后加用MMF、他克莫司和激素等,免疫抑制效果较好。
另外,我们发现,与ABOc-KT相比,ABOi-KT术后外科并发症的种类以及发生率均没有显著区别。由于术前多次血浆处理,凝血因子、血小板损失或功能异常,肝素、枸橼酸钠等抗凝药物的应用,可能导致受者凝血功能紊乱,有文献报道这可能增加出血概率[5,6]。很多移植中心在采用PE和DFPP后,往往以白蛋白作为替代液[3],致使血小板减少,凝血因子丢失[7]。APTT和PT实验可以用来检测内源性和外源性凝血功能,但XIII因子的丢失可能不被这两种手段检测到[8],导致APTT和PT处于正常值范围的出血。如有出血迹象,则输入新鲜AB型血浆和冷沉淀,并根据检测到的凝血功能异常的具体情况,来补充相应凝血因子或凝血酶原复合物。随着利妥昔单抗的应用,血浆处理次数的减少,出血倾向减少,对于术前凝血功能正常的,通常可根据术后凝血功能状态,给予抗凝药物,其长期效果可能优于不抗凝者[9],这也与国外报道相一致[10]。
ABOi-KT受者术前处理的中心环节是尽可能清除体内已经存在的抗A、抗B血型抗体,避免发生HAR,具体目标有:(1)降低预存的ABO血型抗体滴度水平;(2)降低由于B淋巴细胞转化后导致的ABO血型抗体反弹;(3)调整好受者的凝血功能状态。数据表明,ABOi-KT术后HAR发生率和ABOc-KT相比没有显著区别[11]。但ABOi-KT术后48 h到2周是排斥反应的高发期,处理不当可能导致该时间段排斥反应发生率高于ABOc-KT[12]。C4d染色对ABOi-KT术后体液性排斥反应诊断没有实际指导意义[13]。
ABOi-KT通常采用更强的免疫抑制,包括多次血浆处理及利妥昔单抗的使用,这增加了受者术后发生感染的风险。部分研究证实,ABOi-KT受者术后巨细胞病毒(CMV)、单纯疱疹病毒(HSV)、带状疱疹病毒(VSV)、多瘤病毒(BKV)感染以及肺炎发生率均高于ABOc-KT[14,15]。数据显示,术前使用利妥昔单抗并非是增加术后感染风险的主要原因[16]。血浆处理过程中血液和外界接触、经验不足、不规范操作是可能带来感染风险的原因之一。此外,血浆处理后受者的低免疫球蛋白及低补体状态也可能会大幅增加感染几率[17]。如果一旦发生感染,必要时需停用免疫抑制药物。
另外,肾移植后大量使用免疫抑制剂可使肿瘤发病率明显增加,约为同龄普通人群的100倍。但ABOi-KT和ABOc-KT受者相比,二者术后肿瘤发生率没有差异性[18]。停用或减用CNI是治疗术后肿瘤的基础,或可将其替换为mTOR抑制剂。
综上,ABOi-KT是目前缓解供肾短缺的最有效途径。各移植中心为探索标准化的ABOi-KT方案、延长移植肾存活时间做出了很多努力,但仍存在一些亟待解决的问题,如探索最小化免疫抑制治疗方案,以及如何减少、避免术后并发症和不良反应等。尽管如此,ABOi-KT依然是一种相对安全的治疗衰竭期肾病的有效方法。
所有作者均声明不存在利益冲突



























