版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗菌药物合理应用是细菌感染性疾病治疗的核心,近年来,我国临床分离菌株对常用抗菌药物的耐药率呈持续增长的趋势,多重耐药菌越来越常见[1],治疗难度增加,医疗负担加重[2]。抗菌药物疗程过长是导致耐药的主要原因之一,合理的停药时机仍是临床面临巨大难题。实验诊断技术的快速发展,为抗菌药物合理应用提供了更多的参考依据。
降钙素原(PCT)已被广泛应用于细菌感染性疾病诊断和治疗的重要参考指标,PCT在下呼吸道感染和重症监护病房(ICU)重症感染患者抗菌药物治疗疗程中的指导价值逐渐被认可。为充分发挥该炎症标志物的作用,进一步促进我国抗菌药物的合理应用,共识小组广泛征求国内多学科专家意见,并经过多次会议讨论,共同制定了本共识。本共识的适用范围为怀疑或诊断为成人下呼吸道感染和ICU重症感染患者。
证据质量等级和推荐强度等级依据推荐分级的评估、制定与评价(GRADE)系统进行分级,证据等级分高、中、低、极低四级,推荐等级分为强、弱两级(表1)[3,4]。

证据等级和推荐强度
证据等级和推荐强度
| 证据等级和推荐强度 | 定义 | |
|---|---|---|
| 证据等级 | ||
| 高 | 对真实效果值接近效应估计值很有信心 | |
| 中 | 对效应估计值有中等程度的信心:真实值有可能接近估计值,但仍存在二者截然不同的可能性 | |
| 低 | 对效应估计值的确信程度有限:真实值可能与估计值大不相同 | |
| 极低 | 对效应估计值几乎没有信心:真实值很可能与估计值大不相同 | |
| 推荐强度 | ||
| 强推荐 | 支持或反对某项干预措施的强烈推荐,且利大于弊 | |
| 弱推荐 | 支持或反对某项干预措施的条件推荐,利弊不确定 | |
推荐意见1:临床怀疑不明原因感染及脓毒症时,建议及时行PCT检测,以帮助进一步明确细菌感染性疾病的诊断。(高证据等级,强推荐)
生理情况下,PCT由116个氨基酸组成,在甲状腺C细胞中由前体物质(141-氨基酸)脱去25个氨基酸序列而产生,随后在转化酶的作用下分解生成降钙素(32-氨基酸)。因而健康成人血清PCT水平很低,通常不超过0.05 μg/L[5]。
细菌感染时,宿主炎症应答产生的促炎因子诱导甲状腺以外的组织(如肝脏、肺、肠道等)合成PCT,由于这些组织细胞中缺乏分泌颗粒和转化酶,PCT未经处理即以原形释放入血,从而导致血清浓度显著升高。病毒感染时,机体释放的γ干扰素可抑制PCT的产生,因此,PCT是细菌感染较为特异的炎症标志物[6]。动力学数据显示,细菌感染可快速诱导PCT产生,2~6 h即可升高,12 h达峰[7],临床怀疑是细菌感染性疾病的患者及时检测PCT,有助于细菌感染性疾病的早期诊断。
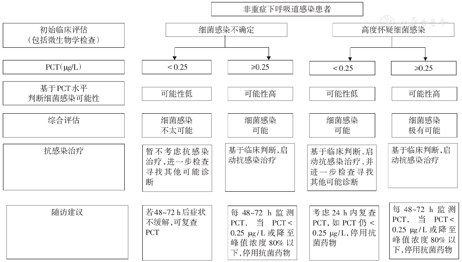
推荐意见2:对于疑似为下呼吸道感染的患者,当PCT≥0.25 μg/L,提示细菌感染的可能性高,建议启用经验性抗菌治疗。(低证据等级,弱推荐)
下呼吸道感染主要包括社区获得性肺炎(CAP)、急性支气管炎、慢性阻塞性肺疾病急性加重(AECOPD)等,鉴别是否存在细菌感染和可能的病原体种类对于决定是否使用抗菌药物具有重要参考价值。
细菌感染患者PCT水平往往高于非细菌感染患者,一项荟萃分析显示,PCT鉴别细菌(含不典型病原体)和非细菌感染的受试者工作特征曲线下面积(AUC)为0.72,其中,细菌感染较不典型病原体(军团菌除外)感染升高更为显著[8]。
Rodríguez等[9]使用0.25 μg/L作为临界值评估流行性感冒患者是否合并细菌感染时,阴性预测值可达92%。在观察性研究中,因使用的临界值不同,相应敏感性和特异性变化较大。几项下呼吸道感染的随机对照研究[10,11,12]参考临界值0.25 μg/L判断细菌感染可能性,以及是否建议启动抗菌治疗,结果显示,PCT指导下的抗菌治疗,抗菌药物处方率显著下降,且安全性良好[8]。
因此,对于疑似下呼吸道感染的患者,当PCT≥0.25 μg/L时,提示存在细菌感染的可能大;但将PCT用于排除诊断时需谨慎,因此,即使PCT<0.25 μg/L,而临床高度怀疑细菌感染时,仍可启动经验性治疗,并及时复查PCT。
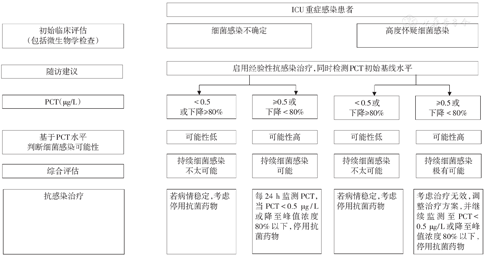
推荐意见3:对于怀疑脓毒症的患者,应立即启动经验性抗菌治疗。PCT≥0.5 μg/L时,有助于脓毒症诊断(高证据等级,强推荐),高水平PCT(尤其>10 μg/L时)提示革兰阴性菌感染可能性更高。(低证据等级,弱推荐)
PCT是脓毒症较为特异的炎症标志物,在全身炎症反应综合征(SIRS)的患者中,早期识别细菌感染的效能优于C反应蛋白(CRP),与序贯器官衰竭评分(SOFA)有较好的相关性,有助于病情严重程度评估[13,14,15,16,17]。一项纳入3 244例患者的荟萃分析显示,PCT诊断脓毒症的AUC可达0.85[18]。目前普遍使用的诊断脓毒症的临界值为0.5 μg/L[19,20,21]。
大多数脓毒症患者病情进展迅速,有效抗菌治疗的延迟将导致病死率增加[22],因此,怀疑是脓毒症的患者应立即启动经验性治疗,不应等待PCT检测结果而延误最佳治疗时机。若PCT低水平,则考虑复测,并排查其他可能诊断。
不同病原体诱导的宿主应答有所不同,PCT水平也呈现不同程度的升高。革兰阴性菌细胞壁中的脂多糖导致促炎因子大量释放,进而诱导PCT合成,因此,革兰阴性菌血流感染患者PCT水平较革兰阳性菌血流感染患者升高更为显著[23,24,25]。一项纳入4 858例患者的观察性研究显示,PCT预测革兰阴性菌菌血症AUC为0.72,最佳临界值为10 μg/L,其中以大肠埃希菌和其他肠杆菌细菌菌血症升高最为显著[26]。不同研究报道的PCT水平差异较大,考虑到重症患者对诊断指标的准确性要求更高,因此,PCT高水平提示革兰阴性菌感染可能性更高,为病原体的鉴别提供参考,但尚不足以指导治疗决策。真菌引起的血流感染时,PCT也可升高,但升高幅度不如革兰阴性菌[23,27],初始经验性治疗后PCT未明显下降,应结合患者免疫状况、基础疾病等合并因素及其他检查结果,警惕真菌感染可能。
推荐意见4:存在院内感染风险的患者,如接受长期机械通气、外科手术治疗、留置动脉或静脉导管等,建议动态监测PCT变化。若出现PCT显著升高提示细菌感染可能,应结合临床,及时予以抗菌药物治疗。(中证据等级,强推荐)
尽管重症感染患者不建议等待PCT检测结果来决定是否启动抗菌治疗,但是对于有院内感染风险的患者,如接受长期机械通气、留置静脉或动脉导管、手术或创伤等,常规监测PCT对于院内细菌感染的早期发现和及时干预仍有积极作用[28,29,30,31,32]。
推荐意见5:PCT检测不能取代微生物学检查,病原微生物仍是细菌感染诊断的金标准,因此,怀疑细菌感染时应在抗菌药物使用前合理留取标本送检。(高证据等级,强推荐)
推荐意见6:已启动抗菌治疗的患者,建议合理监测PCT的动态变化,及时评估治疗疗效(高证据等级,强推荐)。ICU感染患者推荐每24 h监测,PCT无明显下降或不降反升,需积极寻找原因,考虑调整治疗方案;非重症下呼吸道感染患者可适当降低监测频率至48~72 h。(低证据等级,强推荐)
PCT消除迅速,半衰期为20~24 h[7]。PCT水平与感染严重程度相关,监测其动态变化趋势能够及时反映治疗应答。随着有效的抗菌治疗,PCT水平逐步下降;PCT下降不明显,或不降反升,往往提示疗效不佳或无效,需考虑调整治疗方案。脓毒症治疗3 d后,PCT下降不到80%的患者28 d病死率是下降超过80%的患者的两倍(P=0.001)。尽管初始PCT水平有助于评估预后,但治疗期间的下降速度对预后判断的价值更大[33,34]。因此,建议结合PCT动力学特点和病情的严重程度,合理监测。ICU重症感染患者每24 h监测,有助于及时了解患者病情变化;下呼吸道感染的住院患者经验性治疗48~72 h应进行疗效评估,基于临床症状和体征、影像学改变、PCT等炎症标志物水平的变化,调整治疗药物;门诊的轻症患者可不必常规动态监测,若治疗48~72 h后症状不缓解,可复查PCT。需要指出的是,病程的早期PCT可能不升高或仅轻度升高,如有必要,考虑6~24 h复查。
推荐意见7:对于非重症下呼吸道感染患者,当PCT下降至0.25 μg/L或峰值浓度80%以下,且病情稳定的情况下,建议停用抗菌药物。(高证据等级,强推荐)
抗菌治疗的疗程往往依赖于经验判断,需结合致病菌种类、耐药情况、感染严重程度和治疗应答等综合评估。延长治疗时间是否能够降低治疗失败率和复发率尚不明确,但增加不必要的抗菌药物暴露,可增加耐药风险[35]。
在现有感染生物标志物中,PCT检测已被大量随机对照临床研究验证用于指导抗菌药物停药,有助于优化抗菌药物疗程和个体化诊疗,且使用方便快捷。对于正在接受抗菌治疗的下呼吸道感染患者[36],当PCT下降至0.25 μg/L或峰值浓度80%以下,且病情稳定的情况下,可考虑停药,从而显著缩短抗菌药物治疗时间,对抗菌药物合理应用具有积极作用(表2)。
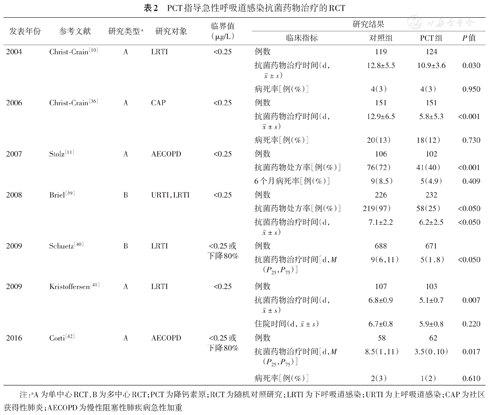
PCT指导急性呼吸道感染抗菌药物治疗的RCT
PCT指导急性呼吸道感染抗菌药物治疗的RCT
| 发表年份 | 参考文献 | 研究类型a | 研究对象 | 临界值(μg/L) | 研究结果 | |||
|---|---|---|---|---|---|---|---|---|
| 临床指标 | 对照组 | PCT组 | P值 | |||||
| 2004 | Christ-Crain[10] | A | LRTI | <0.25 | 例数 | 119 | 124 | |
抗菌药物治疗时间(d, ±s) ±s) | 12.8±5.5 | 10.9±3.6 | 0.030 | |||||
| 病死率[例(%)] | 4(3) | 4(3) | 0.950 | |||||
| 2006 | Christ-Crain[36] | A | CAP | <0.25 | 例数 | 151 | 151 | |
抗菌药物治疗时间(d,  ±s) ±s) | 12.9±6.5 | 5.8±5.3 | <0.001 | |||||
| 病死率[例(%)] | 20(13) | 18(12) | 0.730 | |||||
| 2007 | Stolz[11] | A | AECOPD | <0.25 | 例数 | 106 | 102 | |
| 抗菌药物处方率[例(%)] | 76(72) | 41(40) | <0.001 | |||||
| 6个月病死率[例(%)] | 9(8.5) | 5(4.9) | 0.409 | |||||
| 2008 | Briel[39] | B | URTI,LRTI | <0.25 | 例数 | 226 | 232 | |
| 抗菌药物处方率[例(%)] | 219(97) | 58(25) | <0.050 | |||||
抗菌药物治疗时间(d,  ±s) ±s) | 7.1±2.2 | 6.2±2.5 | <0.050 | |||||
| 2009 | Schuetz[40] | B | LRTI | <0.25或下降80% | 例数 | 688 | 671 | |
| 抗菌药物治疗时间[d,M(P25,P75)] | 9(6,11) | 5(1,8) | <0.050 | |||||
| 2009 | Kristoffersen[41] | A | LRTI | <0.25 | 例数 | 107 | 103 | |
抗菌药物治疗时间(d,  ±s) ±s) | 6.8±0.9 | 5.1±0.7 | 0.007 | |||||
住院时间(d,  ±s) ±s) | 6.7±0.8 | 5.9±0.8 | 0.220 | |||||
| 2016 | Corti[42] | A | AECOPD | <0.25或下降80% | 例数 | 58 | 62 | |
| 抗菌药物治疗时间[d,M(P25,P75)] | 8.5(1,11) | 3.5(0,10) | 0.017 | |||||
| 病死率[例(%)] | 2(3) | 1(2) | 0.610 | |||||
注:aA为单中心RCT,B为多中心RCT;PCT为降钙素原;RCT为随机对照研究;LRTI为下呼吸道感染;URTI为上呼吸道感染;CAP为社区获得性肺炎;AECOPD为慢性阻塞性肺疾病急性加重
近期一项Cochrane的系统评价,分析了26项已发表的随机对照临床研究的6 708例急性呼吸道感染患者的数据,结果显示,与常规治疗组相比,PCT组平均抗菌药物暴露时间显著缩短(P<0.001),抗菌药物相关不良事件发生率更低(P<0.001),且未增加治疗失败率(P=0.068)[37]。其中,AECOPD和急性支气管炎的患者获益最大。随机对照研究的结论在后续大规模"真实世界"研究中也得以验证[38]。
推荐意见8:对于正在接受抗菌药物治疗的ICU重症感染患者,当PCT下降至0.5 μg/L或峰值浓度80%以下,建议抗菌药物停药。(高证据等级,强推荐)
de Jong等[43]的研究是迄今为止规模最大的一项多中心临床研究,共入组1 546例ICU疑似或确诊细菌感染的重症患者,PCT组不仅抗菌药物治疗时间更短(P<0.001),同时1年病死率也更低(P=0.019)。入组患者中,49%为医院获得性感染;从感染部位来看,肺部感染占64%。
因此,对于正在接受抗菌药物治疗的重症感染患者,PCT的动态变化有助于指导停药时机的判断,且安全性良好[44],还可降低患者整体治疗费用。采用PCT指导治疗下呼吸道感染住院患者的治疗费用较常规治疗方案下降23%,脓毒症患者下降49%。这可能与抗菌药物用量减少、机械通气时间和住院时间缩短等因素有关[45]。不同于下呼吸道感染,重症感染患者一般采用更高的停药临界值(<0.5 μg/L或降至峰值浓度80%以下)(表3)。
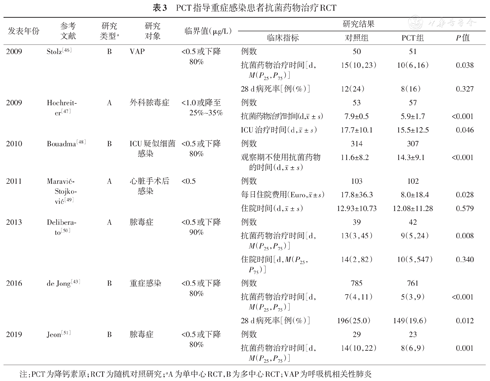
PCT指导重症感染患者抗菌药物治疗RCT
PCT指导重症感染患者抗菌药物治疗RCT
| 发表年份 | 参考文献 | 研究类型a | 研究对象 | 临界值(μg/L) | 研究结果 | |||
|---|---|---|---|---|---|---|---|---|
| 临床指标 | 对照组 | PCT组 | P值 | |||||
| 2009 | Stolz[46] | B | VAP | <0.5或下降80% | 例数 | 50 | 51 | |
| 抗菌药物治疗时间[d,M(P25,P75)] | 15(10,23) | 10(6,16) | 0.038 | |||||
| 28 d病死率[例(%)] | 12(24) | 8(16) | 0.327 | |||||
| 2009 | Hochreiter[47] | A | 外科脓毒症 | <1.0或降至25%~35% | 例数 | 53 | 57 | |
抗菌药物治疗时间(d, ±s) ±s) | 7.9±0.5 | 5.9±1.7 | <0.001 | |||||
ICU治疗时间(d, ±s) ±s) | 17.7±10.1 | 15.5±12.5 | 0.046 | |||||
| 2010 | Bouadma[48] | B | ICU疑似细菌感染 | <0.5或下降80% | 例数 | 314 | 307 | |
观察期不使用抗菌药物的时间(d, ±s) ±s) | 11.6±8.2 | 14.3±9.1 | <0.001 | |||||
| 2011 | Maravić-Stojković[49] | A | 心脏手术后感染 | <0.5 | 例数 | 103 | 102 | |
每日住院费用(Euro, ±s) ±s) | 17.8±36.3 | 8.0±18.4 | 0.028 | |||||
住院时间(d, ±s) ±s) | 12.93±10.73 | 12.08±11.28 | 0.579 | |||||
| 2013 | Deliberato[50] | A | 脓毒症 | <0.5或下降90% | 例数 | 39 | 42 | |
| 抗菌药物治疗时间[d,M(P25,P75)] | 13(3,45) | 9(5,24) | 0.008 | |||||
| 住院时间[d,M(P25,P75)] | 14(2,82) | 10(5,547) | 0.340 | |||||
| 2016 | de Jong[43] | B | 重症感染 | <0.5或下降80% | 例数 | 785 | 761 | |
| 抗菌药物治疗时间[d,M(P25,P75)] | 7(4,11) | 5(3,9) | <0.001 | |||||
| 28 d病死率[例(%)] | 196(25.0) | 149(19.6) | 0.012 | |||||
| 2019 | Jeon[51] | B | 脓毒症 | <0.5或下降80% | 例数 | 29 | 23 | |
| 抗菌药物治疗时间[d,M(P25,P75)] | 14(10,22) | 8(6,9) | 0.001 | |||||
注:PCT为降钙素原;RCT为随机对照研究;aA为单中心RCT,B为多中心RCT;VAP为呼吸机相关性肺炎
推荐意见9:监测PCT水平及其动态变化,并结合临床实际情况综合评估,指导下呼吸道感染和ICU重症感染患者抗菌药物治疗,以减少抗菌药物暴露,对降低耐药风险有积极作用,可作为辅助抗菌药物管理的有用工具。(低证据等级,弱推荐)
可参照图1,图2的流程[19,52],监测PCT水平及其动态变化,结合患者临床症状、体征、影像学、病原微生物检查和其他检查结果,综合评估患者细菌感染的风险,指导下呼吸道感染和ICU重症感染患者抗菌药物的合理应用。
尽管PCT对细菌感染的诊断具有较高的特异性,但一些非感染因素同样会影响PCT的生成和消除,尤其在影响PCT水平的非感染因素与细菌感染并存时,需谨慎解读检测结果(表4)。
推荐意见10:非典型病原体肺炎、肺结核、局限性感染如软组织脓肿等患者,PCT可不升高[53,56,57],不能仅依据PCT结果决定是否启动抗菌治疗,应结合临床。(低证据等级,强推荐)
推荐意见11:外科大手术后PCT可短暂升高,建议手术后监测PCT的动态变化,早期发现术后细菌感染。(低证据等级,强推荐)
外科大手术后PCT常常会出现短暂升高,如无细菌感染发生,一般于术后第1至2天达峰,随后开始逐渐下降[58,59]。升高幅度和持续时间可能与手术类型、手术时间有关。PCT在骨科大手术后升高幅度较小,峰值多在脓毒症诊断临界值0.5 μg/L以下[60,61];腹部及胸心外科手术后升高更为显著,常常超过0.5 μg/L[59,62];发生术后细菌感染的患者,PCT水平较未发生细菌感染的患者更高,且与感染严重程度相关[30]。荟萃分析[63]报道的腹部大手术后第3至5天诊断腹腔细菌感染的最佳临界值分别为1.45、1.28、1.26 μg/L。需要指出的是,现有报道的PCT诊断术后细菌感染的临界值差异较大,仍需进一步研究探索,因此,外科大手术后建议监测PCT,参考其动态变化趋势,及时发现术后细菌感染,PCT持续升高不降超过2 d或下降后再升高往往提示细菌感染的发生[64]。
推荐意见12:慢性肾脏病(CKD)患者PCT基线水平升高,建议使用更高的临界值,并结合临床综合判断。(低证据等级,弱推荐)
在不同程度CKD的患者中,均观察到PCT基线水平有所升高。有研究显示,CKD 5期患者升高更为显著。目前尚无统一的细菌感染诊断临界值,文献报道的最佳临界值在0.50~1.65 μg/L[65,66,67,68]。
推荐意见13:检测结果解读时,应区分健康人群参考限值和临界值的不同,不可将健康人群参考限值作为诊断细菌感染与否的临界值使用。
实验室检测项目的检测结果需与相应的参考体系进行比较,才能对患者的情况作出评估,帮助临床决策,因此,理解不同限值的含义是正确解读检验报告的前提,其中较为重要的是健康人群参考限值和临界值。
健康人群参考区间,是大多数健康人检测值所在区间,一般情况下,常选择95%分布范围的大小表示,参考区间的两端为参考限值。临界值(cut-off)即阳性判断值,则来源于临床患者的数据,是用于确认或排除诊断的医学决定水平。
健康人血浆PCT浓度一般低于0.05 μg/L,这是健康人群参考上限;而辅助诊断下呼吸道感染和脓毒症的临界值却为0.25和0.5 μg/L,不能混淆使用。误将健康人群参考限值用作下呼吸道感染或脓毒症的临界值,必然对检测结果的解读和抗菌药物的合理应用造成重大影响。
推荐意见14:建议使用具有溯源性的检测方法,确保检测结果的解读适用相应的参考体系,包括健康人群参考区间和临界值。
溯源性是为了确保检测结果的解读适用相应的参考体系,包括健康人群参考区间和临界值等,溯源性是结果和判读准确的重要保证。目前临床使用的0.25、0.5 μg/L的临界值是由勃拉姆斯PCT所建立,溯源至该体系的检测方法才能使用上述临界值,如电化学发光法;相反,不能溯源至该体系的检测系统需要建立自己的参考体系,随意套用临界值,可能影响结果解读和抗菌药物停用时机的判断。需要指出的是,溯源性是通过建立检测程序和校准品定值等复杂的过程,形成连续的量值传递链,实现检测结果的可追溯性,仅仅性能比对的相关性并不能代表具有溯源性。
本共识推荐意见的形成是基于溯源至勃拉姆斯PCT检测方法的相关临床研究数据。
推荐意见15:动态监测过程中,应使用同一种检测方法,确保病程前后的检测结果具有可比性,有利于评估病情变化和治疗的有效性。
PCT有多种检测方法,目前实验室常用的有电化学发光法、酶联免疫荧光法和免疫层析法等。前两种检测方法的变异系数(CV)较小,精密度高;而免疫层析法在床旁检测中更为常用,操作便捷,但精密度较低,对同一样本重复检测的结果波动较大[69]。
指导抗菌药物停药需要参考PCT在病程中的动态变化,从而对检测的精密度提出更高的要求。病程中随意更换检测方法,或使用CV较大、精密度较差的检测方法,会干扰对患者病情变化和治疗疗效的判断;尤其在0.25、0.5μg/L临界值附近检测结果的稳定性,对临床的决策影响更为显著。
正确使用和解读PCT,指导下呼吸道感染和ICU重症感染患者抗菌药物的治疗,有助于减少不必要的抗菌药物暴露,对于早期发现院内细菌感染、减少耐药风险具有积极的作用,可作为指导抗菌药物临床合理应用和管理的有效工具。
项目主持者:胡必杰(复旦大学附属中山医院);俞云松(浙江大学医学院附属邵逸夫医院)
执笔者:高晓东(复旦大学附属中山医院);骆煜(复旦大学附属中山医院);马玉燕(复旦大学附属中山医院)
共识制定专家组成员(按姓氏汉语拼音排序):陈佰义(中国医科大学附属第一医院);高晓东(复旦大学附属中山医院);何礼贤(复旦大学附属中山医院);黄怡(海军军医大学第一附属医院);胡必杰(复旦大学附属中山医院);金文婷(复旦大学附属中山医院);李六亿(北京大学第一医院);李敏(上海交通大学医学院附属仁济医院);刘运喜(中国人民解放军总医院);骆煜(复旦大学附属中山医院);马玉燕(复旦大学附属中山医院);邱海波(东南大学附属中大医院);潘珏(复旦大学附属中山医院);施毅(中国人民解放军东部战区总医院);王贵强(北京大学第一医院);王明贵(复旦大学附属华山医院);俞云松(浙江大学医学院附属邵逸夫医院);张静萍(中国医科大学附属第一医院)
所有作者均声明不存在利益冲突