
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
后循环缺血性卒中占卒中的25%~40%, 70%的后循环缺血性卒中是动脉–动脉栓塞所致。椎动脉起始部(vertebral artery origin,VAO)由于血流动力学紊乱等原因是最容易形成动脉粥样硬化的部位,因而成为了后循环缺血发生重要的原因之一[1]。研究表明,9%~33%的后循环缺血性的患者有椎动脉起始部狭窄(vertebral artery origin stenosis,VAOS)或者闭塞[2,3]。用新英格兰后循环缺血登记的年发病率测算,美国每年有1~2万的后循环缺血患者由VAOS导致[4]。但是VAOS的诊治并未引起人们足够的重视。为进一步提高症状性动脉粥样硬化性VAOS的认识,规范其诊治,尤其是血管内治疗,中华预防医学会卒中预防与控制专业委员会介入学组组织了国内神经内科、神经外科及血管介入科等学科的专家,编写了本共识。
VAOS由于研究基于的人群及观察方法不同,报道的VAOS发生率有较大的差异、Hass等[5]对3 788例脑血管造影患者的观察发现,VAOS是仅次于颈动脉分叉部狭窄的脑血管狭窄好发部位。一项基于935例健康及卒中患者的增强MRA检查研究发现,VAOS的发生率为12.7%[6]。两项基于尸检及血管造影检查研究显示,在有心脑血管危险因素的人群中,有超过50%的患者有VAOS。VAOS病理及形态与颈动脉狭窄也有不同。关于VAOS的狭窄发生率及病理见表1[4]。2014年,一项基于门诊无症状人群的超声研究提示,VAOS及闭塞的发生率为15.4%[7]。

VAOS与颈动脉狭窄的流行病学及病理特征比较[4]
VAOS与颈动脉狭窄的流行病学及病理特征比较[4]
| 临床特征 | 椎动脉起始部动脉粥样硬化 | 颈动脉球部动脉粥样硬化 | 颅内动脉粥样硬化 |
|---|---|---|---|
| 尸检检查发生率(%) | 14~39(>35岁) | 32~72(>35岁) | 31.4~44.8(>40岁) |
| 血管成像检查发生率(%,>35岁,来源于脑供血不足患者资料) | 18.4~40.7 | 33.8~67.9 | 27.7~44.5 |
| 动脉粥样斑块比例 | 低 | 高 | 低 |
| 纤维成分比例 | 高 | 低 | 高 |
| 溃疡 | 低 | 高 | 低 |
| 狭窄几何特征 | 向心性狭窄 | 偏心样狭窄 | 向心性狭窄 |
| 近似的年相关卒中 | 10 080~22 400 | 70 000~140 000 | 56 000~70 000 |
| 第一卒中复发风险(%) | 不清楚 | 18(基于kaplan–meier生存曲线) | 23 |
Moufarrij等[8]在1984年报道了89例症状性VAOS的患者5年的随访结果,发现症状性VAOS患者未经治疗,在其后5年卒中复发的风险为25%~35%、5年生存为60%,而匹配对照组5年生存率为87%,明显高于VAOS的患者(P<0.01)。
一项超过400例患者的后循环缺血研究发现,有超过20%的患者有VAOS,且VAOS可以解释超过9%的患者的缺血性卒中的发生,VAOS可以通过血栓栓塞、低灌注及二者混合的机制参与后循环缺血发生[9]。
一项基于尸检的研究结果发现,在259例致死性卒中的患者中,发现VAOS≥30%的狭窄率与后循环脑梗死发生明显相关[10]。
迄今,关于VAOS较为系统的自然史的研究为2013年Thompson单中心回顾性研究,作者观察接受血管成像(DSA、MRA或CTA)检查的358例卒中患者,发现有16.2%患者有VAOS。有VAOS的患者与该中心匹配的无VAOS的患者进行随访研究,结果发现有VAOS的患者出现后循环TIA、卒中及病死率分别是没有VAOS患者的1.6、1.7及6倍,在观察的5年期间,有VAOS患者的生存率为67%,而无VAOS的患者生存率为89%,无VAOS的患者生存率明显高于有VAOS的患者(P<0.01)。研究提示VAOS与后循环卒中的高发病率、密切相关[11]。
尽管VAOS导致卒中的风险较无VAOS风险明显的高,但是绝对卒中的风险仍然相对较低。如Compter等[12]在2011年研究发现,3 717例有动脉粥样硬化性血管病的患者,有282(7.4%)的患者有无症状的VAOS(≥50%的狭窄)或闭塞,在随后的4.6年随访中,有VAOS的患者年后循环缺血性卒中发生率明显高于无VAOS的患者(HR 4.2、95%CI 1.4 ~ 13.1),但是绝对的年卒中发生率并不高,仅为0.4%,而在同期的无VAOS的患者中,后循环的缺血性卒中年卒中发生率<0.1%。
VAOS的诊断金标准仍然是DSA检查。然而DSA检查为有创的检查,涉及到一定的卒中的风险及其他并发症[13]。经颅彩色多普勒(transcrnial color Doppler, TCCD)CT及磁共振的血管成像检查等无创检查方法可以作为VAOS筛查及辅助诊断工具[14]。经颅彩色多普勒对VAOS检查有很高的特异性(93%~98%)但是敏感性较低(70%),有人把PSV>140 cm/s作为超声诊断VAOS>50%的指标[15,16]。近年来一项系统分析提示,应用对比剂的CTA、MRA对50%~99%VAOS的诊断敏感性分别为100%和94%,两者的特异性达95%[14]。
推荐意见:
1.鉴于VAOS在后循环卒中/TIA中起重要作用,应该高度重视VAOS的评估与诊断。
2.VAOS的诊断应该遵循无创的检查作为首选的检查,TCCD对VAOS检查有很高的特异性,但是敏感性较低;对比剂增强的CTA/MRA有更高的敏感性及特异性。
3.在无创的检查怀疑有≥50%VAOS的症状性患者,为进一步明确VAOS的狭窄程度必要时行血管内治疗,在有经验的中心可以考虑行DSA全脑血管造影检查。
VAOS的治疗目前缺乏的循证医学证据。对于无症状的VOAS患者仅需积极控制动脉粥样硬化性的危险因素;对于有症状的VAOS的患者,应该积极治疗。目前的治疗方法除有效控制危险因素外,有药物治疗、外科手术以及介入治疗。
目前缺乏症状性动脉粥样硬化性VAOS药物治疗的系统研究。在ESPS研究中发现,联合双嘧达莫与阿司匹林能减低后循环缺血的风险[17],也有研究提示症状性VAOS单独应用抗血小板聚集的疗效是很有限的[18],而抗凝治疗的作用并没有比抗血小板聚集更好,而且有更高的不良反应发生率[19]。
症状性动脉粥样硬化性VAOS药物治疗推荐意见:
1.药物治疗仍然症状性动脉粥样硬化性VAOS的基础治疗,药物治疗主要包括危险因素控制、抗血小板聚集治疗及他汀类药物,其他应注意不良生活方式的改变(如戒烟、加强锻炼等)。
2.不推荐症状性动脉粥样硬化性VAOS的患者采用抗凝治疗。
症状性动脉粥样硬化性VAOS外科治疗的主要方式有转植和搭桥手术。最早报道的VAOS的外科治疗是1958年采用椎动脉–颈总动脉的转植。1990年Ausman等[20]报道的一组颅内动脉搭桥治疗VAOS导致的后循环管缺血83例,结果有8.4%的病死率及13.3%的并发症发生。其他的关于外科治疗的研究总结见表2[4]。
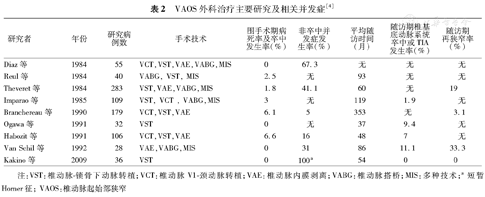
VAOS外科治疗主要研究及相关并发症[4]
VAOS外科治疗主要研究及相关并发症[4]
| 研究者 | 年份 | 研究病例数 | 手术技术 | 围手术期病死率及卒中发生率(%) | 非卒中并发症发生率(%) | 平均随访时间(月) | 随访期椎基底动脉系统卒中或TIA发生率(%) | 随访期再狭窄率(%) |
|---|---|---|---|---|---|---|---|---|
| Diaz等 | 1984 | 55 | VCT,VST,VAE,VABG,MIS | 0 | 67.3 | 无 | 无 | 无 |
| Reul等 | 1984 | 40 | VABG, VST, MIS | 2.5 | 无 | 93 | 无 | 无 |
| Theveret等 | 1984 | 283 | VST,VAE,VABG,MIS | 1.8 | 41.1 | 60 | 无 | 19 |
| Imparao等 | 1985 | 109 | VST, VCT, VABG,MIS | 3 | 无 | 119 | 1.9 | 无 |
| Branchereau等 | 1990 | 179 | VCT,VST,VAE | 6.1 | 5 | 353 | 无 | 3.1 |
| Ogawa等 | 1991 | 32 | VST | 0 | 无 | 37 | 9.4 | 无 |
| Habozit等 | 1991 | 106 | VCT,VST,VAE | 6.6 | 16 | 48 | 7 | 无 |
| Van Schil等 | 1992 | 28 | VAE,VABG,MIS | 0 | 31 | 86 | 11.1 | 33.3 |
| Kakino等 | 2009 | 36 | VST | 0 | 100a | 54 | 0 | 0 |
注:VST:椎动脉–锁骨下动脉转植;VCT:椎动脉V1–颈动脉转植;VAE:椎动脉内膜剥离;VABG:椎动脉搭桥;MIS:多种技术;a短暂Horner征;VAOS:椎动脉起始部狭窄
外科治疗的症状性动脉粥样硬化性VAOS围手术期并发症发生率及病死率仍高,且有较高的颅神经损伤发生率及非神经系统的并发症发生率,因此VAOS的外科治疗不作为临床首选。所以在2014年AHA/ASA卒中及TIA治疗指南中关于VAOS的管理中,手术治疗的证据级别及推荐级别都很低(推荐级别Ⅱb;证据级别C)[21]。
症状性动脉粥样硬化性VAOS外科治疗推荐意见:
目前暂不推荐各种开放外科治疗方法治疗症状性动脉粥样硬化性VAOS。
症状性动脉粥样硬化性VAOS血管内治疗源于20世纪80年代。1981年,Motarjeme等[22]报道了第一例VAOS的球囊血管成形治疗,取得了满意的疗效。
1993年Higashida等[23]报道41例单纯血管成形治疗VAOS的病例,34例患者进行单纯球囊成形治疗,有2例患者有球囊成形后血管痉挛,有1例患者发生了一次<30 min症状加重。在6个月的随访期,9%的患者出现>50%的再狭窄。2003年Cloud等[24]报道单纯球囊扩张治疗VAOS,1年随访,100%的患者出现了>70%的再狭窄。
其后的研究也提示,单纯球囊扩张治疗VAOS有太高的再狭窄发生率,因此,神经介入学者提出应用支架治疗VAOS。
1996年,Storey等[25]首次报道了VAOS的支架治疗。技术成功率100%、无围手术期并发症。此后VAOS的支架治疗逐渐发展起来。
其后研究提示VAOS的支架置入的技术成功率高达92.8~100%,围手术期的病死率仅仅有0.3%,即刻的神经系统并发症发生率仅有0~5%[26]。
2011年Broussalis等[27]报道了22例VAOS支架置入治疗,结果发现55%的患者发生再狭窄。然而仅有2例患者为症状性再狭窄,没有神经功能的恶化或MRI证实的新发病灶。
2011年,一项关于VAOS支架治疗的综述纳入病例数10例以上的研究23个,共808例患者,其中83%为症状性VAOS患者。该综述总结,VAOS支架植入的技术成功率为98.8%,技术相关并发症为2.4%,手术后30 d的卒中/TIA发生率及病死率为2.8%,再狭窄率为20.8%[4]。
2011年Stayman等[28]VAOS的血管内治疗系统回顾显示,27个研究中心的980例患者接受了VAOS(症状性的占92%)的支架置入治疗,技术成功率为99.3%,支架置入30 d内卒中/TIA的发生率为1.9%。再平均随访的24个月内,药物包被支架的再狭窄发生率明显低于裸支架的再狭窄率(11%比30%)。
2013年Edgell等[29]报道一个多中心的椎动脉起始部支架植入的研究,共纳入148例患者,56.8%使用药物包被支架,无手术即刻的卒中或死亡,手术成功率为100%,0.8%的患者在手术30 d卒中、TIA的发生率分别为0.8%及5.2%,术后平均8.5个月随访,再狭窄(≥50%)的发生率为15.5%,药物包被支架与裸支架的再狭窄率没有明显差异。
VAOS支架置入围手术期的并发症发生率在0~5%之间[30,31],围手术期卒中/TIA的发生率低于2%[28]。高达20%~50%支架后的再狭窄率成为了VAOS支架治疗的挑战[30,31]。
药物包被支架在冠脉狭窄能明显降低再狭窄率[32]。所以人们想到用药物包被支架治疗VAOS。2010年,Ogilvy等[33]的研究发现,药物包被的支架植入治疗VAOS,再狭窄率明显低于非药物包被的支架。
Chen等[34]2011年报道的47例VAOS药物包被支架治疗的随访研究,结果发现支架植入成功率100%,患者随访平均28.3个月,有4.2%的患者在支架后5、17个月发生支架植入血管供血区的卒中。有80.9%患者在平均时间为16.3个月(6~48个月)进行DSA随访,支架内再狭窄率为5.3%。研究提示药物包被支架是治疗椎动脉起始部狭窄安全、有效的方法。
Song等[35]2012年报道一组206例患者药物包被支架与裸支架指教VAOS的对照研究,结果如表3。
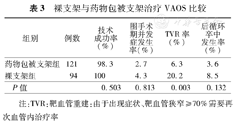
裸支架与药物包被支架治疗VAOS比较
裸支架与药物包被支架治疗VAOS比较
| 组别 | 例数 | 技术成功率(%) | 围手术期并发症发生率(%) | TVR率(%) | 后循环卒中发生率(%) |
|---|---|---|---|---|---|
| 药物包被支架组 | 121 | 98.3 | 2.7 | 6.3 | 3.6 |
| 裸支架组 | 94 | 100 | 4.3 | 20.2 | 8.5 |
| P值 | 0.503 | 0.813 | 0.003 | 0.132 |
注:TVR:靶血管重建:由于出现症状、靶血管狭窄≥70%需要再次血管内治疗率
但也有作者的研究提示药物包被支架与裸支架治疗VAOS再狭窄率无差异[36]。2006年Eberhardt等[18]回顾的313例药物包被支架治疗VAOS,结果发现在平均随访的11.8个月中,25.7%的患者出现再狭窄。Taylor等[30]2008年的研究发现,44例接受药物包被支架治疗的患者,在随访的7.7个月中,再狭窄发生率高达48%。
目前,有关药物包被支架治疗VAOS的研究,其再狭窄率的差异也很大。药物支架防治再狭窄的结论仍然有矛盾的报道[33,37]。2014年一项荟萃分析的比较研究提示,应用药物包被支架治疗椎动脉起始部狭窄能有效降低再狭窄及症状的复发。但是需要进一步的比较研究[38]。
目前缺乏椎动脉起始部支架置入再狭窄相关因素的系统研究。一项研究提示支架后再狭窄最为相关的因素为病变的长度,≤5 mm、5~10 mm及>10 mm病变长度支架置入后再狭窄的发生率分别为21%、29%及50%[39]。其他的相关因素还与支架类型(是否为药物包被支架)、手术的操作有关(尤其是留于锁骨下动脉的支架的长度、支架长度及支架释放的压力等)、支架后药物治疗及V1段是否迂曲有关[40]。
关于是否使用远端栓塞保护装置的研究报道较少,2004年Wehman等[41]首先在VAOS血管内治疗使用远端栓塞保护装置,技术成功率100%,无手术相关并发症发生。2006年Qureshi等[42]报道了12例VAOS血管内治疗使用远端保护装置的的结果,11例患者成功放置远端保护装置,手术后随访1个月无卒中及死亡。Wehman建议VAOS血管内治疗使用远端栓塞保护装置的适应证:远端椎动脉≥3.0 mm,病变为溃疡斑块且没有明显的成角。
VAOS支架置入治疗逐渐成为VAOS治疗的安全、有效的选择。尽管目前的VAOS支架治疗研究看到了VAOS治疗的一线曙光,但是仍缺乏高证据级别的研究,所以在2014年AHA/ASA卒中及TIA治疗指南中关于VAOS的管理中,血管内治疗的证据级别及推荐级别都很低(推荐级别Ⅱb;证据级别C),而且血管内治疗只在最佳的药物治疗后仍然有症状发作时才考虑[21]。
症状性动脉动脉粥样硬化性VAOS血管内治疗推荐意见:
1.在有经验中心开展症状性动脉粥样硬化性VAOS血管内治疗是安全、有效的。
2.症状性动脉粥样硬化性VAOS血管内治疗主要适应证有[4,43]:(1)一侧VAOS≥50%,伴有:①对侧椎动脉狭窄闭塞或发育不良,或者对侧椎动脉没有参与到基底动脉;②有前循环的血管病变(狭窄或闭塞),后循环通过Willis环对前循环有重要的代偿作用。(2)双侧VAOS≥ 50%,伴有后循环缺血性卒中/TIA;或者前循环的血管病变(狭窄或闭塞),后循环通过Willis环对前循环有重要代偿作用。
3.症状性动脉粥样硬化性VAOS血管内治疗围手术期药物使用同颈动脉狭窄血管内治疗。
4.药物包被支架可能比裸支架能更好地预防支架后再狭窄的发生。
5.在行VAOS血管内治疗时,如远端椎动脉≥3.0 mm,病变为溃疡斑块有高栓塞风险且远端椎动脉无明显的成角时,可以使用远端保护装置辅助血管内治疗。
药物治疗(如强化他汀药物使用、双联抗血小板聚集治疗)的发展,可能对VAOS治疗有很大的获益,但是目前缺乏药物治疗与支架治疗VAOS的对照研究。关于症状性动脉粥样硬化性VAOS血管内治疗与药物治疗安全性与疗效的随机对照研究,有一项正在进行[44]。同时研发使用与VAO的专用支架也势在必行。症状性动脉粥样硬化性VAOS的研究(自然史、药物治疗与血管内治疗等)也应该提到历史日程。
参与共识讨论专家(按姓氏首字拼音顺序):毕齐(首都医科大学附属北京安贞医院);曹亦宾(唐山工人医院);陈康宁(第三军医大学附属西南医院);董强(复旦大学附属华山医院);范一木(天津环湖医院);高连波(大连医学院附属第四医院);管生(郑州大学一附院);韩巨(济南千佛山医院);胡波(华中科技大学同济医学院附属同济医院);黄家星(香港中文大学威尔斯亲王医院);李宝民(解放军总医院);刘丽萍(首都医科大学附属北京天坛医院);刘新峰(南京军区总医院);刘亚杰(南方医科大学附属珠江医院);吉训明(首都医科大学附属北京宣武医院);马宁(首都医科大学附属北京天坛医院);缪中荣(首都医科大学附属北京天坛医院);莫大鹏(首都医科大学附属北京天坛医院);牛国忠(杭州市第一人民医院);秦超(广西医科大学第一附属医院);石向群(解放军兰州军区总医院);史树贵(第三军医大学附属西南医院);帅杰(第三军医大学附属新桥医院);王伊龙(首都医科大学附属北京天坛医院);王拥军(首都医科大学附属北京天坛医院);吴伟(山东大学附属齐鲁医院);徐安定(暨南大学附属第一医院);许予明(郑州大学附属第一医院);张苏明(武汉同济大学附属医院);张勇(青岛医学院附属医院);赵钢(第四军医大学附属西京医院);赵振伟(第四军医大学附属唐都医院);郑洪波(四川大学华西临床医学院华西医院);朱其义(山东临沂人民医院);周盛年(山东大学附属齐鲁医院);David Wang(美国伊利诺伊州立大学Peoria医学中心)
执笔人:陈康宁(第三军医大学附属西南医院神经内科)

























