
越来越多的研究证据表明,机械循环辅助(MCS)可以对循环系统提供有效辅助,纠正血流动力学紊乱状态,改善器官组织灌注,提高患者的生存率,其临床应用逐渐增多。Impella作为经皮MCS装置的一种,目前已经被美国食品及药品管理局(FDA)批准用于心原性休克(CS)或者选择性和紧急高危经皮冠状动脉介入治疗(PCI)或保护性PCI患者。因此,本文将从Impella的作用原理、Impella在CS患者中应用、Impella在高危PCI患者中应用及Impella指南推荐意见和批准适应证说明等几个方面介绍Impella临床应用的研究进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
机械循环辅助(mechanical circulatory support, MCS)已成为心原性休克(cardiogenic shock, CS)及晚期心力衰竭(心衰)等心血管危重症治疗方面进展最迅速的领域[1,2,3,4]。MCS具有改善危重病人血流动力学的重要作用,在部分替代心脏泵功能的同时,可使心脏处于休息状态,作用迅速肯定,是危重心血管疾病治疗的重要选择。目前,常用的MCS有主动脉内球囊反搏(intra-aortic balloon pump, IABP)、体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)、左心室辅助设备(left ventricular assist device, LVAD)TandemHeart、磁悬浮人工心脏和心脏轴流泵Impella。本文将重点介绍Impella的临床应用进展。
Impella属于LVAD,根据管道直径的不同分为3种型号:12F(Impella 2.5)、14F(Impella CP)和21F(Impella 5.0),最大输出流量分别为2.5L/min、3.0~4.0L/min和5.0L/min。装置工作原理为通过导管前端的内置微型轴流泵将左心室的氧合血液经导管流入口抽出,再将轴流泵直接泵入升主动脉,建立左心室-升主动脉引流途径。能够辅助增加心输出量,升高主动脉压和冠状动脉灌注压,改善平均动脉压、冠状动脉血流量;同时减少左心室前负荷和肺动脉楔压,降低室壁张力,减少心肌耗氧量。起到一个主动的机械泵作用,部分替代左心室功能。Impella可用于心律失常患者,但不能耐受心脏骤停(cardiac arrest, CA)或心室颤动患者,Impella 2.5提高心输出量(cardiac output, CO)的作用强于IABP,Impella CP和Impella 5.0的作用与TandemHeart相当。
2014年,O′Neil等[5]入选了来自美国38家医院,参加USpella注册研究的154例合并CS的急性心肌梗死(acute myocardial infarction, AMI)患者(AMICS),比较PCI术前置入Impella(Impella 2.5)和PCI术后置入Impella患者的临床特征及预后差异,主要终点为存活至出院率。结果发现,PCI术前置入Impella患者合并糖尿病、周围血管疾病、慢性阻塞性肺疾病及既往卒中的比例更高,治疗的病变及血管更多(P均<0.01)。但是,与PCI术后置入Impella患者比较,PCI术前置入Impella患者存活至出院率更高(40.7%比65.1%,P=0.003)(表1)。即使校正潜在混杂因素后,PCI术前置入Impella仍是AMICS患者院内存活的独立预测因素[比值比(odds ratio,OR)0.37,95%可信区间(confidence interval,CI)0.17~0.79,P=0.01]。

PCI术前后置入Impella对存活至出院率的影响
PCI术前后置入Impella对存活至出院率的影响
| 分组 | Impell支持状态 | 总例数 | 出院例数 | 存活至出院率(%) | |
|---|---|---|---|---|---|
| PCI术前置入Impella | 持续Impella支持 | 63 | 41 | 65.1 | |
| PCI术后置入Impella | |||||
| PCI术前IABP支持 | 术后Impella支持 | 53 | 21 | 39.6 | |
| PCI术前无器械支持 | 术后Impella支持 | 38 | 15 | 39.5 | |
注:PCI为经皮冠状动脉介入治疗
2016年,Schroeter等[6]入选了单中心连续68例置入Impella(主要是Impella 2.5)合并CS的急性冠脉综合征(acute coronary syndromes, ACS)患者,比较早期置入Impella(在首次行冠脉造影时置入)和延迟置入Impella(主要是在置入IABP后)对患者短期和长期结局的影响,结果发现,延迟置入Impella是患者长期不良预后的独立预测因素[风险比(hazard ratio,HR)2.157,P=0.04]。
2017年,Basir等[7]入选了2009年1月至2014年6月参加经导管心室辅助装置(catheter Ventricular Assist Device, cVAD)注册研究,行PCI并在PCI术前、术中或术后24h内置入Impella的AMICS患者,旨在评价早期应用Impella(2013年6月前为Impella 2.5,2013年6月之后为Impella CP)对AMICS患者预后的影响。研究共纳入287例患者,平均年龄66岁,男性占76%,左心室射血分数(left ventricular ejection fraction, LVEF)为(25±12)%。在Impella置入前,80%患者在使用正性肌力药物,40%患者使用IABP,9%患者置入Impella时正进行积极的心肺复苏。全体患者至出院存活率为44%。多变量分析结果显示,PCI术前早期置入Impella(OR 0.485,95%CI 0.240~0.981,P=0.044)与生存率增加显著相关。CS发生后<1.25h,1.25~4.25h及>4.25h置入Impella患者的生存率分别为66%、37%和26%(P=0.017)。总之,休克发生后早期置入Impella与AMICS患者的生存率提高独立相关。
2017年,Flaherty等[8]总结了三个AMICS患者应用Impella的研究结果显示,与晚期(再血管化后)置入Impella比较,早期(再血管化前,冠状动脉造影时)置入Impella可以使AMICS患者的住院或30d病死率显著降低48%[危险比(risk ratio,RR)0.52,95%CI 0.31~0.88,I2=0%,P=0.01]。
2009年1月至2016年12月期间,来自美国1 010家医院的46 949例患者纳入了一项关于Impella应用的质量改进(quality improvement, IQ)注册研究,其中15 259例为AMICS患者,这些患者中51%存活至Impella撤机,其中,PCI术前置入Impella作为一线治疗患者的存活率(59%)显著高于Impella作为补救治疗患者的存活率(52%)。而且,接受肺动脉导管(pulmonary artery catheter, PAC)血流动力学监测患者存活率(63%)也显著高于未行PAC血流动力学监测患者的存活率(49%)[9]。
国家心原性休克倡议(The National Cardiogenic Shock Initiative)项目是一项单臂、前瞻性、多中心研究,针对行PCI的AMICS患者,评价早期经皮MCS对结局的影响,要求参与单位按照标准方案治疗AMICS患者,强调有创血流动力学监测和快速启动MCS。2016年7月至2019年2月,美国35个中心参加,共纳入171例患者,平均年龄63岁,男性占77%,83%患者使用血管收缩剂或正性肌力药,20%患者发生院外有目击的CA,29%患者发生院内CA,10%患者在置入MCS时正在进行积极的心肺复苏。按照标准方案,74%患者在PCI术前置入MCS,92%患者行PAC检查,入门至开始支持时间为(85±63)min,入门至球囊开通时间为(87±58)min。全体患者至出院存活率为71%[10],高于Basir等人[7] 2017年的报道,说明在当前临床实践中,按照标准休克方案治疗可以改善AMICS患者的预后。
总之,这些研究结果一致表明,早期置入Impella和有创血流动力学监测有助于改善AMICS患者的临床预后。
ISAR-SHOCK研究[11]入选了26例AMICS患者,比较IABP与Impella 2.5的疗效差异,除1例患者在置入MCS前死亡外,其他25例均成功置入MCS,13例置入IABP,12例置入Impella,研究的主要终点为MCS置入30 min后心脏指数(cardiac index, CI)的变化。结果发现,置入Impella比IABP后CI增加更显著,二者CI变化值分别为(0.49±0.46)L·min-1·m-2和(0.11±0.31)L·min-1·m-2(P=0.02)。但两组患者30d病死率均为46%。
IMPRESS研究[12]入选了48例严重AMICS患者,24例置入IABP,24例置入Impella CP,比较IABP和Impella CP对MCS置入后30d全因病死率的影响,结果发现,置入IABP和Impella CP患者的30d全因病死率分别为50%和46%,差异无统计学意义(P>0.05)。
CS合并右心室衰竭增加患者病死率,常发生在AMI、双心室置换、心肌切除术及心脏移植术后[13]。肺动脉搏动指数(pulmonary artery pulsatility index, PAPi)=(肺动脉收缩压-肺动脉舒张压)/中心静脉压,可以帮助评价右心衰竭程度及预测是否需要右心MCS[14]。AMI时PAPi<1,或者LVAD后PAPi<1.85,提示右心衰竭。Impella RP时目前唯一被证明有效的右心MCS器械。Impella RP心脏泵稳定血流动力学、减轻右心室负荷、促进右心衰竭的恢复,可提供高达4 L/min的血液量。
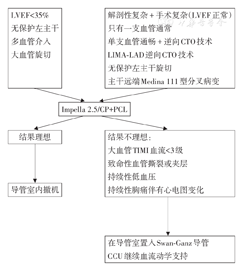

LVEF为左心室射血分数,CTO为慢性完全闭塞病变,LIMA-LAD为左乳内动脉-前降支,PCI为经皮冠状动脉介入治疗,TIMI为心肌梗死溶栓治疗,CCU为冠心病监护室
PROTECT-Ⅰ研究[15]是一项前瞻性、非对照、多中心、可行性研究,在美国食品及药品管理局(Food and Drug Administration, FDA)指导下设计,主要评估高危PCI患者应用Impella的安全性和可行性。入组特点:LVEF≤35%,计划PCI,包括无保护左主干PCI或只有一支血管通畅。结果显示,Impella应用于高危PCI患者安全、有效。
PROTECT-Ⅱ研究[16]是一项前瞻性、多中心、随机试验,比较需要血流动力学支持的择期或紧急PCI患者(无保护左主干,只有一支血管通畅,LVEF≤35%,三支血管严重病变伴有LVEF≤30%,不适于外科手术)应用Impella 2.5和IABP两者的临床预后。基于原来的安全性和有效性,假设是Impella 2.5优于IABP。共有112家医院参与本研究,入选了452例患者。90d随访时10个主要不良心血管事件(major adverse cardiovascular events, MACE)包括:死亡、一过性脑缺血发作或卒中、心肌梗死、再血管化、心脏和血管手术、急性肾功能衰竭、心肺复苏或心脏除颤、主动脉返流程度增加、严重低血压、血管造影失败。结果显示,90d随访时MACE发生率在Impella 2.5组明显少于IABP组(40.0%比51.0%,P<0.023)。进行旋磨的患者事件发生率较高,但Impella组的MACE发生率也明显低于IABP组(35.5%比50.5%,P=0.003)。
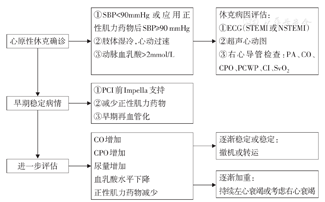

SBP为收缩压,ECG为心电图,STEMI为ST段抬高型心肌梗死,NSTEMI为非ST段抬高型心肌梗死,PA为肺动脉压,CO为心输出量,COP为心脏功率输出,PCWP为肺毛细血管楔压,CI为心脏指数,SvO2为静脉血氧饱和度,PCI为经皮冠状动脉介入治疗
cVAD注册研究[17]是一项国际注册、回顾性、多中心研究,包括了所有Impella系统设备(Impella 2.5、Impella CP、Impella 5.0、Impella LD和Impella RP),是Impella真实临床应用的情况,共纳入2 704例患者,主要来自美国、加拿大和欧洲,其中,CS患者1 090例,占40%;择期或紧急高危PCI患者1 275例,占47%,其他情况339例,占13%。平均年龄65岁,75%为男性;患者大多伴有多种危险因素(糖尿病42%,高血压71%,肾功能衰竭24%),胸外科学会(Society of Thoracic Surgery, STS)危险评分预测死亡率约21%,预测并发症发生率为60%;尽管儿茶酚胺±IABP治疗,患者依然处于休克状态,器官和组织灌注差。
Impella置入平均时间为26h,平均泵速Impella 2.5为2.2L/min,Impella CP为2.9L/min,Impella 5.0/LD为4.3L/min。平均重症监护室(intensive care unit, ICU)时间Impella 2.5为6天,Impella CP为5天,Impella 5.0/Impella LD为19天;平均住院时间Impella 2.5为7天,Impella CP为5.5天,Impella 5.0/Impella LD为23天。
置入Impella可以显著提高平均动脉压(mean artery pressure, MAP)、CO及心脏功率输出(cardiac power output, CPO),降低肺毛细血管楔压(pulmonary capillary wedge pressure, PCWP),差异均有统计学意义(P均<0.01)(表2)。
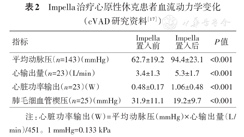
Impella治疗心原性休克患者血流动力学变化(cVAD研究资料[17])
Impella治疗心原性休克患者血流动力学变化(cVAD研究资料[17])
| 指标 | Impella置入前 | Impella置入后 | P值 |
|---|---|---|---|
| 平均动脉压(n=143)(mmHg) | 62.7±19.2 | 94.4±23.1 | <0.001 |
| 心输出量(n=23)(L/min) | 3.4±1.3 | 5.3±1.7 | <0.001 |
| 心脏功率输出(n=23)(W) | 0.48±0.17 | 1.06±0.48 | <0.001 |
| 肺毛细血管楔压(n=25)(mmHg) | 31.9±11.1 | 19.2±9.7 | <0.001 |
注:心脏功率输出(W)=平均动脉压(mmHg)×心输出量(L/min)/451。1 mmHg=0.133 kPa
此外,研究结果显示,计划植入Impella患者的30d生存率约70%,显著高于非计划紧急植入Impella患者的30d生存率(38%)(表3)。
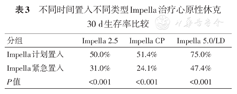
不同时间置入不同类型Impella治疗心原性休克30 d生存率比较
不同时间置入不同类型Impella治疗心原性休克30 d生存率比较
| 分组 | Impella 2.5 | Impella CP | Impella 5.0/LD |
|---|---|---|---|
| Impella计划置入 | 50.0% | 51.4% | 75.0% |
| Impella紧急置入 | 31.0% | 24.1% | 47.4% |
| P值 | <0.001 | <0.001 | <0.001 |
目前为止,已经有多个指南对于CS患者或高危PCI患者中应用Impella给出不同级别的推荐意见[18,19,20,21],主要为Ⅱb类推荐,C级证据(表4)。

Impella在指南/共识中的推荐情况汇总
Impella在指南/共识中的推荐情况汇总
| 指南/共识名称 | 发布时间 | 适应症 | 推荐级别及证据水平 | FDA批准时间 |
|---|---|---|---|---|
| 2018年ESC/EACTS心肌血运重建指南[18] | 2019年 | ACS合并CS患者 | Ⅱb类C级 | 2016年 |
| 2016年ESC急性和慢性心力衰竭诊断和治疗指南[19] | 2016年 | 难治性CS患者 | Ⅱb类C级 | 2016年 |
| 终末期心衰等待心脏移植或不适合心脏移植患者 | Ⅱa类C级 | |||
| 2015年SCAI/ACC/HFSA/STS关于在心血管疾病管理中使用经皮机械循环支持的临床专家共识文件[20] | 2015年 | 高危PCI患者 | Ⅱb类C级 | 2008年 |
| 2011年ACCF/AHA/SCAI经皮冠状动脉介入治疗指南[21] | 2011年 | 高危PCI患者 | Ⅱb类C级 | 2008年 |
注:FDA为美国食品和药品管理局,ESC为欧洲心脏病学会,EACTS为欧洲心胸外科协会,ACS为急性冠脉综合征,CS为心原性休克,SCAI为心血管造影和介入学会,ACC为美国心脏病学会,HFSA为美国心力衰竭协会,STS为胸外科学会,PCI为经皮冠状动脉介入治疗,ACCF为美国心脏病学院基金会,AHA为美国心脏协会
目前,Impella已经被多个国家认可(欧洲2004年,美国2006年,加拿大2007年,中国2013年,印度和日本2017年),主要用于CS和高危PCI患者。
美国FDA已经批准Impella系统可用于AMI、心肌炎、心肌病、心包炎和外科术后引起的CS患者。2016年,美国FDA批准通过Impella(2.5、CP、5.0/LD)器械可用于治疗正在发展的CS、AMI后立即(48h内)或心脏术后CS。不管是否已经有IABP支持,只要药物治疗效果不好,早期短期使用是安全有效的(Impella 2.5和Impella CP支持时间≤4 d,Impella 5.0/LD支持时间≤6 d)。2016年,美国FDA和上市前批准管理(pre-market approval, PMA)同意右侧心脏Impella RP可用于LVAD、AMI、心脏移植及心脏外科术后失代偿的右心衰竭患者(体表面积≥1.5m2),可提供流量为4L/min的血液。
到目前为止世界范围内,大概有1 200家医院的3 000名医生,约65 000患者应用了Impella心脏轴流泵循环辅助系统。多个前瞻性、注册性、单中心和多中心研究和300多篇已经发表的论文显示,Impella心脏轴流泵是非常有效的循环辅助系统。
随着我国经济水平的发展和饮食结构的改变,冠状动脉粥样硬化性心脏病(冠心病)已经成为我国居民的主要疾病谱之一。AMI合并CS、AMI合并机械并发症,以及慢性心衰患者急性失代偿等心血管急危重症病例呈增加趋势。MCS让既往危重患者及疑难复杂手术变得可行,让部分心脏重症患者获得了新生。展望未来,IABP、ECMO、Impella、LVAD等MCS装置在心脏急危重症患者中的应用将会越来越多,多种MCS装置的联合使用,也必将使心脏重症治疗的成功率进一步提高。
所有作者均声明不存在利益冲突































