
报道1例临床表现复杂多样的药物性肝损伤,在临床诊断与治疗疾病中具有参考意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
药物性肝损伤(drug-induced liver injury,DILI)发病机制尚不明确,目前普遍认为除了药物或代谢产物对肝脏直接毒性外,免疫应答激活所造成攻击性损伤是发病的重要事件,若同时伴有病毒及细菌感染,则更易诱发DILI[1]。故该类疾病临床表现复杂多样,且无特异性,其早期诊断存在一定的困难。现报道1例表现为重叠综合征且伴EB病毒感染的药物性肝损伤,以期供临床参考。
患者男性,34岁,主因"乏力、腹胀10 d,皮肤、巩膜黄染3 d"于2018年11月12日入院。10 d前无诱因出现乏力、腹胀、食欲不振。自行服用"奥美拉唑肠溶胶囊""金双岐""伊托必利"等,上述症状无改善,并伴恶心、厌油腻,时有干呕。3 d前出现皮肤、巩膜黄染,尿色加深,当地医院行肝脏生物化学指标检测结果显示:总胆红素138.5 μmol/L,直接胆红素68.58 μmol/L,间接胆红素69.92 μmol/L,丙氨酸转氨酶1279 U/L,天冬氨酸转氨酶856 U/L,碱性磷酸酶608 U/L,γ-谷氨酰转移酶362 U/L,胆汁酸319.5 μmol/L,白蛋白39.1 g/L,球蛋白43.2,白球比0.9,血常规检测结果显示单核细胞百分比10.8%,为求进一步诊治来我院。门诊以"黄疸原因待查"收住消化内科。既往否认病毒性肝炎病史,体检曾有"血清丙氨酸转氨酶最高58 U/L";否认饮酒史,否认家族遗传代谢性疾病史,否认可疑毒物接触史。间断发作"荨麻疹"病史3年余,2个月前曾因"肺部感染"输注"头孢哌酮/舒巴坦钠注射液和左氧氟沙星注射液"3周后,症状消失。体格检查:生命体征平稳,皮肤、巩膜重度黄染,全身浅表淋巴结不大,双肺呼吸音粗,未闻及干湿啰音。腹平坦,全腹无压痛、反跳痛及肌紧张,肝脾肋下未及,Murphy征阴性,移动性浊音阴性。双下肢无水肿。入院诊疗:上腹部X线计算机断层摄影术、磁共振胰胆管成像结果无明显异常。胸部X线计算机断层摄影术结果主要提示双肺支气管炎并周围渗出性改变,纵隔多个稍大淋巴结。初步诊断为"肝损伤;肺部感染"。对症治疗同时,完善相关检测:病毒性肝炎系列阴性;血清铜、铜蓝蛋白、血清铁、铁蛋白、转铁蛋白均正常;自身抗体系列均阴性;自身免疫性肝病检测结果显示抗线粒体抗体-M2阳性;免疫功能组合检测结果显示免疫球蛋白G 29.8 g/L;EBV-CA免疫球蛋白G阳性。复查肝脏生物化学指标结果显示总胆红素160.72 μmol/L,直接胆红素103.14 μmol/L,间接胆红素57.58 μmol/L,丙氨酸转氨酶546 U/L,天冬氨酸转氨酶275 U/L,碱性磷酸酶651 U/L,γ-谷氨酰转移酶387 U/L,胆汁酸378.3 μmol/L,白蛋白35.2 g/L,球蛋白43.2,白球比0.8。血常规检测结果显示单核细胞百分比11.7%。依据相关指南,予以诊断"自身免疫性肝病(原发性胆汁性胆管炎与自身免疫性肝炎重叠综合征);肺部感染"。采用熊去氧胆酸治疗1周后,复查肝生物化学指标结果显示总胆红素109.34 μmol/L,直接胆红素62.55 μmol/L,间接胆红素46.79 μmol/L,丙氨酸转氨酶115 U/L,天冬氨酸转氨酶97 U/L,碱性磷酸酶541 U/L,γ-谷氨酰转移酶192 U/L,胆汁酸277.6 μmol/L,白蛋白40.1 g/L,球蛋白46.7,白球比0.9。入院第10 d,患者出现发热,无发冷,无咳嗽、咯痰,无腹痛、腹泻,无心慌、气短,无头痛、头晕,体温39.8℃,查体发现双侧锁骨上淋巴结肿大,大小不一,触之表面光滑,压痛阳性,可滑动,与周围无黏连。复查血常规结果显示白细胞6.48×109/L,中性粒细胞百分比52.9%,单核细胞百分比14.5%,C反应蛋白15.09 mg/L,血沉64 mm/h。EBV DNA:1.15×103拷贝/ml。EBV-CA免疫球蛋白M阴性;EBV-EA(1∶10)阳性;EB病毒核抗原(1∶10)阳性;行胸腹腔淋巴结扫描未见其余肿大淋巴结,脾脏大小同前,血培养示阴性。予以抗病毒(更昔洛韦,0.25 g,1次/d,静脉滴注)、静脉用丙种球蛋白(12.5 g/d)治疗3 d后,患者体温渐降至正常,精神好转,查体示锁骨上淋巴结消失,肝脾未触及。继续抗病毒治疗至1周后行超声引导下肝穿刺活组织检查术,送检3条穿刺组织,病理结果提示炎症G0~1/S1(图1)。免疫组织化学无特殊(图2)。原位杂交结果显示:EB病毒编码小RNA阴性。病理结果诊断提示考虑药物/毒物引起的肝损伤。故修正诊断"药物性肝损伤(混合型);EB病毒感染再激活"。加用扶正化瘀胶囊以缓解慢性炎症纤维化形成,继续治疗2周后肝生物化学指标进一步好转出院。出院后继续服用熊去氧胆酸、还原型谷胱甘肽及抗纤维化药物,1个月后复查肝生物化学指标结果显示总胆红素、直接胆红素、间接胆红素、碱性磷酸酶、γ-谷氨酰转移酶、白蛋白均正常,球蛋白48.2,白球比0.8,EBV DNA < 500拷贝/ml,自身免疫性肝病系列均阴性(抗线粒体抗体-M2阴性),免疫功能检测结果显示免疫球蛋白G 30 g/L,嘱患者每3~6个月来我院消化内科门诊复查随诊。
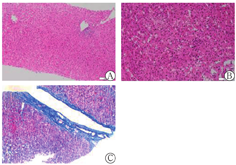

注:A:HE×100;B:HE×200;C:Masson×200
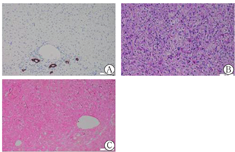

注:A:CK7×200;B:PAS×200;C:铜染色×200
DILI为临床常见疾病之一,其中特异质型是临床诊治或研究的热点。其诱发的肝脏免疫性炎症损伤既可表现为快速过敏反应,也可缓慢出现多种自身抗体,表现为各类型自身免疫性肝病[2,3]。目前,DILI主要依靠排他法进行初步诊断[1,2,4]。本例患者在入院之初,不仅肝生物化学指标结果显示胆红素进行性升高,碱性磷酸酶及γ-谷氨酰转移酶明显升高[碱性磷酸酶> 4×正常值上限(ULN),γ-谷氨酰转移酶> 5×ULN],且自身免疫性肝病指标检测结果显示抗线粒体抗体-M2阳性,血清免疫球蛋白G > 1.8×ULN,结合既往曾有"血清氨基转移酶轻微异常"及"荨麻疹"病史,且在入院后排除常见病毒性肝炎、脂肪性肝病、非嗜肝病毒性肝炎、遗传代谢性肝病等,故初步诊断为"自身免疫性肝病(原发性胆汁性胆管炎-自身免疫性肝炎重叠综合征)"。其诊断采用巴黎标准[5],即自身免疫性肝病和原发性胆汁性胆管炎各自3项诊断标准中有2项同时或相继出现,便可作出诊断。但本例系青年男性,既往仅有血清氨基转移酶轻度升高,无胆汁淤积征象,这与重叠综合征多见于中年女性,呈慢性反复发作病程的特征有所不符,且2个月内有反复肺部感染病史,故暂未应用糖皮质激素,予以单用熊去氧胆酸,辅以保肝、利胆、助消化等对症治疗后,患者肝生物化学指标明显改善。由此可见患者对熊去氧胆酸应答良好。
但在熊去氧胆酸巩固治疗期间,患者无明显诱因出现体温升高,锁骨上淋巴结肿大。血常规提示病毒性感染(单核细胞比例增高)。回顾患者入院时检测病毒系列EBV-免疫球蛋白G阳性,当时并无发热、咽痛、淋巴结肿大等症状,分析系因该病毒在人群中普通易感(95%),且多为终生无症状携带者,这一抗体在既往感染后可持续存在[6,7]。但不排除少数现症感染早期或活跃感染的可能[8],如EBV肝炎,该病是EBV感染引发全身多系统损伤(如反复发热、淋巴结病变、肝生物化学指标异常、肝脾肿大、间质性肺炎等)的重要表现之一[9],可出现类似于急性肝炎临床症状,部分可反复发作,进展为慢性活动性EBV感染,从而出现严重的肝损伤、胆汁淤积或肝功能衰竭,病情复杂,病死率较高[10]。其发病机制主要与EB病毒感染继发细胞免疫激活有关。其诊断要素包括:天冬氨酸转氨酶和丙氨酸转氨酶升高、经血清学或病毒学检验证实EBV活动性感染、组织病理学变化的特征、或原位杂交EB病毒编码小RNA可见阳性细胞。分析本例起病特征,EBV DNA呈低滴度(1.15×103拷贝/ml),提示虽然存在EBV活动性感染,但其与肝损伤的因果关系并不明确。EBV特异性抗体谱显示低亲和力抗体阴性,EBV-CA免疫球蛋白M阴性,提示现症急性感染证据不足;而在予以抗EBV治疗后,症状好转,肿大淋巴结消失,肝生物化学指标进一步改善,提示既往EBV感染复发可能性大。肝活组织检查病理结果未见肝内小胆管破坏性炎症或小胆管减少,也未提示明显肝细胞坏死引发的界面性肝炎、淋巴细胞穿入等自身免疫性肝病征象,CK7阳性,原位杂交未见阳性淋巴细胞,这些均不支持原发性胆汁性胆管炎和自身免疫性肝病的诊断,故病理诊断提示药物/毒物性肝损伤。为此,再次追问用药史,在入院前2个月内曾应用"注射用头孢哌酮/舒巴坦钠、左氧氟沙星注射液",共约21 d,停药近20余天后出现肝生物化学指标异常。且因入院后发现抗线粒体抗体-M2阳性及EBV DNA高于正常,RUCAM评分介于1~2分,故未考虑DILI之诊断。但综合分析,重叠综合征极少男性发病,而有报道EBV可诱发抗线粒体抗体阳性原发性胆汁性胆管炎,抗线粒体抗体-M2阳性亦可见于非原发性胆汁性胆管炎肝衰竭(通常为一过性),故本例抗线粒体抗体-M2阳性可能系EBV诱发的短暂性自身免疫紊乱。应用熊去氧胆酸后,短期内肝脏生物化学指标快速改善,也证实自身免疫病程相对较短,病变处于急性期。DILI在原有肝病基础上或某些感染状态下可能更易发生,或DILI本身可诱发自身免疫性肝病,或DILI、基础肝病或感染、DILI相关自身免疫这3种情况叠加,引发肝脏炎性损伤。但若自身免疫性肝病抗体阳性及相关病毒标志物阳性,往往不会优先考虑DILI之诊断。只有在肝穿病理排除肝内小胆管病变及肝细胞界面炎后,方可进一步倾向DILI诊断。本例出院后1个月复查抗线粒体抗体-M2转阴,符合最后诊断的逻辑分析。但患者既往血清氨基转移酶轻度升高及"荨麻疹"病史,肝活组织检查病理Masson染色结果显示汇管区纤维组织增生,均提示存在肝脏慢性炎症损伤,故仍需定期门诊随访,动态观察病情变化。
本例初发表现为原发性胆汁性胆管炎-自身免疫性肝炎重叠综合征伴EBV感染,最终诊断为药物性肝损伤(混合型),提示DILI诊断须灵活应用排他性。既使存在其他病因特异性诊断标志物(如抗线粒体抗体-M2阳性、EBV DNA阳性),若应用常规临床发病特征及流行病学分析无法解释,仍应考虑DILI可能。因此,多种肝损因素并存时,必须全面分析,发现其内在病理联系,确定主要病因,及早干预以改善预后。
所有作者均声明不存在利益冲突



























