
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着我国老龄人口的增多,以及对血栓性疾病管理规范化水平的不断提高,术前长期服用抗血栓药物患者在外科手术患者中所占比例也在不断增加。抗血栓药物主要包括抗凝药物、抗血小板药物和纤溶药物[1]。术前长期服用抗血栓药物(抗凝药物和抗血小板药物)的患者,围手术期如继续服用可增加手术出血风险,而停用则可致血栓栓塞事件的风险增加。鉴于出血和血栓栓塞对患者近远期预后均有重要不良影响,如何平衡两种风险至关重要,有时需多学科协作评估以制定个体化的患者管理方案。本共识结合目前国内外最新的证据和指南,并通过相关多学科专家的讨论,针对内科常见血栓栓塞疾病的血栓栓塞风险分级、外科手术出血风险分级、抗血栓药物的停药时机和桥接方案、择期与急诊外科手术围手术期抗血栓药物的管理以及区域阻滞麻醉与抗血栓药物管理等形成推荐意见,以期降低此类患者围手术期主要心脑血管事件和出血不良事件的发生率,保障患者围手术期安全。
抗血栓药物是指用于预防血栓形成和治疗已形成血栓的药物。根据作用不同可分成3类:(1)抗凝药物:抑制凝血过程;(2)抗血小板药物:抑制血小板聚集;(3)纤溶药物:通过诱导纤维蛋白降解使已经形成的血栓溶解[1]。
凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ需要经过γ-羧化后才具有生物活性,抗凝蛋白C和S同样需要经过羧化才具有活性,这两个过程均需要维生素K的参与。VKA通过抑制维生素K还原酶,间接阻断上述凝血因子及抗凝蛋白C、S在肝脏的合成,从而起到抗凝作用;而对体内已经活化的凝血因子无直接拮抗作用。因此只有当已合成的凝血因子在体内相对耗竭后,VKA才发挥抗凝作用。华法林是VKA中最常用的一种,其治疗剂量区间较为狭窄且具有明显的个体差异,患者的年龄、体重、饮食情况等均可影响患者对该药物的敏感性;同时华法林经肝脏细胞色素P450(CYP450)酶途径代谢,这也使其易发生药物与药物间的相互作用[2]。临床抗凝治疗中需进行抗凝强度监测,以国际标准比值(INR)为监控目标,控制INR在2.0~3.0之间。服用华法林后12~18 h起效,36~48 h达到抗凝高峰,单次给药持续时间为2~5 d,多次给药则可持续4~5 d。由于本品为间接作用的抗凝药,半衰期长,给药5~7 d后疗效才可稳定,故维持量是否足够务必观察5~7 d后才能判断[3,4]。
这类药物包括直接凝血酶抑制剂和直接Ⅹa因子抑制剂。其中达比加群酯、阿哌沙班、艾多沙班、利伐沙班是目前临床上常用的直接口服抗凝药,又称为非维生素K拮抗剂类口服抗凝剂(NOAC)。(1)直接凝血酶抑制剂(阿加曲班、比伐卢定、达比加群酯):主要通过直接、可逆地结合凝血酶的活性部位而抑制凝血酶,阻止纤维蛋白原被激活形成纤维蛋白,从而阻断凝血级联反应的最后步骤及血栓形成。阿加曲班、比伐卢定和达比加群酯是目前临床上可用的直接凝血酶抑制剂,比伐卢定直接抑制凝血酶的同时,还可将凝血酶和纤维蛋白分离[5]。这类药物可口服(达比加群酯)或静脉注射(比伐卢定、阿加曲班)。口服后吸收快,血药浓度较快升高达到峰浓度并发挥抗凝作用,同时半衰期短、停药后抗凝作用消退较快[5]。一般治疗人群不需要进行剂量调整,在肾功能不全、高龄及低体重等特殊人群中,半衰期可能延长。其治疗窗较宽且作用特异性较强,因此无需进行抗凝监测。以临床上常用的达比加群酯为例,服药后0.5~2.0 h达到峰浓度,多次给药后终末半衰期约为12~14 h,半衰期在肾功能不全时会出现延长[4,6]。(2)直接Ⅹa因子抑制剂(利伐沙班、阿哌沙班、艾多沙班):通过抑制Ⅹa因子、阻止凝血酶原转变为凝血酶而发挥抗凝作用,同时抑制内源性和外源性凝血途径,继而阻断纤维蛋白的形成,最终抑制血栓的形成及扩大[7]。利伐沙班目前广泛应用于预防深静脉血栓、肺栓塞以及房颤患者的卒中预防[8]。阿哌沙班2012年被美国食品和药品监督管理局(FDA)批准用于非瓣膜性房颤患者脑卒中和血栓事件的预防治疗[9]。艾多沙班2015年被批准用于房颤患者脑卒中及静脉血栓栓塞症(VTE)的预防和治疗。与直接凝血酶抑制剂类似,直接Ⅹa因子抑制剂口服吸收快、血药浓度较快升高达到峰浓度并发挥抗凝作用,同时半衰期短、停药后抗凝作用消退较快。在肾功能不全、高龄及低体重等特殊人群中半衰期可能延长。治疗过程中无需进行抗凝监测。利伐沙班服药后2~4 h达最高浓度,平均消除半衰期7~11 h,重度肾损害、伴有凝血异常和临床相关出血风险的肝病患者禁用[10]。
间接凝血酶抑制剂通过结合并激活抗凝血酶,间接抑制凝血因子主要是Ⅹa和Ⅱa因子活性,从而发挥抗凝作用。在结合并激活这些抗凝血酶复合物后,能以原型自由解离,并继续与其他抗凝血酶结合发挥抗凝作用。常见药物包括普通肝素(UFH)、低分子量肝素(LMWH)和磺达肝癸钠[5]。UFH由于还能和血浆蛋白、内皮细胞、巨噬细胞结合,因而个体差异大,需要频繁监测和滴定给药,半衰期2 h左右。LMWH可以可靠地基于体重给药,除了一些特殊患者(老年患者、孕妇、肾功能不全患者),无需频繁监测,半衰期6~8 h,因而目前主要用于长效抗凝药物的停药后桥接治疗[11]。常用LMWH包括依诺肝素、达肝素、亭扎肝素等。
环氧化酶抑制剂不可逆地抑制环氧合酶1(COX-1),在高剂量时也可抑制环氧合酶2(COX-2),后者是合成花生四烯酸类产物(包括前列腺素H2和血栓烷A2)的关键限速酶。阿司匹林对COX1和COX2的抑制作用持久,可持续整个血小板的寿命周期,约7~10 d。其有效且不可逆的作用特点,使其成为缺血性脑卒中和心肌梗死的二级预防用药[5,11]。然而大约有1/3的患者在单独使用阿司匹林治疗的过程中仍然出现了血栓性并发症,因此高危患者可采用双联抗血小板药物进行治疗[2]。
P2Y12受体位于血小板表面,通过结合二磷酸腺苷(ADP)促使血小板聚集而发挥凝血作用。大多数抗血小板药物的研制都是以结合这些血小板表面的受体为靶目标,减缓血小板的激活。这类药物不可逆或可逆地抑制血小板ADP受体,从而抑制活化血小板释放ADP诱导的血小板聚集[5,11]。氯吡格雷和普拉格雷属于前体药物,通过肝脏代谢后激活。由于其结合的不可逆性,暴露于此类药物的血小板凝血活性在剩余寿命周期都受到影响,因而血小板功能的恢复速率同血小板的更新速度一致,通常需要7~10 d。替格瑞洛的抑制作用具有可逆性,停药后抗血小板效应在3~5 d消失。坎格瑞洛可逆性抑制P2Y12受体且在血浆中可快速被酶代谢,可通过静脉进行给药,在停止输注的1 h内血小板功能可恢复到正常水平;此药代动力学特性使其成为围手术期停用长效抗血小板药物后可选的桥接治疗药物[5]。
糖蛋白Ⅱb/Ⅲa是血小板表面的受体,主要介导纤维蛋白原、血管性血友病因子(von Willebrand因子)和玻璃粘连蛋白与血小板的结合,从而使血小板发生交联,引起血小板聚集。阿昔单抗、替罗非班、依替巴肽可目标性阻断这一过程。替罗非班、依替巴肽作用时间较短,其血小板抑制作用在给药后可持续2~4 h。阿昔单抗作用持续时间较长,对于无其他高危出血风险的患者需在术前48 h停药[5,11]。
环磷酸腺苷(cAMP)作为细胞内信号传导的第二信使,在血小板聚集中发挥重要作用。cAMP升高抑制血小板聚集。PDE水解cAMP,降低细胞内cAMP水平,促进血小板聚集。因此抑制PDE可以有效地抑制血小板聚集。西洛他唑、双嘧达莫可通过此途径发挥抗血小板作用,然而其同样具有舒张血管的作用,因此低血压是此类药物常见的不良反应[5]。
纤溶药物能够直接或间接激活纤维蛋白溶解酶原变成纤溶酶,从而降解血栓的主要成分纤维蛋白,促进血栓的裂解并达到开通血管的目的。目前根据药物发现的时间和药物特点,纤溶药物主要分为3类。
这类药物不具有纤维蛋白特异性,可出现全身纤溶激活状态,增加出血风险。尿激酶无抗原性和过敏反应,链激酶具有一定抗原性,部分患者输注链激酶时出现过敏反应。临床应用上具有一定局限性[12]。
t-PA对纤维蛋白具有特异性亲和力,故可选择性激活血凝块中的纤溶酶原,具有较强的局部溶栓作用,同时不引起全身纤溶激活状态。scu-PA同时具有酶原和酶的双重性,其诱导的溶栓同样具有相对血栓的专一性。二者无抗原性,过敏反应较少[12]。rhPro-UK具有溶栓作用强、出血风险小、再通率高等优点,目前较多应用于急性ST段抬高型心肌梗死的紧急溶栓治疗。
替奈普酶对纤维蛋白特异性较t-PA强,拮抗纤溶酶原激活抑制剂-1(PAI-1)的能力较t-PA强。瑞替普酶是目前国内临床用的重组人组织型纤溶酶原激酶衍生物,血管开通率高,临床应用方便[12]。
心房颤动(房颤)、心脏瓣膜病、VTE、冠状动脉粥样硬化性心脏病、脑卒中、周围血管病等多种临床急慢性疾病,均存在不同程度的血栓栓塞风险,患者可能长期服用抗血栓药物。本文列出了目前临床应用较为广泛的血栓栓塞风险分级及评分方法,作为患者围手术期血栓栓塞风险评估的参考。
房颤是最常见的心律失常之一。我国2004年所发表的数据显示,30~85岁人群中房颤发病率为0.77%;脑卒中等血栓栓塞性并发症是房颤致死致残的主要原因[13]。合理应用抗凝药物、预防卒中的新发和复发是房颤患者综合管理策略中的重要内容。根据基线特征对患者进行危险分层是制定抗凝治疗策略的基础,目前CHA2DS2-VASc评分[14]是临床上应用最广泛的评估工具(表1)。

CHA2DS2-VASc评分表
CHA2DS2-VASc评分表
| 危险因素 | 评分 |
|---|---|
| 充血性心力衰竭/左心功能不全(C) | 1 |
| 高血压(H) | 1 |
| 年龄>75岁(A) | 2 |
| 糖尿病(D) | 1 |
| 卒中/TIA/血栓形成(S) | 2 |
| 血管性疾病(V) | 1 |
| 年龄65~74岁(A) | 1 |
| 女性(Sc) | 1 |
| 总分 | 9 |
注:TIA为短暂性脑缺血发作
随着CHA2DS2-VASc评分的增高,房颤患者未来发生血栓栓塞事件的风险逐渐增高。评分1~3分的房颤患者血栓栓塞风险评级为低危(年血栓栓塞率<5%),4~5分为中危(年血栓栓塞率5%~10%),>5分为高危(年血栓栓塞率>10%)[15]。CHA2DS2-VASc已被用于胸外科手术患者围手术期新发房颤血栓栓塞的风险评估[16],但将其用于合并房颤患者围手术期血栓栓塞的风险评估,尚无确切数据支持。目前可将其应用于评估房颤患者停用抗凝药物后血栓栓塞风险以及是否需要桥接治疗。
【推荐意见】对于接受长期抗凝药物治疗的房颤患者,其围手术期停药所致的血栓栓塞风险,可以用CHA2DS2-VASc评分进行风险分级。
对于机械瓣膜置换术后的患者,其血栓栓塞风险分级见表2[4]。对于高危患者,即使服用华法林进行抗凝,年卒中发生率仍然>10%;中危患者在服用华法林抗凝情况下年卒中发生率为5%~10%;低危患者在服用华法林抗凝情况下年卒中发生率低于5%[17]。

心脏机械瓣膜置换术后患者栓塞风险分级表
心脏机械瓣膜置换术后患者栓塞风险分级表
| 风险分级 | 危险因素 | 中断VKA后是否桥接 | |
|---|---|---|---|
| 高危 | 二尖瓣置换 | 推荐 | |
| 球笼瓣或斜碟形主动脉瓣置换术 | |||
| 6个月内卒中或TIA发作 | |||
| 中危 | 双叶状主动脉瓣置换和下列因素中的1个或多个 | 推荐 | |
| 心房颤动 | |||
| 既往卒中或TIA发作 | |||
| 高血压病 | |||
| 糖尿病 | |||
| 充血性心力衰竭 | |||
| 年龄>75岁 | |||
| 低危 | 双叶状主动脉瓣置换,且无心房颤动和其他卒中危险因素 | 无需桥接 | |
注:VKA为维生素K拮抗剂;TIA为短暂性脑缺血发作
机械瓣置换术后患者中止抗凝可致血栓发生,该类患者围手术期中断VKA抗凝后可以LMWH进行短期桥接治疗。对于创伤小、出血可控的手术或者操作,无需中断VKA;较大手术可以中断VKA使INR水平处于略低于临床治疗水平,而无需进行桥接抗凝治疗;但对于合并有其他血栓形成风险、使用老一代机械瓣或者二尖瓣置换的患者,需要进行抗凝桥接治疗[18]。
生物瓣膜置换术后的患者通常无需进行长期抗凝治疗。部分指南建议在生物瓣膜植入/置换术后的3~6个月内进行短期的抗凝治疗,以降低血栓事件的发生率。若遇到生物瓣膜置换6个月后仍在使用抗凝治疗的患者,则其抗凝治疗的目的可能是针对继发的其他并发症,其停药后的栓塞风险应根据该继发的并发症进行评估。择期外科手术均应推迟至生物瓣膜置换3~6个月后进行;若为限期或急诊手术,则可以暂停华法林治疗且无需进行桥接,并在出血风险减小后恢复抗凝治疗[4,17]。
【推荐意见】对于长期接受抗凝药物治疗的人工心脏瓣膜患者,围手术期停药可导致血栓栓塞风险增加。可以参照心脏机械瓣膜置换术后栓塞风险分级表进行风险分级,或请心外科、心内科、麻醉科进行多学科会诊。
VTE包括深静脉血栓形成(DVT)和肺血栓栓塞症(PTE),是同一种疾病在不同阶段的临床表现。抗凝是VTE治疗的基础,抗凝疗程不足可致VTE的复发。无诱因及恶性肿瘤相关的VTE是复发的高危因素,因此合并上述两项高危因素的患者也应延长抗凝治疗时间[19]。
近期VTE患者停用抗血栓药物后血栓复发风险较高,有研究结果显示在VTE后1个月内停用抗血栓药物,其月复发率高达40%;而完成3个月抗凝治疗后,其年复发率降至15%[20]。继发于外科手术或一过性因素的VTE,抗凝时间为3个月;首次发生DVT且原因不明的患者,先给予3个月抗凝治疗,疗程结束后根据患者抗凝获益风险比决定是否继续抗凝;合并活动性肿瘤或具有血栓形成原发性危险因素(抗凝血酶缺失、蛋白C或S缺乏、凝血酶原基因突变等)的首次发生DVT患者,以及反复多次发生DVT的患者建议长期抗凝[21]。综上所述,对于VTE患者,建议在完成3个月抗凝治疗后进行择期外科手术。
遗传性易栓症是一种易发生血栓栓塞的具有遗传倾向的疾病,其血栓栓塞类型主要为静脉血栓。其病因包括抗凝血酶缺陷、蛋白C缺陷、蛋白S缺陷、因子V Leiden突变等。大部分遗传性易栓症患者需接受抗凝治疗预防VTE的发生,治疗药物包括传统的华法林或肝素,以及非维生素K拮抗剂类口服抗凝剂[22]。
对于VTE及易栓症患者,围术期血栓复发与形成的风险分级见表3[4,23]。高危提示年发生VTE风险>10%,中危提示上述风险在5%~10%之间,低危提示上述风险<5%。
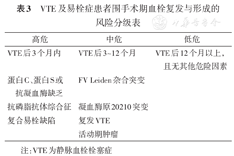
VTE及易栓症患者围手术期血栓复发与形成的风险分级表
VTE及易栓症患者围手术期血栓复发与形成的风险分级表
| 高危 | 中危 | 低危 |
|---|---|---|
| VTE后3个月内 | VTE后3~12个月 | VTE后12个月以上,且无其他危险因素 |
| 蛋白C、蛋白S或抗凝血酶缺乏 | FV Leiden杂合突变 | |
| 抗磷脂抗体综合征 | 凝血酶原20210突变 | |
| 复合易栓缺陷 | 复发VTE | |
| 活动期肿瘤 |
注:VTE为静脉血栓栓塞症
对于既往曾有无诱因VTE、无或有诱因且威胁生命的肺栓塞患者,术前应咨询内科医生共同参与患者围手术期抗凝治疗方案制定[4]。
【推荐意见】对于长期接受抗凝药物治疗的VTE或易栓症患者,其围手术期停药所致血栓栓塞风险,可以按照围手术期血栓复发与形成的风险分级表进行风险分级,或请内科会诊。
阿司匹林(每日75~100 mg)作为冠心病的一级和二级预防药物已在临床广泛使用,而阿司匹林联合一种P2Y12受体拮抗剂的双联抗血小板治疗则应用于经皮冠状动脉介入治疗(PCI)后、心脏搭桥术后、溶栓后以及单纯药物治疗的急性冠脉综合征患者中。
既往研究发现[24],冠心病患者在植入冠状动脉支架后1个月内行非心脏外科手术,围手术期死亡、急性心肌梗死和支架内血栓等心脏不良事件发生率高达30%;在2~6个月时进行手术,上述不良事件发生率降至10%~15%;在6个月后进行手术降至10%以下。因此对植入冠状动脉支架的患者,若拟行高出血风险的手术,则需仔细权衡停用抗血小板药物造成的心血管并发症风险以及不停用药物所致出血风险之间的利弊。
2018年发布的PCI术后患者行外科手术围手术期抗血栓药物多学科管理意见中,对PCI术后患者围手术期血栓栓塞风险进行分级[25],具体见表4。对于PCI术后>12个月的患者,围手术期血栓栓塞风险为低危,可以进行择期手术。而对于PCI术后12个月以内的患者要根据多种因素决定择期手术时间。概括而言,单纯冠状动脉普通球囊扩张后至少2周再行择期手术,植入金属裸支架(BMS)后至少1个月再行择期手术,植入药物洗脱支架(DES)后至少3个月再行择期手术,对于新一代的DES可以根据情况适当缩短时间,植入生物可吸收支架(BVS)后至少12个月再行择期手术。该多学科管理意见未包括药物涂层球囊(DCB)术后的患者,但目前DCB在国内使用也逐渐增加。由于DCB推荐的双联抗血小板时间为1~3个月[26],所以DCB术后至少1个月再行择期手术。在针对具体患者时,可参照表4进行血栓风险分级,其中,缺血风险升高的临床证据包括此次PCI时临床表现为ACS、既往多次心肌梗死病史、既往规范抗血小板治疗过程中发生支架内血栓、左室射血分数<35%、慢性肾脏疾病和糖尿病;缺血风险升高的造影证据包括长支架或多个支架(至少植入3枚支架或治疗3处以上病变或支架总长度>60 mm)、重叠支架、支架直径小(<2.5 mm)、分叉处病变(植入2枚支架)、广泛的冠状动脉病变性冠心病、血运重建不完全或慢性完全闭塞病变的治疗。若患者无法提供支架等冠心病相关信息,建议术前心内科会诊,进一步对手术耐受情况及血栓风险进行评估。
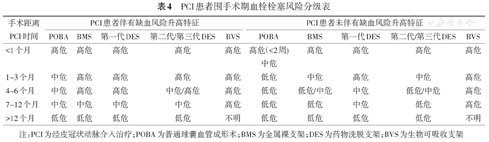
PCI患者围手术期血栓栓塞风险分级表
PCI患者围手术期血栓栓塞风险分级表
| 手术距离PCI时间 | PCI患者伴有缺血风险升高特征 | PCI患者未伴有缺血风险升高特征 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| POBA | BMS | 第一代DES | 第二代/第三代DES | BVS | POBA | BMS | 第一代DES | 第二代/第三代DES | BVS | |
| <1个月 | 高危 | 高危 | 高危 | 高危 | 高危 | 高危(<2周)中危 | 高危 | 高危 | 高危 | 高危 |
| 1~3个月 | 中危 | 高危 | 高危 | 高危 | 高危 | 低危 | 中危 | 高危 | 中危 | 高危 |
| 4~6个月 | 中危 | 高危 | 高危 | 中危/高危 | 高危 | 低危 | 低危/中危 | 中危 | 低危/中危 | 高危 |
| 7~12个月 | 中危 | 中危 | 中危 | 中危 | 高危 | 低危 | 低危 | 中危 | 低危 | 高危 |
| >12个月 | 低危 | 低危 | 低危 | 低危 | 不明 | 低危 | 低危 | 低危 | 低危 | 不明 |
注:PCI为经皮冠状动脉介入治疗;POBA为普通球囊血管成形术;BMS为金属裸支架;DES为药物洗脱支架;BVS为生物可吸收支架
冠心病患者行冠状动脉旁路移植术(CABG)也是外科治疗手段之一。关于CABG术后抗血小板药物治疗时限,应根据患者CABG时临床情况来制定:急性冠脉综合征患者进行CABG后,术后应重新开始恢复P2Y12抑制剂治疗,治疗时间应达到急性冠脉综合征事件后的12个月(Ⅰ类推荐);对于PCI术后再行CABG术患者,术后应重新恢复P2Y12抑制剂治疗,至完成PCI要求的双联抗血小板药物治疗时间(Ⅰ类推荐);而稳定性缺血性心脏病患者在CABG术后也可以考虑进行双联抗血小板治疗12个月,以确保移植静脉的通畅(Ⅱb类推荐)[27]。减少动脉粥样硬化性血栓形成实现持续健康(REACH)注册研究发现,CABG术后若冠心病二级预防治疗未达到1年,无论基线危险因素情况如何,术后心血管不良事件均显著增加[28]。因此对于CABG患者术后进行择期非心脏手术的患者,尤其是在CABG术后1年内患者,建议术前心外科、心内科会诊,进一步对手术耐受情况及血栓栓塞风险分级进行评估。
对于未行PCI的冠心病患者,若近期发生心肌梗死,建议将择期非心脏手术推迟至心肌梗死事件6个月以后进行[25]。术前仅用阿司匹林作为心血管病一级预防(未诊断冠心病人群,为积极改善冠心病高危因素而进行的预防性用药)的患者,可在术前暂停使用阿司匹林;而当阿司匹林作为心血管病二级预防(诊断冠心病人群,为减少并发症,改善病死病残率而进行的预防性用药)的患者,除进行高出血风险手术外,建议继续使用阿司匹林。术前仅用P2Y12抑制剂进行治疗的患者,若拟行低危出血风险手术,建议围手术期继续应用,或术前至少使用阿司匹林7 d,75~100 mg替代P2Y12抑制剂。对于有长期抗血小板治疗指征的患者,术后尽早恢复单抗血小板药物治疗[25]。对于这部分患者,建议术前完成心内科、心外科、麻醉科等参与的多学科会诊,参照最新心脏病患者非心脏手术术前评估指南进行医疗决策[29],给予包括心脏再血管化手术和(或)非心脏手术的手术时机、手术方案以及围手术期抗栓药物管理在内的综合处理方案。
【推荐意见】长期接受抗血小板治疗用于冠心病一级预防的,属于低危人群;长期接受抗血小板治疗未行血运重建且病情稳定的冠心病患者也属于相对低危人群;未行PCI治疗心肌梗死后6个月内的患者属于血栓高危人群;如果已行PCI治疗且无心绞痛症状,可以按照PCI患者围手术期血栓栓塞风险分级表进行风险评估;如果已行PCI治疗或应用抗血小板药物进行冠心病二级预防但仍有心绞痛症状的患者,或者CABG 1年内的患者,可组织有相关外科、心内科、心外科、麻醉科等参与的多学科会诊,形成非心脏手术时机、手术方案以及围手术期血栓栓塞风险的综合评估及处理方案。
对于非心源性缺血性脑卒中患者,推荐使用抗血小板药物而非口服抗凝药物用于预防卒中复发和其他心血管事件。根据患者的复发风险、经济情况、疗效及其他临床情况个体化选择抗血小板药物[30,31]。对于伴有严重颅内动脉狭窄(狭窄率70%~99%)的缺血性脑卒中/TIA患者,推荐联合应用阿司匹林和氯吡格雷90 d,90 d后可单用其中一种药物作为长期预防性用药[31]。若拟行高出血风险手术,术前停用抗血小板药物。如果拟行低出血风险手术,术前使用阿司匹林作为缺血性脑卒中二级预防的患者,建议围手术期不停用阿司匹林;术前单独使用P2Y12抑制剂进行预防的患者,建议围手术期继续应用,或至少术前7 d,用75~100 mg阿司匹林替代P2Y12抑制剂[32]。
一项大样本观察性研究提示[33],近期发生的缺血性脑卒中尤其是9个月内的缺血性脑卒中与择期非心脏手术后严重心血管不良事件相关。该研究发现术前3个月内、3~6个月内、6~12个月内、12个月以上发生缺血性脑卒中/TIA的患者,在非心脏手术后30 d内缺血性脑卒中再发生率分别为11.8%、4.5%、1.8%、1.4%;而无此病史者,术后30 d内缺血性脑卒中发生率仅为0.1%[33]。因此所有缺血性脑卒中/TIA患者,推荐限期或择期手术尽量推迟至发病9个月之后进行。必须进行双联抗血小板治疗的患者,建议在完成3个月双联抗血小板药物治疗后再进行择期手术。若手术无法推迟,则至少在缺血性脑卒中/TIA事件1个月后进行。对于拟行非心脏大手术的患者,若术前6个月内曾发生缺血性脑卒中/TIA,且颅外颈动脉狭窄≥50%(症状性狭窄),推荐在非心脏手术前进行颈动脉再血管化治疗,以降低围手术期脑卒中的风险。对于无症状性颅外颈动脉狭窄患者,即缺血性脑卒中/TIA发生已超过6个月或者未曾发生缺血性脑卒中/TIA患者,若行非心血管外科手术,不推荐手术前进行预防性颈动脉内膜剥脱术或颈动脉支架植入术[34]。
目前尚缺乏缺血性脑卒中/TIA患者围手术期卒中风险分级评估的方法。非心源性缺血性脑卒中/TIA发病在6个月内、合并颅内外责任血管狭窄>50%者,定义为症状性狭窄,为卒中复发高危人群;距发病时间越短、狭窄程度越重,卒中复发风险越高。症状性颅内动脉狭窄>70%的患者,即使经积极内科药物治疗,发病1年内脑卒中和死亡的复合终点事件发生率仍高达12.2%[35],为卒中复发的高危人群。颅内外责任血管狭窄>50%,缺血性脑卒中/TIA发病6个月以上或者未曾发生者,定义为无症状性狭窄,为卒中复发高危或中危人群。对于不合并颅内外责任血管狭窄患者,缺血性脑卒中/TIA发病时间3个月之内为高危,3个月以上患者可采用Essen卒中风险评分量表对围手术期卒中风险进行评估(表5),评分越高复发风险越高,≥3分为围手术期卒中的中危人群,<3分为低危人群。若合并非责任血管狭窄,则需要多学科专家会诊来评估围手术期脑卒中/TIA的复发风险[36]。
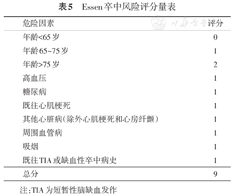
Essen卒中风险评分量表
Essen卒中风险评分量表
| 危险因素 | 评分 |
|---|---|
| 年龄<65岁 | 0 |
| 年龄65~75岁 | 1 |
| 年龄>75岁 | 2 |
| 高血压 | 1 |
| 糖尿病 | 1 |
| 既往心肌梗死 | 1 |
| 其他心脏病(除外心肌梗死和心房纤颤) | 1 |
| 周围血管病 | 1 |
| 吸烟 | 1 |
| 既往TIA或缺血性卒中病史 | 1 |
| 总分 | 9 |
注:TIA为短暂性脑缺血发作
对于明确存在血管狭窄的脑卒中患者,血管内支架植入术也是治疗的主要方式之一。症状性或无症状性颅内外脑动脉狭窄支架植入术后,通常建议连续使用双联抗血小板药物,治疗时间为1~12个月不等,此后长期进行单一抗血小板药物治疗;其中颈动脉支架后建议至少进行1个月的双联抗血小板治疗[36]。目前尚缺乏脑血管支架植入后围手术期处理的循证证据,可参照冠心病冠状动脉支架的血栓栓塞风险分级推荐意见进行酌情处理[34],择期手术尽量推迟至支架植入1个月后进行。而对于已行颈动脉内膜剥脱术的患者,建议在围手术期及术后长期进行抗血小板药物治疗[34];拟行非心脏手术前,建议由神经内科、神经外科、血管外科、麻醉科、外科进行多学科会诊,明确手术时机。
心源性缺血性脑卒中/TIA患者,围手术期血栓栓塞风险分级及处理同非瓣膜性房颤和瓣膜性房颤患者。距离缺血性卒中/TIA发病时间越近,复发风险越高;发病3个月以内者列为高危,3个月以上者列为中危,未发生者列为低危[4]。这些患者同时要兼顾房颤本身的CHA2DS2-VASc评分,以风险分级较高的结果作为最终血栓栓塞风险分级结果。
脑静脉窦血栓形成的围手术期血栓栓塞风险分级及处理同VTE。
对于因缺血性脑卒中/TIA病史而长期服用抗栓药物的患者,在评估停药所致围手术期再发缺血性脑卒中/TIA风险时,可依据下述标准评估停药所致围手术期再发缺血性脑卒中/TIA的风险:高危指年缺血性脑卒中/TIA发生率>10%、中危为5%~10%、低危<5%。此类患者围手术期脑卒中风险分级流程见图1。
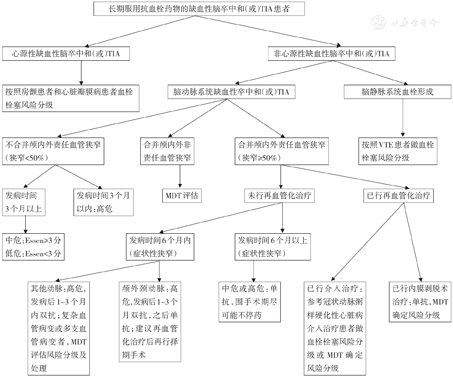

注:TIA为短暂性脑缺血发作;VTE为静脉血栓栓塞症;MDT为多学科协作诊疗
【推荐意见】对于长期接受抗血小板药物治疗的缺血性脑卒中/TIA患者,其围手术期停药后血栓栓塞的风险,可以按照围手术期脑卒中/TIA再发风险分级流程图进行风险分级;对于有缺血性脑卒中/TIA病史且合并颅内外血管狭窄的患者,可申请相关外科、神经内科、神经外科、麻醉科、血管外科等多学科会诊,形成非心脏手术时机、手术方案以及围手术期血栓栓塞风险的综合评估及处理意见。
阿司匹林或氯吡格雷单独使用被推荐用于有症状的外周动脉疾病(PAD)患者,以减少心肌梗死、脑卒中和血管性死亡(心脑血管、静脉血栓栓塞、出血及其他血管原因所致的死亡,以及未知原因的死亡)的发生。对于无症状的PAD患者[踝肱指数(ABI)≤0.90],抗血小板治疗同样能降低或减少心肌梗死、脑卒中和血管性死亡发生率。双联抗血小板(阿司匹林、氯吡格雷)则被推荐用于有症状的PAD患者下肢血管血运重建术后[37]。
围手术期停用抗血小板药物对于除颈动脉外的PAD患者的风险及获益尚不明确,所以对PAD患者尤其是有症状的PAD患者进行术前评估时,建议邀请介入/血管外科医生共同参与围手术期抗血栓药物停药与否以及是否进行桥接的方案制定。
【推荐意见】对于长期接受抗血小板药物治疗的周围血管病患者,其围手术期停药所致血栓栓塞风险,可由相关外科、介入/血管外科、心内科、心外科、麻醉科多学科会诊进行风险分级。
围手术期出血风险主要受手术或有创操作的类型影响。通常来说任何长时间(超过45 min)的手术操作以及在重要部位(如中枢神经系统和心脏)、血运丰富的器官(如肝脏、脾脏)或大血管、纤溶活跃部位(如泌尿系统)等进行的手术或有创操作应视为有高危出血风险[38]。国内外对于不同类型手术或有创操作出血风险分级不尽相同,本文参考相关文献[4,30,38],并结合五类常见非心脏手术特点,总结外科手术出血风险分级见表6。

外科手术出血风险分级表
外科手术出血风险分级表
| 出血风险 | 高危 | 低危 |
|---|---|---|
| 内镜操作 | 除外出血风险低危的内镜操作,包括内镜+实体肿物针吸活检,狭窄扩张(食道、结直肠),内镜下氩等离子凝固治疗,息肉切除术,经皮胃镜胃造口术(PEG),曲张血管硬化,痣核硬化,贲门失弛缓扩张术,黏膜切除术/黏膜下切除术(ESD术),胰腺囊肿超声细针穿刺活检,壶腹切开术 | 食道、胃、十二指肠镜或结肠镜检查(不做活检),超声内镜无活检,内镜下逆行胰胆管造影(ERCP),内镜下支架置入术,乳头肌扩张无括约肌切开 |
| 胸外科手术 | 除外出血风险低危的胸外科手术,包括肺叶切除术,一侧全肺切除术,胸膜全肺切除术,淋巴结清扫术,食管手术,胸膜剥脱术 | 单纯肺楔形切除术,单纯肺大疱切除术,胸膜活检(无胸膜出血、渗血),纵膈肿物切除术,胸壁肿物切除术 |
| 泌尿外科手术 | 肾上腺相关手术,肾脏相关手术,输尿管相关手术(非结石类手术),经皮肾镜碎石术,膀胱切除/部分切除术,前列腺根治性切除术,经尿道膀胱肿瘤电切术(TUR-Bt),经尿道前列腺切除术(TUR-P),睾丸部分切除/切除术,阴茎部分切除/切除术,经尿道闭孔无张力尿道中段悬吊术(TVT-O),腹膜后肿物切除术,回肠膀胱术 | 膀胱内窥镜检查,双猪尾管(DJ管)置入/置换/取出术,输尿管镜检查术,经尿道膀胱镜/输尿管镜碎石术,骶神经刺激电极植入/调节/取出术,前列腺粒子植入术,前列腺-尿道金属支架置入术,膀胱镜内切开术,尿道扩张术,尿道肿物切除术 |
| 骨科手术 | 股骨颈骨折手术,髋关节置换术,膝关节置换术,骨盆、长骨骨折切开复位内固定术,重大脊柱手术,人工肩关节置换术,骨肿瘤手术,二次翻修手术 | 手外科手术,足外科手术,小型脊柱外科手术,肩、手、膝、足部关节镜检查及手术 |
| 普通外科手术 | 甲状腺相关手术,胃相关手术(除外穿孔修补术),减肥手术,脾切除术,胰腺相关手术,胆囊手术,胆道相关手术,十二指肠相关手术(除外穿孔修补术),小肠相关手术,结肠相关手术,直肠相关手术,肝脏手术 | 乳腺手术,疝气手术,消化道穿孔修补术,造口还纳术,造口术,阑尾手术,皮肤肿物切除术 |
患者的自身因素也会对出血风险产生影响[39]。HAS-BLED用于评估非瓣膜性房颤患者的出血风险(表7)。研究表明[40],HAS-BLED同样适用于评价长期服用抗血栓药物患者围手术期使用肝素桥接的出血风险,HAS-BLED评分≥3分高度提示高出血风险[41]。因此,建议对于术前长期服用抗凝药物治疗的患者,可以采用HAS-BLED评分进行患者自身出血风险评估。

HAS-BLED评分表
HAS-BLED评分表
| 疾病种类 | 评分 |
|---|---|
| 高血压(H) | 1 |
| 肝、肾功能不全(A) | 各1分 |
| 脑卒中(S) | 1 |
| 出血(B) | 1 |
| 异常INR值(L) | 1 |
| 年龄>65岁(E) | 1 |
| 药物或饮酒(D) | 各1分 |
注:INR为国际标准比值
对于术前使用抗血小板药物治疗的患者,可以参考PRECISE-DAPT评分[42]进行患者自身出血风险评价。
鉴于目前尚无明确的指南对手术出血风险进行分级,建议外科医师关注患者自身情况、手术具体情况以及自身操作熟练程度,综合评价手术出血风险。若患者自身出血风险分级与手术出血风险分级不一致,建议取风险分级较高者作为最终出血风险分级结果。
【推荐意见】对于长期接受抗栓药物治疗、拟行非心脏手术的患者,可以按照外科手术出血风险分级表进行风险分级。
【推荐意见】对于长期接受抗栓药物治疗、拟行非心脏手术的患者,抗凝治疗患者可以按照HAS-BLED评分表进行患者出血风险分级;抗血小板治疗患者可以参照PRECISE-DAPT评分表进行患者出血风险分级。
【推荐意见】对于长期接受抗栓药物治疗、拟行非心脏手术的患者,如果其手术出血风险分级与患者出血风险分级结果不一致,建议取风险较高的分级作为最终的手术与患者出血风险分级。
长期服用抗血栓药物患者围手术期药物管理策略的制定,需要谨慎权衡血栓栓塞风险和围手术期出血风险,最终方案的制定需要遵循个体化原则。在评估完患者的血栓栓塞风险以及围手术期出血风险后,决定是否需要停用抗血栓药物(比如低栓塞风险、高围手术期出血风险患者需术前停用抗血栓药物)。而药物的半衰期决定了术前停药时机,药物的起效时间决定术后恢复使用药物的时机[4]。
桥接可以作为应用长效抗血栓药物患者接受有创操作前的一个替代治疗,其目的是增强抗血栓药物的可控性,在减小高危患者围手术期血栓栓塞风险的同时,尽量最小化大手术后的出血风险。不同类型抗血栓药物围手术期桥接获益不尽相同,下文将分别针对各类常见抗血栓药物推荐围手术期是否需要进行抗凝、抗血小板桥接以及具体桥接方案。临床上常用药物的停药时机、恢复用药时机见表8。

常见抗血栓药物停药时机及恢复用药时机
常见抗血栓药物停药时机及恢复用药时机
| 药物 | 术前停药时机 | 术后恢复用药时机 | |||
|---|---|---|---|---|---|
| 维生素K拮抗剂 | |||||
| 华法林 | 术前5 d | 术后12~24 h | |||
| 抗血小板药物 | |||||
| 阿司匹林 | |||||
| 未行PCI者 | 术前7~10 d | 术后出血风险减少后 | |||
| PCI术后 | 尽量缩短停药时间(4~10 d) | 术后出血风险减少后 | |||
| 氯吡格雷 | 术前5 d | 术后出血风险减少后 | |||
| 普拉格雷 | 术前7 d | 术后出血风险减少后 | |||
| 替格瑞洛 | 术前5 d | 术后出血风险减少后 | |||
| 其他抗凝药物 | |||||
| 普通肝素(静脉) | |||||
| 低出血风险 | 术前4~6 h | 术后24 h | |||
| 高出血风险 | 术前4~6 h | 术后48~72 h | |||
| 普通肝素(皮下) | |||||
| 低出血风险 | 术前12~24 h | 术后24h | |||
| 高出血风险 | 术前12~24 h | 术后48~72 h | |||
| 低分子肝素 | |||||
| 低出血风险 | 术前24 h | 术后24 h | |||
| 高出血风险 | 术前24 h | 术后48~72 h | |||
| 达比加群酯 | |||||
| 低出血风险 | |||||
| 肾功能正常 | 术前24 h | 术后24 h | |||
| 肾功能不全 | 术前48 h | 术后24 h | |||
| 高出血风险 | |||||
| 肾功能正常 | 术前48 h | 术后48~72 h | |||
| 肾功能不全 | 术前96 h | 术后48~72 h | |||
| 利伐沙班、阿哌 | |||||
| 沙班及艾多 | |||||
| 沙班 | |||||
| 低出血风险 | 术前24 h | 术后24 h | |||
| 高出血风险 | 术前48 h | 术后48~72 h | |||
注:PCI为经皮冠状动脉介入治疗
术前使用VKA抗凝的患者若术前需要暂停用药,建议术前5 d开始停用药物,术后12~24 h(手术当日夜间或术后第一日晨)在止血彻底的前提下恢复使用VKA[3]。
对于机械瓣膜置换术后、房颤或VTE患者,若血栓栓塞风险分级为高危,建议进行抗凝桥接治疗[3]。桥接治疗的方案为:在停用VKA后,监测INR低于治疗范围后开始LMWH治疗剂量给药,在术前24 h停用治疗剂量的LMWH;手术当日复查INR,若INR<1.5则可进行择期手术,否则静脉给予维生素K(1 mg);术后12~24 h(手术当日夜间或术后第一日晨)在止血彻底的前提下恢复VKA使用,按照术前治疗剂量进行给药;同时根据出血风险在术后24 h(非高出血风险手术)立即开始、或术后48~72 h(高出血风险手术)开始使用LMWH治疗剂量给药,一旦INR达到治疗范围即可停止LMWH给药;对于肾功能不全的患者(肌酐清除率<30 ml/min),UFH优于LMWH[18]。
使用UFH进行桥接治疗患者,通常静脉给予治疗剂量,建议在高出血风险的手术或操作前停用4~6 h。如果手术为低风险手术,则在术后24 h后可恢复UFH使用;若为出血高风险手术,则在术后48~72 h可根据出血情况考虑开始恢复UFH使用[3]。
对于机械瓣膜置换术后、房颤或VTE患者,若血栓栓塞风险分级为低危,建议在停用VKA治疗后可不进行桥接治疗[3]。对于血栓栓塞风险为中危的患者,其是否进行桥接治疗需依据患者个体情况及手术相关因素决定[3]。
进行简单牙科操作时,可在继续使用VKA药物,同时局部使用止血药物,或者在操作前停用2~3 d。进行简单的皮肤操作时,推荐继续使用VKA药物并优化局部止血。眼科白内障手术患者可以继续使用VKA治疗[3]。
【推荐意见】对于长期接受VKA抗凝治疗的患者,应当根据手术患者出血风险和围手术期血栓栓塞风险,决定是否需要停药和桥接;如果需要桥接,通常应用LMWH和UFH进行桥接。
NOAC起效和消退快、半衰期短、不需要监测凝血参数是其在临床应用中具有的主要优势,但在围手术期中应用却存在难以监测和管理的问题,且目前大部分NOAC尚无可用的拮抗剂。
NOAC的围手术期管理需要依据手术出血风险、患者因素进行个体化决策,患者因素包括肾功能、肝功能和合并用药[41]。其中合并用药包括CYP3A4抑制剂和P-糖蛋白抑制剂类药物(增加抗凝药物浓度)、抗血小板药物、抗炎药物、选择性或非选择性五羟色胺再摄取抑制剂和其他抗血栓药物,这些药物和NOAC合用时会增加出血风险。
对于肾功能正常患者,低出血风险手术建议术前停药24 h,高出血风险手术建议术前停药48 h,详细停药时间见表8[43]。而对于肾功能不全患者,低出血风险手术建议术前停用达比加群酯2 d,高出血风险手术建议术前停药4 d。
术后恢复NOAC的时间取决于手术出血风险、止血效果和患者自身因素。鉴于NOAC起效迅速,术后恢复口服NOAC的时机应谨慎决策[4]。低出血风险手术后恢复用药时间为24 h以后;高危出血风险手术后,治疗剂量NOAC的恢复时间建议推迟至术后48~72 h[44]。对于血栓栓塞风险高危的患者,在未恢复NOAC期间可进行预防剂量的肝素治疗,但尚无获益证据支持。
【推荐意见】对于长期接受NOAC治疗的患者,应根据围手术期血栓栓塞风险和手术患者出血风险,决定是否需要停药;通常不给予桥接治疗。
对于长期使用抗血小板药物治疗的患者,围手术期处理应充分考虑心脑血管事件风险与继续服用药物的出血风险,必要时由内科医生、外科医生以及麻醉科医生进行多学科讨论制定最终方案。
使用阿司匹林作为心血管疾病二级预防的患者,若进行简单牙科、皮肤手术或白内障手术,可在手术期间继续使用阿司匹林[3]。对正在使用阿司匹林治疗的患者,若心血管事件风险分级为高危和中危,建议在非心脏手术期间继续使用阿司匹林治疗;若心血管事件风险分级为低危,则建议术前停用阿司匹林。
若术前必须停用抗血小板药物,推荐无论术前长期口服阿司匹林剂量大小,未行PCI患者术前停药时间均为7~10 d[4];无论拟行手术出血风险高低,停药时间氯吡格雷、替格瑞洛为术前5 d,普拉格雷为术前7 d[25]。PCI术后患者,对于大部分手术操作围手术期均可以保留口服阿司匹林;但一些极高出血风险的手术,如神经外科手术[25],术前可停用阿司匹林,但尽量缩短停药时间。口服阿司匹林患者血小板聚集功能通常在停药后4~6 d恢复正常水平[45]。参考美国区域阻滞和疼痛医学学会和欧洲麻醉协会对区域阻滞及疼痛治疗的指导意见[46],对于高危出血风险手术,术前服用阿司匹林作为PCI术后二级预防治疗时,术前阿司匹林停药时间可减少为4 d。
阿司匹林、氯吡格雷、普拉格雷、替格瑞洛服用后可在1 h内发挥抗血小板作用,因此术后应该在出血风险最小化后恢复口服药物治疗。对于PCI术后患者,建议术后24~48 h恢复P2Y12抑制剂,并使用负荷量,推荐使用氯吡格雷600 mg作为负荷量[32]。
目前尚无确切证据支持在外科手术前应用短效抗血小板药进行桥接治疗[5]。在长效抗血小板药物停药期间,不推荐使用UFH、LMWH或非甾体类抗炎药作为桥接治疗[32]。
对于PCI术后1个月内的患者,若行限期手术且术前必须停用抗血小板药物,建议根据个体案例进行多学科会诊,考虑进行静脉输注抗血小板药物桥接治疗,该桥接治疗必须在重症监护室且监测检验条件充分的条件下进行[9]。
若使用坎格瑞洛作为桥接药物,桥接方案为术前5 d停用氯吡格雷、替格瑞洛,术前7 d停用普拉格雷。氯吡格雷、替格瑞洛停用2~3 d,普拉格雷停药3~4 d后开始使用坎格瑞洛进行桥接治疗,术前1~6 h停药。血小板功能监测可作为开始输注坎格瑞洛时间的决策参考。术后恢复用药时推荐使用口服氯吡格雷,并且使用负荷量。若患者无法口服,可考虑术后进行静脉输注桥接治疗[25]。
若使用替罗非班或依替巴肽作为桥接药物,桥接方案为术前5 d停用氯吡格雷、替格瑞洛,术前7 d停用普拉格雷。术前72 h至术前4~6 h持续输注替罗非班或依替巴肽。对于肾功能受损的患者,药物剂量需要进行减量,同时缩短输注时间,可考虑在术前8~12 h停止输注。术后恢复用药时推荐使用口服氯吡格雷,并且使用负荷量。若患者无法口服,可考虑术后进行静脉输注桥接治疗[25]。
【推荐意见】对于长期接受抗血小板药物治疗的患者,应当根据围手术期血栓栓塞风险和手术患者出血风险,决定是否需要停药和桥接;小剂量阿司匹林尽量不停药。如果必须桥接,通常应用坎格瑞洛、替罗非班或依替巴肽进行桥接,整个桥接过程应当在重症监护室且有检验、监测条件的情况下进行;不推荐使用UFH、LMWH或非甾体类抗炎药作为桥接治疗。
在评估患者停用抗血栓药物后的血栓栓塞风险、手术出血风险、熟悉各类抗栓药物药理学特点以及桥接方案后,权衡利弊决策是否在术前停用抗血栓药物。若确认围手术期需停用药物,则根据患者使用药物的半衰期和患者自身情况决定停药时间,根据药物的起效时间决定术后恢复服药的时间;同时,根据药物的特性以及血栓栓塞的风险分级,确认围手术期是否进行桥接并制定桥接方案。由于整个决策过程比较复杂,因而推荐形成多学科协作团队,共同会诊后,最终形成针对该患者的围手术期抗血栓药物管理方案(图2)。
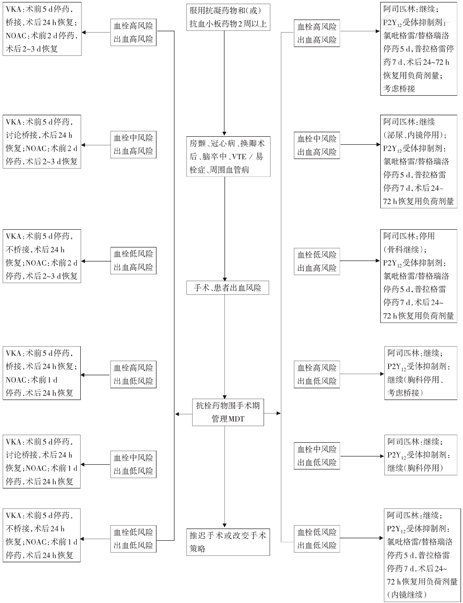

注:VKA为维生素K拮抗剂;NOAC为非维生素K拮抗剂类口服抗凝剂;VTE为静脉血栓栓塞症;MDT为多学科协作诊疗
【推荐意见】长期接受抗栓药物治疗的患者拟行择期非心脏手术前,应当综合考虑停药所致血栓栓塞风险及手术患者自身出血风险,参照决策流程图,必要时申请相关学科进行多学科会诊,共同决定围手术期抗栓药物的个体化管理方案,保障患者围手术期安全。
对于长期服用抗血栓药物的患者,如需进行高出血风险的急诊手术,可使用拮抗剂、凝血酶原复合物或血液制品,对抗血栓药物的作用进行拮抗或者减弱其药物作用,目前尚无抗血栓药物在急诊手术中的管理指南。
UFH可通过静脉给予鱼精蛋白被充分有效拮抗,1 mg鱼精蛋白可拮抗80~120 U的UFH[47]。LMWH亦可通过给予鱼精蛋白进行部分拮抗,0.5~1.0 mg鱼精蛋白可拮抗1 mg依诺肝素。新药Aripazine可能可以安全且充分拮抗LMWH[48],但目前仍在进行临床研究中。
VKA的作用可以通过多种途径被拮抗,包括口服或静脉给予维生素K、输注凝血酶原复合物以及新鲜冰冻血浆[47]。静脉给予维生素K的剂量为1~10 mg,输注时间为30 min以上;凝血酶原复合物静脉输注剂量为25~50 U/kg;新鲜冰冻血浆剂量为10~15 ml/kg。
NOAC的清除通常需要48~72 h。达比加群酯(Dabigatran)是目前唯一一个具有拮抗剂的NOAC,FDA已批准达比加群酯特异性逆转剂Idarucizumab作为其拮抗剂[49];同时可通过血液透析被清除[48]。其他NOAC的拮抗剂目前还在进一步研究中。
在一些急诊情况下,含4种凝血因子的凝血酶原复合物输注可部分拮抗Ⅹa因子抑制剂活性[4,50]。
【推荐意见】关于急诊手术前抗凝药物的紧急拮抗,可以通过特异拮抗剂进行拮抗治疗,也可以应用凝血酶原复合物、新鲜冰冻血浆对抗药物作用。VKA可用维生素K半小时以上静脉输注、凝血酶原复合物以及新鲜冰冻血浆进行拮抗;UFH可用鱼精蛋白进行拮抗;LMWH可用鱼精蛋白部分拮抗;达比加群酯可用Idarucizumab拮抗;直接Ⅹa因子抑制剂可用凝血酶原复合物部分拮抗。
正在服用抗血小板药物并因出血需要进行急诊手术的患者,输注血小板可以替代被抗血小板药物抑制的血小板。如果条件允许可以在术前测定血小板功能。
对于单用阿司匹林的患者,若进行低危出血风险手术可不用预防性输注血小板。术前使用噻吩并吡啶类药物或双联抗血小板药物治疗的患者建议术前输注一次血小板以减少术中输血。血小板推荐剂量为1单位单采血小板或10 ml/kg的随机多供者血小板[4]。
【推荐意见】关于急诊手术前抗血小板药物的紧急拮抗,可以应用单采血小板预防性输注对抗药物作用,如果单用阿司匹林的患者可以不用拮抗。
进行溶栓治疗患者若行急诊手术,出血风险较高。目前尚无指南针对正在进行溶栓治疗的患者进行急诊外科手术相关建议。以下治疗参考2016年美国神经重症监护学会发布的《颅内出血患者抗栓药物拮抗治疗指南》[51]。首先应停止使用溶栓药物;同时使用冷沉淀(Cryoprecipitate)10单位作为初始剂量;若有冷沉淀使用禁忌或无法获得冷沉淀,可以使用纤溶对抗物作为替代治疗,比如氨甲环酸(Tranexamic acid)10~15 mg/kg静脉输注20 min以上。在进行上述治疗以后建议复查纤维蛋白原水平,若纤维蛋白原水平低于1 500 mg/L,建议再次输注冷沉淀治疗。输注血小板目前尚无证据支持其有明确作用。
【推荐意见】关于急诊手术前溶栓药物的紧急拮抗,应立即停用此类药物,给予冷沉淀或抗纤溶药物对抗药物作用。
术前长期服用抗血栓药物的患者,在进行区域阻滞麻醉时同样存在出血风险。麻醉医生也需要考虑患者术前长期服用抗血栓药物的情况,根据停药时间进行麻醉方式选择。若需要进行硬膜外或神经阻滞置管,术后拔管也需要考虑恢复抗血栓药物时机。区域阻滞麻醉包括椎管内阻滞(包括硬膜外阻滞和蛛网膜下腔阻滞)和外周神经阻滞。表9对区域阻滞操作的出血风险进行了风险分级[46]。根据美国区域阻滞和疼痛医学学会和欧洲麻醉协会相关指南,表10对抗血栓药物在区域阻滞操作前停药时间、操作后恢复用药时间进行了总结[46,52,53]。

区域阻滞出血风险分级
区域阻滞出血风险分级
| 低危 | 高危 |
|---|---|
| 浅表及可压迫神经丛/外周神经阻滞,如股神经、腋路臂丛、腘窝入路坐骨神经阻滞等 | 椎管内阻滞;深部及不可压迫神经丛/外周神经阻滞,如锁骨下臂丛、骶旁坐骨神经、后路腰丛阻滞等 |

区域阻滞穿刺/置管或拔除操作时抗血栓药物的停药及恢复时机
区域阻滞穿刺/置管或拔除操作时抗血栓药物的停药及恢复时机
| 药物 | 穿刺/置管或拔管前停药时间 | 穿刺/置管或拔管后恢复用药时间 | 手术后是否保留置管 | 操作前实验室检查 |
|---|---|---|---|---|
| 普通肝素(静脉) | 4~6 h,且凝血功能正常;合并其他凝血疾病不建议进行区域阻滞 | 1 h | 可以保留置管,术后监测运动功能,并且尽量降低局部麻醉药物浓度 | PLT(若治疗>4 d) |
| 普通肝素(皮下) | 低剂量预防(≤15 000 U/d):4~6 h,或评估凝血功能; | 1 h | 低剂量(≤15 000 U/d)可保留置管;高剂量(单次剂量>5 000 U或>15 000 U/d)时无明确意见,建议权衡利弊决定是否保留置管,并且降低局部麻醉麻药物浓度,保留感觉和运动功能,进行神经功能监测 | APTT、ACT、PLT |
| 拔管:4~6 h; | ||||
| 高剂量预防(>15 000 U/d且≤20 000 U/d):12 h,并评估凝血功能; | ||||
| 治疗剂量(单次剂量>10 000 U或 >20 000 U/d):24 h,并评估凝血功能 | ||||
| 低分子肝素(预防剂量,依诺肝素<60 mg/d) | 12 h | 穿刺/置管后12 h,拔管后4 h | 可以保留置管;每日1次给药:术后第2次低分子肝素距离术后第1次低分子肝素给药至少24 h;每日2次给药:建议在术后给予低分子肝素前拔除置管 | PLT(若治疗>4 d) |
| 低分子肝素(治疗剂量,依诺肝素1.5 mg·kg-1·d-1,达肝素200 U·kg-1·d-1,亭扎肝素175 U·kg-1·d-1) | 24 h | 穿刺/置管后24 h,且拔管后4 h | 建议在术后首次给药前拔除置管 | PLT(若治疗>4 d) |
| 阿司匹林 | 无要求 | 无要求 | 可以保留置管 | |
| 氯吡格雷 | 5~7 d | 若给予负荷量,置管拔除后6 h;若不给予负荷剂量,无时间要求 | 可以保留1~2 d,同时恢复用药时不给予负荷量 | |
| 普拉格雷 | 7~10 d | 若给予负荷量,置管拔除后6 h;若不给予负荷剂量,无时间要求 | 不建议保留置管 | |
| 替格瑞洛 | 5~7 d | 若给予负荷量,置管拔除后6 h;若不给予负荷剂量,无时间要求 | 不建议保留置管 | |
| 华法林 | 穿刺/置管:至少5 d且INR正常; | 保留置管期间监测INR及神经功能,降低用药浓度;1.5<INR<3,保留 | 每日监测INR | |
| 拔管:恢复口服华法林后12~24 h,INR<1.5 | 置管患者建议谨慎观察;INR>3,保留置管患者建议停药或减量 | |||
| 达比加群 | 穿刺/置管: | 6 h | 推荐:术后恢复首次口服用药前6 h拔除置管 | TT、APTT |
| 72 h(肌酐清除率>80 ml/min); | ||||
| 96 h(肌酐清除率50~79 ml/min); | ||||
| 120 h(肌酐清除率30~49 ml/min); | ||||
| 不建议操作(肌酐清除率<30 ml/min); | ||||
| 拔管:34~36 ha | ||||
| 利伐沙班 | 穿刺/置管:72 h; | 6 h | 推荐:术后恢复首次口服用药前6 h拔除置管 | 抗Ⅹa因子活性 |
| 拔管:22~26 ha | ||||
| 阿哌沙班 | 穿刺/置管:72 h; | 6 h | 推荐:术后恢复首次口服用药前6 h拔除置管 | 抗Ⅹa因子活性 |
| 拔管:26~30 ha | ||||
| 艾多沙班 | 穿刺/置管:72 h; | 6 h | 推荐:术后恢复首次口服用药前6 h拔除置管 | 抗Ⅹa因子活性 |
| 拔管:20~28 h |
注:PLT为血小板计数;APTT为活化部分凝血活酶时间;ACT为激活凝血时间;INR为国际标准化比值;TT为凝血酶时间;a意外置管后,拔除置管前需停药时间,若需提前拔管需进行抗Ⅹa因子活性检测
需要指出的是,对于高出血风险区域阻滞操作,如果此类操作的患者获益大于风险,单独服用阿司匹林(无同时应用其他抗凝或抗血小板药物)不是禁忌。对于椎管内操作,单次蛛网膜下腔麻醉出血风险小于硬膜外麻醉。硬膜外导管和周围神经置管在置入和拔出时所致的出血风险一样,因而抗栓药物处理原则一致。同时,使用上述导管不应影响术后抗血栓药物的恢复用药。对于低出血风险区域阻滞操作,如果患者获益明显大于风险,可以考虑用于正在应用单或双抗血小板药物的患者。长期服用抗栓药物患者的神经阻滞操作推荐由有经验的麻醉医师在超声引导下实施,以利于减少出血和损伤风险[32]。
血栓弹力图(TEG)和旋转式血栓弹力测试仪(RoTEM)是一类全血床旁检测项目,主要用于检测止血块的形成、强度及纤溶全过程。临床用于出血患者目标导向性以及个体化输血的治疗中,目前已被推荐用于指导心脏手术中的出血管理。仅有几个病例报道将其用于高危出血风险患者行硬膜外阻滞前的评估[54,55],目前尚缺乏足够的临床证据将其常规应用于使用抗血栓药物患者能否行高危区域阻滞操作的评估[56],但可以考虑个性化处理。
【推荐意见】对于长期接受抗栓药物治疗的患者,区域阻滞麻醉的选择需要权衡患者出血风险与阻滞麻醉的获益;椎管内阻滞及深部神经阻滞是出血高风险操作;需要留置导管的阻滞操作,其置管与拔管具有相同的出血风险,对抗栓药物的停药与恢复要求一致,导管的应用不应影响术后抗栓药物的恢复;可以考虑将TEG/RoTEM用于高出血风险神经阻滞操作前检测,评估患者的出血风险;此类患者的神经阻滞操作推荐有经验的麻醉医师在超声引导下进行操作。
围手术期使用抗血栓药物的外科患者逐年增加,围手术期抗血栓药物的管理已成为一个重要的议题,而其围手术期管理策略的制定和执行则需要外科、麻醉科、内科医师共同进行多学科协作,以及患者的积极参与。术前需要充分评估患者的血栓栓塞风险、拟行手术或操作的出血风险以及患者自身出血风险,并根据患者所服用药物的特性最终确认是否停药、停药时机及桥接方案。需要指出的是,本文所述的抗凝桥接治疗仅针对患者术前服用抗血栓药物在围手术期所需的处理,若患者因手术原因术后长时间卧床,则需额外考虑是否需要给予抗凝治疗来预防深静脉血栓。此外对于胃肠道或其他大手术患者,术后因肠外营养治疗而无法实施推荐意见下的恢复口服药物治疗时,是否有其他替代药物的治疗也需进一步研究。
本共识制定专家组成员:
项目主持者:王东信(北京大学第一医院麻醉科);赵丽云(首都医科大学附属北京安贞医院麻醉中心);霍勇(北京大学第一医院心血管内科)
执笔者(按姓氏汉语拼音排序):龚艳君(北京大学第一医院心血管内科);蒋捷(北京大学第一医院心血管内科);刘冠伊(北京大学第一医院内镜中心);李怀瑾(北京大学第一医院麻醉科);孙葳(北京大学第一医院神经内科);王梓凝(北京大学第一医院药学部);向倩(北京大学第一医院药学部);杨敏(北京大学第一医院介入血管外科);虞巍(北京大学第一医院泌尿外科);于峥嵘(北京大学第一医院骨科);张鸿(北京大学第一医院麻醉科);赵虎(北京大学第一医院胸外科);张思宇(北京大学第一医院心脏外科);庄岩(北京大学第一医院普通外科)
专家组成员(按姓氏汉语拼音排序):艾艳秋(郑州大学第一附属医院麻醉科);曹永平(北京大学第一医院骨科);陈纪言(广东省人民医院心内科);陈韵岱(中国人民解放军总医院心内科);程晓曙(南昌大学第二附属医院心内科);崔一民(北京大学第一医院药学部);冯艺(北京大学人民医院麻醉科);葛均波(复旦大学中山医院心内科);何奔(上海交通大学附属胸科医院心内科);何志嵩(北京大学第一医院泌尿外科);康荣田(河北医科大学附属第二医院麻醉科);李简(北京大学第一医院胸外科);李悦(哈尔滨医科大学附属第一医院心内科);林箐(北京大学第一医院医务处);钱菊英(复旦大学中山医院心内科);戎龙(北京大学第一医院内镜中心);谭宏宇(北京大学肿瘤医院麻醉科);王古岩(首都医科大学附属北京同仁医院麻醉科);王进(北京大学第一医院心脏外科);王平(北京大学第一医院副院长);王文生(北京大学第一医院血液内科);向定成(中国人民解放军南部战区总医院心内科);徐铭军(首都医科大学附属北京妇产医院麻醉科);徐亚伟(上海市第十人民医院心内科);杨杰孚(北京医院心内科);伊志强(北京大学第一医院神经外科);杨尹默(北京大学第一医院普通外科);朱斌(北京大学国际医院麻醉科);赵平(中国医科大学附属盛京医院麻醉科);张析哲(赤峰市医院麻醉科)
孙璐(北京大学第一医院医务处);贾英雷(北京大学第一医院医务处)
所有作者均声明不存在利益冲突

























