
CT是诊断胃癌常用的影像学检查方法,具有高空间分辨率、无创等优势以及强大的图像后处理技术支持,可通过形态学特征、密度及强化方式等多角度阐述病情的变化,有助于诊断胃癌分化程度、病理类型、TNM分期以及评估化疗疗效等。本文就目前CT在胃癌诊断中的应用价值进行归纳总结,旨在提高临床对CT在该领域应用价值的认识水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是我国高发的消化系统恶性肿瘤,具有较高的死亡率。CT检查是诊断胃癌常用的影像学方法,基于其高空间分辨率、无创等优势和强大的图像后处理技术支持,可清楚显示病变本身、周围脏器情况、是否发生淋巴结转移及远处转移等,可术前评估肿瘤分化程度、病理类型,进行TNM分期,并预测预后,进而为临床提供有价值的诊断依据。
胃癌分化程度与肿瘤的生物学行为以及患者预后等方面密切相关,准确评估其分化程度有助于指导临床制定个体化治疗方案以及判断患者预后。胃癌病灶的CT强化方式及强化率与胃癌的分化程度存在一定的相关性,分层或不均匀强化者,组织分化多为低分化腺癌(图1,2),均匀强化者组织分化多见于高或中分化腺癌[1](图3, 4, 5, 6)。文献报道[2],高分化腺癌动脉期强化率(增强扫描与平扫CT值差值/肿瘤平扫CT值)≥0.5,实质期强化率≥1.0;中分化腺癌实质期强化率<1.0,动脉-实质期强化率(增强实质期与平扫CT值差值/动脉期与平扫CT值差值)<2.0;低分化腺癌实质期强化率≥1.0,动脉-实质期强化率≥2.0。需要指出的是,目前以CT增强特征预测胃癌分化程度的研究尚存在一定的分歧[3, 4],仍需对更多成像方法诸如灌注成像、能谱成像、影像组学等进一步研究。
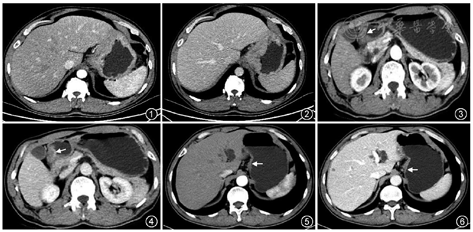

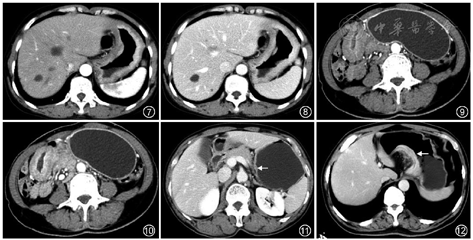
胃癌的组织学类型与患者的发病年龄、肿瘤部位、Borrmann分型、浆膜侵犯以及淋巴和远隔转移等,均是影响胃癌患者预后的主要因素[5]。CT对胃印戒细胞癌的诊断具有一定的帮助,胃印戒细胞癌多累及胃窦和胃底,累及全胃者较少,鲜有多发病灶;病灶多为肿块型和弥漫型;病灶强化模式多样,强化峰值多在静脉期,低强化区具有延迟强化的特点[6](图7,8)。Borrmann Ⅳ型胃癌在所有类型胃癌中预后最差,易发生腹膜播散转移[7],更倾向于分层强化的方式,自动脉期至平衡期,增厚的胃壁表现为由内向外的透壁性强化[8](图9,10)。对于更多病理类型的判断,目前CT存在一定的局限性,仍需更多的研究深入探讨。

CT成像不仅有助于明确病灶的位置、大小、形态、与周围器官的关系,还能进一步评估胃壁恶性病变的浸润程度,观察周围淋巴结转移情况及远处器官有无转移。
1.T分期:CT检查是术前评估胃癌T分期的常规手段,但胃壁组织学上的5层结构(黏膜层、黏膜肌层、黏膜下层、固有肌层、浆膜层)在CT图像中很难完整显示,尤其是对于早期胃癌的诊断和浆膜层侵犯的评估,因此胃癌CT评估T分期的准确率还有待提高[9]。近年来,关于T分期的CT征象研究取得了一定的进展,如通过“双轨征”诊断早期胃癌,其典型表现为胃壁稍增厚,黏膜层明显强化,胃壁外层稍高强化,中间呈条带状低密度(图11);浆膜面高强化线征(图12)是区分胃癌T3和T4a期的有效征象,该征象与浆膜面侵犯有关[10];断层时钟分区法,即在横断面和矢状面上将胃的周长分成12等份,11点~1点的区域认为是胃小弯,5点~7点为大弯,7点~11点是前壁,1点~5点是后壁,在明确定位的基础上有助于评估浆膜面侵犯[11]。以上研究结果使CT对胃癌T分期的诊断能力得到进一步提升和完善。
CT多以胃壁厚度和CT值为依据进行T分期诊断,需要注意的是,胃壁厚度的评估与胃腔充盈程度、胃壁的扩张等因素密切相关[12],因此CT扫描操作的规范化是准确诊断T分期的重要前提。另外,多平面重组技术在胃癌的分期诊断中具有重要的临床意义,通过结合横断面、冠状面和矢状面三个方位,能多角度观察肿块的形态,全面分析肿瘤的浸润程度[13],且对周围脏器的侵犯程度进行全面而深入的评估[14]。
2.N分期:胃癌有无淋巴结转移是选择手术方式的主要依据,且进展期胃癌转移淋巴结数量也是影响患者预后的重要因素。目前,对于CT评价胃癌N分期的争议较大,诊断准确率并不令人满意[9]。第8版国际抗癌联盟(Union for International Cancer Control,UICC)及美国癌症联合会(American Joint Committee on Cancer,AJCC)分期明确提出短径>10 mm的淋巴结为可疑转移淋巴结,而临床工作和既往研究中发现,短径<5 mm的转移淋巴结也占较大比例,这部分小的转移淋巴结在CT上难以分辨,故在胃癌N分期的评价中,仍需联合淋巴结大小、形态和数目进行综合评估[15],其评估标准还有待进一步探讨和总结。目前,对于能谱CT[16]和影像组学[17]的研究结果发现其对术前淋巴结转移的诊断具有一定的临床应用价值,因此以CT诊断为基础并结合功能CT或组学方法的研究可能为评估CT胃癌N分期提供具有潜力的新方向。
3.M分期:胃癌最常见的远处转移位置是腹膜和肝脏,在第8版UICC/AJCC分期中远隔淋巴结转移也被定为M1期。CT在评价胃癌远处转移M分期方面较为可靠,灵敏度较高,胸部、腹部及盆腔CT可作为评估胃癌转移的常规项目。腹腔内的微小种植转移和腹膜种植转移的检出是CT评估的难点,对于无腹腔积液、无明显结节转移灶的种植转移,CT的检出率还不满意,仅为30.0%~62.5%。最近研究显示,CT为基础的影像组学列线图在隐匿性腹膜转移中具有更高的诊断价值[18],因此对于高度怀疑腹膜转移者,除腹腔镜检查确定外,CT影像组学方法也可作为临床诊断的辅助工具以进行无创术前评估。
随着个体化精准医疗的不断发展,进展期胃癌患者越来越多地采用新辅助化疗。目前,进展期胃癌的新辅助化疗疗效评价主要依据患者的症状、体征以及肿瘤体积、径线变化等影像学资料等进行综合判断。CT检查可以从形态学、肿瘤密度等多角度描述病情的变化,同时利用多平面重组技术全面地了解肿瘤的情况,对疗效进行评估。目前对新辅助化疗评估方面多采用的是世界卫生组织或实体肿瘤的疗效评估标准1.1版(response evaluation criteria in solid tumors 1.1,RECIST1.1)评价标准,通过TNM分期改变情况以及肿瘤最长径变化来判定。然而胃是空腔脏器,随着胃的蠕动,肿瘤最长径也会随之变化,且化疗后部分肿瘤因强化程度减低、瘤周水肿及纤维化等原因,导致肿瘤与邻近正常胃壁分界不清,对明确界定肿瘤范围带来一定困难,造成肿瘤的最长径测量误差增大。Hallinan等[19]研究表明胃癌体积测量法是可行的,具有良好的可重复性。赵群等[20]研究发现,新辅助化疗后肿瘤体积减少率与基于RECIST 1.1疗效评估结果呈正相关,提示肿瘤体积减少率预测新辅助化疗疗效具有较好的效果,具有一定的可行性。
综上所述,CT不仅能显示肿瘤本身的情况,更重要的是可显示周围脏器情况、肿瘤与周围脏器关系以及是否有淋巴结、远处转移。结合形态学、肿瘤密度、强化方式等方面综合阐述病情的变化,可在术前提供更多的诊断信息,在胃癌分化程度、病理分型、TNM分期以及疗效评估等方面发挥重要的作用,具有重要的临床价值。
中华医学会放射学分会腹部学组对本栏目给予大力支持
所有作者均声明不存在利益冲突
单选题
1.下列关于胃印戒细胞癌的描述,错误的是()
A.多累及胃窦和胃底
B.累及全胃较少
C.病灶多为肿块型和弥漫型
D.一般为多发病灶
E.病灶强化模式多样
2.关于胃癌的描述,下列说法错误的是()
A.胃癌是我国高发的消化系统恶性肿瘤,具有较高的死亡率
B.CT对进展期胃癌可进行分期
C.胃癌病灶的CT强化方式及强化率与胃癌的分化程度存在一定的相关性
D.Borrmann Ⅳ型胃癌在所有类型胃癌中预后较好
E.CT检查是术前评估胃癌T分期的常规手段
3. 第8版UICC/AJCC分期明确提出淋巴结短径>( )作为可疑转移考虑
A.1 mm B.5 mm C.10 mm D.15 mm E.20 mm
4. 胃壁在组织学上可分为5层,由内向外依次是()
A.黏膜肌层、黏膜层、黏膜下层、固有肌层、浆膜层
B.黏膜层、黏膜下层、黏膜肌层、浆膜层、固有肌层
C.黏膜层、黏膜肌层、黏膜下层、固有肌层、浆膜层
D.黏膜层、黏膜肌层、黏膜下层、浆膜层、固有肌层
E.黏膜层、黏膜下层、黏膜肌层、固有肌层、浆膜层
5. 胃癌最常见的远处转移位置是()
A.腹膜、盆腔
B.肝脏、骨
C.腹膜、肝脏
D.肝脏、肺
E.肺、骨



























