
分析炎症性肠病(IBD)人群中,NUDT15基因多态性与硫唑嘌呤(AZA)导致骨髓抑制不良反应的相关性,为IBD临床治疗提供参考。
通过计算机检索中国知网、万方、维普数据库、PubMed、Cochrane图书馆和Web of Science,筛选NUDT15基因突变与AZA治疗IBD的随机对照试验文献,并对符合纳入标准的研究进行质量评价和资料提取,进行Meta分析。
纳入10篇文献,共3095例患者。Meta分析显示,亚洲IBD人群中NUDT15基因突变率明显高于TPMT基因突变率(21.5%比2.8%,OR = 0.10,95%CI:0.07 ~ 0.15,P<0.001),差异具有统计学意义;NUDT15基因突变与AZA相关的白细胞减少具有显著相关性(OR = 0.40,95%CI:0.34 ~ 0.47,P<0.001);NUDT15突变的IBD患者更易在应用AZA的早期出现白细胞减少(OR = 2.69,95%CI:1.67 ~ 4.33,P<0.001);同时NUDT15基因纯合突变型(TT型)更易出现Ⅲ~Ⅳ级的骨髓抑制(OR = 0.09,95%CI:0.04 ~ 0.18,P<0.001)。
亚洲IBD人群中,AZA引起的骨髓抑制与NUDT15基因突变具有显著相关性,较TPMT基因突变关系更为密切,并多发生于应用AZA的8周内。同时,NUDT15基因TT纯合突变会增加重度骨髓抑制的风险。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是慢性非特异性肠道炎性疾病,目前治疗目标是诱导临床缓解和达到内镜下黏膜愈合、防治并发症[1]。研究表明硫唑嘌呤(azathioprine,AZA)可减少克罗恩病(Crohn′s disease,CD)患者的住院率和手术率,可用于诱导和维持缓解治疗,也常与生物制剂联合应用治疗中重度IBD[1,2]。但30% ~ 40%的IBD患者因AZA的不良反应而减量甚至停用,最常见的不良反应为白细胞减少[3]。目前研究已证实硫嘌呤S-甲基转移酶(TPMT)基因多态性突变与AZA活性密切相关。低活性TPMT导致6-硫鸟嘌呤核苷酸(6-TGN)血药浓度升高,增加临床应答同时也提高了骨髓抑制的风险。近年研究发现NUDT15基因突变与AZA引起白细胞减少密切相关[4,5,6]。本研究分析AZA治疗IBD患者引起白细胞减少与NUDT15基因突变的关系。
检索中国知网、万方、维普数据库、PubMed、Cochrane图书馆、Web of Science,检索时间均为各数据库建库至2019年5月,检索文献语种限定为中文和英文。中文检索词为"NUDT15"、"炎症性肠病"、"硫唑嘌呤"、"白细胞减少";英文检索词为"NUDT15"、"inflammatory bowel disease"、"azathioprine"、"leukocytopenia"。
纳入标准:(1)研究类型:随机对照研究或队列研究;(2)研究目的:国内外公开发表的NUDT15基因突变与AZA治疗IBD引起的白细胞减少不良反应关系的研究;(3)研究对象:确诊的IBD患者(包括溃疡性结肠炎、CD、未定型IBD),性别不限,年龄>14岁;(4)干预措施:患者均接受AZA治疗,并且行基因检测(NUDT15和TPMT);(5)结局:外周血中白细胞减少(白细胞<4.0 × 109/L)。
排除标准:(1)会议、摘要、综述、病例个案报道;(2)研究数据不全或研究样本量<30;(3)非相关研究、重复筛选记录或重复研究。
两位研究者严格按照以上纳入和排除标准筛选获得的相关文献和提取有关数据,意见不统一时通过协商解决。文献主要提取内容包括(1)一般资料:文献第一作者、发表年限、研究人群国籍、纳入样本量、疾病类型、病例组和对照组人数;(2)评价指标:白细胞减少的标准、早晚期白细胞减少人数、各级白细胞减少人数、NUDT15突变基因型人数;其中早期白细胞减少定义为开始服用AZA 8周内发生白细胞减少症,晚期白细胞减少则为白细胞减少发生于超过8周的AZA治疗[7];根据WHO骨髓抑制分级标准:Ⅲ级骨髓抑制是指外周血白细胞<2.0 × 109/L,中性粒细胞(N)<1.0×109/L,Ⅳ级骨髓抑制是指外周血白细胞<1.0 × 109/L,N<0.5 × 109/L。
根据纽卡斯尔-渥太华量表(NOS)进行质量评价,两位研究者根据NOS统一评分≥6分为高质量研究纳入。
采用RevMan 5.3统计软件进行系统评价分析。首先进行异质性分析,I2>50%提示存在明显异质性,若P<0.05,各研究结果存在实质异质性,采用随机效应模型分析;若P≥ 0.05,各研究结果无明显异质性,则采用固定效应模型分析;其余同质性较好(I2<50%)均采用固定效应模型分析。NUDT15突变与AZA引起IBD患者白细胞减少的关系,计算得到相对危险度(odd ratio,OR)和95%置信区间(CI)表示效应量,以P<0.05为差异具有统计学差异。
通过检索各数据库共获得相关文献81篇,符合本研究标准的文献10篇[4,5,6,8,9,10,11,12,13,14],文献筛查流程见图1。纳入文献均为随机对照研究或队列研究,1篇为前瞻性研究,9篇为回顾性研究。文献研究目的均为亚洲人中NUDT15基因突变与AZA治疗IBD引起的白细胞减少不良反应关系。共纳入3095例IBD患者,其中病例组668例、对照组2427例。各研究人群均为确诊的亚洲IBD患者,AZA治疗大于≥2个月、检测NUDT15和TPMT基因,定期复查血常规。根据NOS各项研究的质量评分均>6分,纳入文献基本特征见表1。
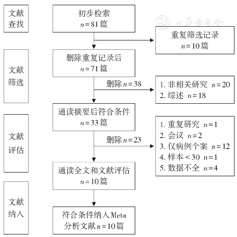

纳入文献基本特征
纳入文献基本特征
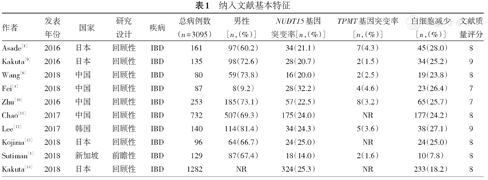
| 作者 | 发表年份 | 国家 | 研究设计 | 疾病 | 总病例数(n = 3095) | 男性[n,(%)] | NUDT15基因突变率[n,(%)] | TPMT基因突变率[n,(%)] | 白细胞减少[n,(%)] | 文献质量评分 |
|---|---|---|---|---|---|---|---|---|---|---|
| Asade[8] | 2016 | 日本 | 回顾性 | IBD | 161 | 97(60.2) | 34(21.1) | 7(4.3) | 45(28.0) | 8 |
| Kakuta[9] | 2016 | 日本 | 回顾性 | IBD | 135 | 98(72.6) | 28(20.7) | 2(1.5) | 34(25.2) | 9 |
| Wang[6] | 2018 | 中国 | 回顾性 | IBD | 80 | 59(73.8) | 16(20.0) | 2(2.5) | 19(23.8) | 8 |
| Fei[4] | 2018 | 中国 | 回顾性 | IBD | 87 | 8(9.2) | 28(32.2) | 4(4.6) | 23(26.4) | 7 |
| Zhu[10] | 2016 | 中国 | 回顾性 | IBD | 253 | 185(73.1) | 57(22.5) | 8(3.2) | 65(25.7) | 7 |
| Chao[11] | 2017 | 中国 | 回顾性 | IBD | 732 | 507(69.3) | 175(24.0) | NR | 177(24.2) | 8 |
| Lee[12] | 2017 | 韩国 | 回顾性 | IBD | 140 | 114(81.4) | 34(24.3) | 5(3.6) | 38(27.1) | 9 |
| Kojima[13] | 2018 | 日本 | 回顾性 | IBD | 96 | 64(66.7) | 24(25.0) | NR | 24(25.0) | 8 |
| Sutiman[5] | 2018 | 新加坡 | 前瞻性 | IBD | 129 | 87(67.4) | 18(14.0) | 2(1.6) | 10(7.8) | 8 |
| Kakuta[14] | 2018 | 日本 | 回顾性 | IBD | 1282 | NR | 324(25.3) | NR | 233(18.2) | 8 |
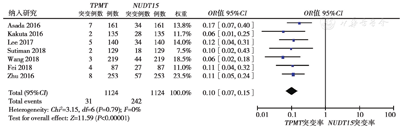
7篇文献[4,5,6,8,9,10,12]分析了亚洲IBD患者TPMT、NUDT15基因突变率的差异,共纳入1124例患者。各研究间异质性低(P = 0.79,I2 = 0%),采用固定效应模型分析显示,亚洲IBD人群NUDT15基因突变明显高于TPMT基因突变率(21.5%比2.8%,OR = 0.10,95%CI:0.07 ~ 0.15,P<0.001),差异具有统计学意义,见图2。

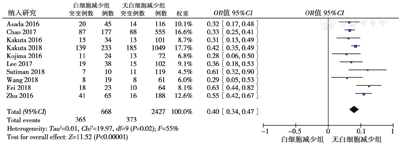
10篇文献[4,5,6,8,9,10,11,12,13,14]纳入3095例患者分析了在IBD患者中AZA相关的外周血白细胞变化与NUDT15基因突变率的差异,各研究间显示存在明显异质性(P = 0.02,I2 = 55%),采用随机效应模型分析结果显示,白细胞减少组的NUDT15突变率高于白细胞正常组(54.6%比15.4%,OR = 0.40,95%CI:0.34 ~ 0.47,P<0.001),差异有统计学意义,提示NUDT15基因突变与AZA相关的白细胞减少具有显著相关性,见图3。

5篇文献[4,8,9,10,11]分析NUDT15等位基因突变与白细胞减少发生的时间关系,共纳入344例患者。各研究显示异质性低(P = 0.31,I2 = 16%),采用固定效应模型分析结果显示,早期白细胞减少症患者NUDT15基因突变率高于晚期白细胞减少症(68.7%比41.9%,OR = 2.69,95%CI:1.67 ~ 4.33,P<0.001),表明NUDT15突变的患者更易在服用AZA的8周内发生白细胞减少,见图4。
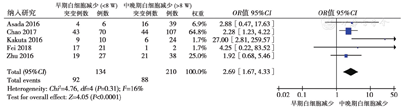

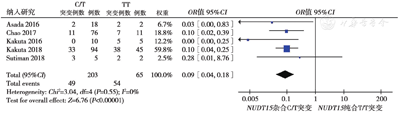
5篇文献[5,8,9,11,14]分析了NUDT15基因型与Ⅲ~Ⅳ级骨髓抑制的相关性,共纳入268例患者。各研究间异质性低(P = 0.55,I2 = 0%),采用固定效应模型分析,在Ⅲ~Ⅳ级骨髓抑制患者中,NUDT15基因型C/T占比低于TT型(24.1%比83.1%,OR = 0.09,95%CI:0.04 ~ 0.18,P<0.001),差异有统计学意义,表明NUDT15基因纯合突变(TT型)更易引起Ⅲ~Ⅳ级的骨髓抑制,见图5。

本研究通过Meta分析AZA治疗亚洲IBD患者引起的白细胞减少与NUDT15基因突变的相关性,结果发现在亚洲IBD人群中,NUDT15基因的高突变率大大增加了AZA引起的骨髓抑制风险。因此,亚洲IBD人群的NUDT15基因突变检测是个值得关注的问题。
AZA作为治疗IBD的主要药物之一,经体内代谢后生成具有药理作用的6-TGN。6-TGN通过一系列酶促反应,生成6-硫鸟嘌呤三磷酸(6-TdGTP),最终还原为6-硫基鸟苷三磷酸(6-TGTP),6-TGTP整合至双链DNA(DNA-TG)上,触发其无效错配修复从而诱导免疫细胞凋亡,发挥AZA的免疫抑制特性和细胞毒性[2,4,5,6]。
近年研究发现TPMT基因多态性与AZA相关的白细胞减少密切相关,特别是TPMT3C基因突变,不能有效地将部分AZA催化为非活性物质,从而导致体内6-TGN水平过高引起骨髓抑制风险增加。但在亚洲地区,TPMT基因突变率仅为1% ~ 3%,相关数据却显示23% ~ 35%的IBD患者出现AZA相关的骨髓抑制[3]。提示在亚洲人群中可能受到其他基因突变的影响。
NUDT15基因主要由焦磷酸水解酶组成,是属于Nudix水解酶家族成员。2014年Yang等[3]首次指出NUDT15R139C突变与AZA治疗CD患者导致白细胞下降明显相关。NUDT15R139C是NUDT15基因里一个非同义SNP编码p.Arg139Cys的等位基因,韩国的NUDT15R139C基因突变率为10.4%、日本为7%、中国为13%,而美国仅为2%,其突变率在亚洲人群中明显高于美国人群[6]。另有研究指出亚洲地区NUDT15基因突变率高达20.1%[11]。本研究结果显示亚洲人群中NUDT15基因突变率(21.5%)明显高于TPMT突变率(2.8%)。
Kakuta等[9]证实在日本IBD队列中,NUDT15突变与白细胞减少明显相关,认为NUDT15作用机制与6-TGN浓度无显著相关性。NUDT15可能作用于核苷二磷酸酯,水解6-TGN的代谢产物6-TdGTP和6-TGTP,将6-TGTP转化成6-TGMP,从而使AZA代谢产物6-TGN不能整合至DNA,导致DNA-TG减少,从而负向调节AZA的药物活性及细胞毒性[8]。Moriyama等[15]通过敲除人类淋巴细胞中NUDT15R139C基因,发现基因敲除组6-TGTP及DNA-TG明显升高,NUDT15基因突变明显增加AZA对细胞的毒性。本研究发现NUDT15突变的亚洲IBD人群,更易发生AZA使用后的白细胞减少症。
本研究还进一步发现NUDT15基因突变与早期白细胞减少明显相关。同时NUDT15基因纯合突变更易引起严重白细胞下降。Lee[12]等也指出NUDT15基因突变对早期白细胞减少(特别4周内)的预测值可达88.2%(84% ~ 94%)。在治疗AZA期间,常见于8周内发生白细胞减少,之后应用AZA发生白细胞减少的频率及程度有所降低。建议在AZA治疗期间应密切监测血常规,对早期白细胞有下降趋势的也应警惕骨髓抑制的发生[13,16]。当早期发生白细胞减少时,应立即停用AZA,给予提升白细胞治疗,待指标正常后可酌情小剂量使用。
本研究存在一定的局限性:(1)纳入的文献大部分为回顾性研究,回顾性偏倚不可避免,观察性研究也存在数据选择偏倚;(2)各文献均有其他药物治疗IBD可能影响骨髓抑制,无法用亚组分析排除其他药物和因素影响;(3)纳入患者为亚洲人群,但每个国家人群数量不均,部分样本量不足,可能对数据造成一定的影响,相关的准确机制有待深入研究。
综上所述,在亚洲人群中,NUDT15基因突变与AZA治疗IBD引起的白细胞减少密切相关,检测NUDT15基因多态性和6-TGTP活性,能够评估AZA引起的白细胞减少风险,并早期评估骨髓抑制的程度。因此在IBD患者使用AZA治疗前,可将NUDT15基因分型检测应用于亚洲人群的白细胞减少症。
所有作者均声明不存在利益冲突



























