
探讨极早产儿支气管肺发育不良(bronchopulmonary dysplasia,BPD)相关性肺动脉高压(pulmonary hypertension,PH)的临床特点及危险因素。
选择2016年1月至2018年12月上海市儿童医院新生儿重症监护病房收治的胎龄<32周且符合BPD诊断标准的早产儿进行回顾性分析。根据生后28 d后多普勒心脏彩超检查是否存在PH分为PH组和非PH组。分析两组早产儿的基本资料、母亲妊娠期情况、多普勒心脏彩超检查结果、并发症、治疗措施、住院天数等指标。
共纳入BPD早产儿86例,其中PH组18例,非PH组68例。PH组胎龄、出生体重低于非PH组[(28.0±1.2)周比(28.8±1.5)周,975(875,1 151)g比1 172(954,1 374)g],重度BPD比例及母亲年龄≥35岁比例高于非PH组[44.4%(8/18)比16.2%(11/68),44.4%(8/18)比13.2%(9/68)],差异有统计学意义(P<0.05)。PH组早产儿室间隔缺损、存在早发性PH比例高于非PH组[11.1%(2/18)比1.5%(1/68),77.8%(14/18)比51.5%(35/68)],呼吸机使用天数、用氧天数、住院天数均长于非PH组[58.5(42.0,74.0)d比39.0(30.0,51.8)d,62.0(42.8,82.5)d比45.5(38.3,57.5)d,(79.2±16.5)d比(67.9±18.9)d],差异有统计学意义(P<0.05)。Logistic回归分析显示,呼吸机使用天数、用氧天数及母亲年龄≥35岁是BPD极早产儿发生PH的独立危险因素(P<0.05)。
BPD相关性PH极早产儿具有胎龄小、出生体重低、BPD程度重、母亲年龄≥35岁、合并室间隔缺损、早发性PH以及呼吸机使用天数和用氧天数显著延长的临床特点。呼吸机使用天数和用氧天数长、母亲年龄≥35岁是极早产儿BPD相关性PH的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着围生医学迅速发展,极低出生体重儿(very low birth weight infant,VLBWI)和超低出生体重儿(extremely low birth weight infant,ELBWI)存活率明显上升,BPD发病率也随之升高,严重影响早产儿存活率及生存质量[1,2]。新型BPD主要发生于出生体重<1 000 g、胎龄<26周的极不成熟早产儿,胎龄<32周BPD早产儿肺组织病理改变的主要特征为结构简单、肺泡发育受阻、肺血管床减少、肺泡及肺血管生长受限,使得气体交换障碍,肺血管收缩反应增强、肺血管重塑,从而导致肺动脉高压(pulmonary hypertension,PH)形成。目前BPD相关性PH的发病机制尚不完全清楚,但其中一个重要特点为参与调节肺动脉压力的信息物质一氧化氮(nitric oxide,NO)生成减少。孕后期一氧化氮合酶活性增高,NO生成增多,当早产或缺氧时一氧化氮合酶表达降低,NO生成减少,从而减弱了NO介导的信号通路对肺血管平滑肌细胞的松弛作用[3]。PH是包括BPD在内的早产儿慢性呼吸系统疾病的常见并发症[4],发病率随着早产儿胎龄和出生体重的降低而增加。国外研究显示低出生胎龄、低出生体重、羊水过少、长期机械通气以及氧依赖为BPD相关性PH的危险因素[5],17%~24%的BPD患儿存在PH[6,7],重度BPD早产儿更易发生PH[4]。国内新生儿医师对于BPD相关性PH的认识水平差异较大。本研究通过系统回顾BPD早产儿的临床资料,探讨BPD相关性PH极早产儿的临床特点,为早发现、早干预提供依据。
选择2016年1月至2018年12月上海市儿童医院新生儿重症监护病房(neonatal intensive care unit,NICU)收治的BPD极早产儿进行回顾性分析。入选标准:(1)胎龄<32周;(2)入院日龄<3 d;(3)符合BPD诊断标准,即任何氧依赖[吸入氧浓度(fraction of inspire O2,FiO2)>21%]≥28 d[8]。排除由于先天性心脏病或其他解剖结构异常(例如膈疝或者胸廓畸形)导致PH、经历严重感染、感染性休克,以及缺少生后14 d内和28 d后心脏彩超检查结果等资料不完整的病例。BPD临床分度标准:根据校正胎龄36周或出院时所需氧浓度进行分度,(1)轻度:未用氧;(2)中度:FiO2<30%;(3)重度:FiO2≥30%或需要机械通气[8]。根据生后28 d后多普勒心脏彩超结果是否存在PH分为PH组和非PH组。本研究通过上海市儿童医院伦理委员会审查(LLSC2015006)。
(1)肺动脉收缩压(pulmonary artery systolic blood pressure,sPAP)>35 mmHg或>2/3体循环收缩压;或(2)存在动脉导管水平或心房水平的右向左分流[8]。当心脏彩超检查无法通过探测三尖瓣反流评估肺动脉压时,可以通过心脏收缩末期室间隔位置和形状评判:室间隔呈圆形为正常或轻度PH,室间隔扁平状为中度PH,室间隔凸向左心室为重度PH[9]。根据相关研究报道,将BPD早产儿生后14 d内发生的PH定义为早发性PH;生后至少28 d(校正胎龄36周后或出院前)发生的PH定义为晚发性PH[10]。
在住院系统中收集两组早产儿病例资料,包括:(1)早产儿一般情况:性别、胎龄、出生体重、出生身长、Apgar评分、BPD分度。(2)母亲妊娠期情况:母亲年龄、分娩方式、是否合并妊娠期糖尿病、妊娠期高血压、胎盘早剥、胎膜早破>18 h。(3)多普勒心脏彩超检查结果:房间隔缺损、动脉导管未闭、卵圆孔未闭、室间隔缺损。(4)疾病情况:早发性PH、新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、贫血、电解质紊乱、酸碱失衡、颅内出血、败血症。(5)治疗情况:肺表面活性物质、机械通气时间、用氧时间、住院天数。
应用SPSS 27.0统计软件进行数据分析。符合正态分布的计量资料以 ±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验;根据单因素统计学分析的结果,将有意义的变量进行Logistic回归分析,筛选BPD相关性PH的独立危险因素。P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验;根据单因素统计学分析的结果,将有意义的变量进行Logistic回归分析,筛选BPD相关性PH的独立危险因素。P<0.05为差异有统计学意义。
研究期间符合入选标准的BPD早产儿124例,因病例资料不完整排除38例,最终纳入86例,其中PH组18例,非PH组68例。PH组胎龄、出生体重小于非PH组,重度BPD比例高于非PH组,差异有统计学意义(P<0.05);两组性别、身长、5 min Apgar评分比较,差异均无统计学意义(P>0.05)。见表1。
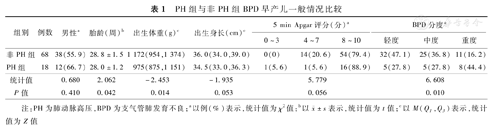
PH组与非PH组BPD早产儿一般情况比较
PH组与非PH组BPD早产儿一般情况比较
| 组别 | 例数 | 男性a | 胎龄(周)b | 出生体重(g)c | 出生身长(cm)c | 5 min Apgar评分(分)a | BPD分度a | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 0~3 | 4~7 | 8~10 | 轻度 | 中度 | 重度 | ||||||
| 非PH组 | 68 | 38(55.9) | 28.8±1.5 | 1 172(954,1 374) | 36.0(34.0,39.0) | 0(0) | 14(20.6) | 54(79.4) | 32(47.1) | 25(36.8) | 11(16.2) |
| PH组 | 18 | 12(66.7) | 28.0±1.2 | 975(875,1 151) | 34.5(33.0,36.3) | 1(5.6) | 1(5.6) | 16(88.9) | 5(27.8) | 5(27.8) | 8(44.4) |
| 统计值 | 0.680 | 2.062 | -2.453 | -1.935 | 5.779 | 6.608 | |||||
| P值 | 0.410 | 0.042 | 0.014 | 0.053 | 0.056 | 0.010 | |||||
注:PH为肺动脉高压,BPD为支气管肺发育不良;a以例(%)表示,统计值为χ2值;b以 ±s表示,统计值为t值;c以M(Q1,Q3)表示,统计值为Z值
±s表示,统计值为t值;c以M(Q1,Q3)表示,统计值为Z值
PH组母亲年龄≥35岁比例高于非PH组,差异有统计学意义(P<0.05),Logistic回归分析提示母亲年龄≥35岁是BPD早产儿发生PH的独立危险因素(OR=4.629,95%CI 1.314~16.307,P=0.017)。两组分娩方式、母亲妊娠期高血压、妊娠期糖尿病、胎盘早剥、胎膜早破>18 h比例等比较,差异均无统计学意义(P>0.05)。见表2。
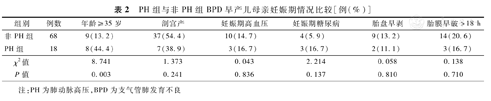
PH组与非PH组BPD早产儿母亲妊娠期情况比较[例(%)]
PH组与非PH组BPD早产儿母亲妊娠期情况比较[例(%)]
| 组别 | 例数 | 年龄≥35岁 | 剖宫产 | 妊娠期高血压 | 妊娠期糖尿病 | 胎盘早剥 | 胎膜早破>18 h |
|---|---|---|---|---|---|---|---|
| 非PH组 | 68 | 9(13.2) | 37(54.4) | 10(14.7) | 4(5.9) | 9(13.2) | 14(20.6) |
| PH组 | 18 | 8(44.4) | 7(38.9) | 3(16.7) | 3(16.7) | 2(11.1) | 3(16.7) |
| χ2值 | 8.741 | 1.373 | 0.043 | 2.214 | 0.058 | 0.138 | |
| P值 | 0.003 | 0.241 | 0.836 | 0.137 | 0.810 | 0.710 |
注:PH为肺动脉高压,BPD为支气管肺发育不良
PH组早产儿室间隔缺损比例高于非PH组,差异有统计学意义(P<0.05);两组动脉导管未闭、卵圆孔未闭、房间隔缺损比例比较,差异均无统计学意义(P>0.05)。见表3。
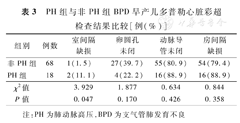
PH组与非PH组BPD早产儿多普勒心脏彩超检查结果比较[例(%)]
PH组与非PH组BPD早产儿多普勒心脏彩超检查结果比较[例(%)]
| 组别 | 例数 | 室间隔缺损 | 卵圆孔未闭 | 动脉导管未闭 | 房间隔缺损 |
|---|---|---|---|---|---|
| 非PH组 | 68 | 1(1.5) | 27(39.7) | 55(80.9) | 54(79.4) |
| PH组 | 18 | 2(11.1) | 4(22.2) | 16(88.9) | 16(88.9) |
| χ2值 | 3.929 | 1.877 | 0.634 | 0.844 | |
| P值 | 0.047 | 0.170 | 0.426 | 0.358 |
注:PH为肺动脉高压,BPD为支气管肺发育不良
本研究中存在早发性PH的早产儿共49例,其中非PH组35例[51.5%(35/68)],PH组14例[77.8%(14/18)],PH组存在早发性PH比例高于非PH组,差异有统计学意义(P<0.05)。两组发生RDS、NEC、贫血、电解质紊乱、酸碱失衡、颅内出血、败血症等比例比较,差异均无统计学意义(P>0.05)。
PH组早产儿呼吸机使用天数、用氧天数、住院天数长于非PH组,差异有统计学意义(P<0.05);两组PS使用率差异无统计学意义(P>0.05),见表4。Logistic回归分析显示,呼吸机使用天数、用氧天数是BPD早产儿发生PH的独立危险因素,详见表5。

PH组与非PH组BPD早产儿治疗情况比较
PH组与非PH组BPD早产儿治疗情况比较
| 组别 | 例数 | 呼吸机使用天数(d)a | PS使用b | 用氧天数(d)a | 住院天数(d)c |
|---|---|---|---|---|---|
| 非PH组 | 68 | 39.0(30.0,51.8) | 56(82.4) | 45.5(38.3,57.5) | 67.9±18.9 |
| PH组 | 18 | 58.5(42.0,74.0) | 17(94.4) | 62.0(42.8,82.5) | 79.2±16.5 |
| 统计值 | -2.867 | 1.622 | -2.714 | -2.307 | |
| P值 | 0.004 | 0.203 | 0.007 | 0.024 |
注:PH为肺动脉高压,BPD为支气管肺发育不良,PS为肺表面活性物质;a以M(Q1,Q3)表示,统计值为Z值;b以例(%)表示,统计值为χ2值;c以 ±s表示,统计值为t值
±s表示,统计值为t值
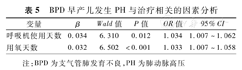
BPD早产儿发生PH与治疗相关的因素分析
BPD早产儿发生PH与治疗相关的因素分析
| 变量 | β | Wald值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|
| 呼吸机使用天数 | 0.034 | 6.310 | 0.012 | 1.034 | 1.007~1.062 |
| 用氧天数 | 0.032 | 6.502 | <0.001 | 1.033 | 1.007~1.058 |
注:BPD为支气管肺发育不良,PH为肺动脉高压
新型BPD发病率逐年增加,成为导致早产儿死亡的原因之一。新型BPD的主要病理表现为肺泡数目减少及肺血管发育不良,引起气体交换障碍、肺血管收缩反应增强及肺血管重塑,最终导致PH[11]。因此,积极探讨BPD相关性PH的危险因素,对于提高患儿生存率及远期生存质量尤为重要。
本研究中PH组早产儿胎龄和出生体重明显减小,与Check等[12]、Mourani等[13]研究结论一致。一方面,本研究所纳入的早产儿胎龄<32周,此时肺发育仅处于囊泡期,肺泡结构尚未形成,对呼吸支持的依赖性大,肺组织在体外的发育受到外界刺激,易引起肺部炎症反应,导致肺血管发育不良,进一步导致PH;另一方面,胎龄<32周的早产儿一氧化氮合酶活性降低,NO生成减少,肺血管舒张作用减弱。本研究中PH组早产儿重度BPD比例高,与国外众多研究结果一致[12,14,15,16]。重度BPD早产儿常存在严重肺发育障碍,长期机械通气诱发肺部炎症反应,加重肺泡上皮细胞及毛细血管内皮细胞损伤,从而导致PH。本研究中,两组早产儿在性别、Apgar评分方面差异无统计学意义,与国外Bhat等[14]研究结果相符。
研究显示,高龄产妇分娩的早产儿出生体重低于同胎龄新生儿[17,18]。本研究中,PH组早产儿母亲年龄≥35岁比例显著增加。这与高龄产妇多存在器官机能减退、血管弹性下降,更易引起胎儿宫内窘迫及早产,使胎肺发育阻滞相关。两组早产儿母亲孕期是否合并妊娠期糖尿病、胎盘早剥、胎膜早破>18 h及分娩方式差异均无统计学意义,这与国内王瑜等[19]对于BPD相关性PH预测因素的研究结果一致。
PH组早产儿存在早发性PH的比例显著增高,提示存在早发性PH的BPD早产儿更易发生BPD相关性PH。新生儿在生后2周左右完成从胎儿循环向成人循环的转变。若未能有效实现转变,则导致肺循环受阻、肺动脉压力升高,从而影响肺泡及肺血管发育。Kim等[20]建议对中重度BPD早产儿每月常规行超声心动图检查,以明确是否存在PH。
本研究结果显示,PH组BPD早产儿存在室间隔缺损比例较高。有文献表明,当室间隔缺损发生左向右分流时,右心室收缩期阻力增加,长期肺循环血流量增多导致PH[21]。需要注意的是,目前早发性PH、室间隔缺损与BPD相关性PH的关系尚无定论,仍需大样本、多中心、前瞻性的临床研究。本研究中,PH组和非PH组病例在动脉导管未闭、房间隔缺损、卵圆孔未闭方面差异无统计学意义,这与Bhat等[14]对BPD相关性PH早产儿临床特点的研究结论一致。两组在是否合并NEC、RDS、贫血、酸碱失衡、电解质紊乱、颅内出血、败血症等方面差异无统计学意义,这与国外Kim[20]、Check等[12]研究结果一致。
在治疗措施方面,PH组早产儿呼吸机使用天数、用氧天数显著增加,这与国外研究结果一致[12,15]。肺发育不成熟是导致BPD的根本原因。在BPD的治疗措施中,呼吸支持是重要手段。有研究表明,机械通气时间与BPD严重程度相关[19]。重度BPD早产儿肺发育极不成熟,未成熟肺组织接受呼吸机治疗的过程中会出现肺部炎症反应,毛细血管内皮细胞、基底膜损伤,血管重塑,肺动脉压力增高。因此,对于早产儿应采用保护性通气策略,尽量减少机械通气造成的损伤。对于接受气管插管的BPD早产儿争取做到早拔管。此外,两组早产儿PS使用率差异无统计学意义,与国外对于BPD相关性PH的meta分析[5]结果不同,这与本研究所纳入病例胎龄较小,入院时多因存在RDS接受PS促胎肺成熟有关。本研究中,PH组早产儿住院天数显著增加,与国外对于BPD相关性PH治疗及预后的研究结果一致[12,14,16,22,23]。这意味着BPD相关性PH早产儿需要更长时间的住院监护治疗,给家庭带来沉重经济负担。
综上,BPD相关性PH极早产儿具有低胎龄、低出生体重、存在室间隔缺损、BPD程度重的临床特点。早产儿机械通气时间、用氧时间延长增加BPD相关性PH的发生率。BPD相关性PH患儿住院天数显著延长,可能会影响病死率及远期呼吸系统疾病发生率。早发性PH与BPD相关性PH具有一定联系,动态监测BPD早产儿多普勒心脏彩超尤为重要。此外,避免高龄妊娠可能对降低BPD相关性PH的发生有益。但是本研究为单中心的回顾性临床研究,仅分析了上海市儿童医院NICU 3年中收治的BPD早产儿临床资料,样本量有限,后续有条件应进行多中心、大样本的前瞻性研究。
所有作者均声明不存在利益冲突



























