
研究耐药铜绿假单胞菌临床分离株β-内酰胺酶基因的携带状况,及其对β-内酰胺类抗菌药物耐药性的作用。
收集2018年3月至2019年5月浙江省杭州市和宁波市两个地区6所医院住院患者首次发现感染时临床分离的98株耐药铜绿假单胞菌,其中宁波地区39株,杭州地区59株。所有菌株采用琼脂稀释法对14种抗菌药物进行敏感性试验,采用聚合酶链反应(PCR)及序列分析的方法分析A、B、C、D四类共39种β-内酰胺酶基因携带情况,阳性基因测序后作BLAST比对。采用SPSS 24.0软件对数据进行分析。
98株耐药铜绿假单胞菌中,多重耐药(MDR)菌占81.63%,广泛耐药(XDR)菌占12.25%。所有菌株对多黏菌素B敏感,对亚胺培南和美罗培南的耐药率分别为94.90%和82.65%,宁波地区分离株对阿米卡星、妥布霉素和庆大霉素的耐药率高于杭州地区分离株(χ2=31.962、22.440和29.671,P<0.01),杭州地区分离株对氨曲南和亚胺培南的耐药率均高于宁波地区分离株(χ2=4.181和5.543,P<0.05)。共检出7种β-内酰胺酶基因,其中PDC和OXA-50群的检出率最高,均为100.00%,TEM、GES和OXA-10群只在宁波地区分离株中检出,KPC只在杭州地区分离株中检出。β-内酰胺酶基因阳性模式有7种,所有菌株均携带PDC和OXA-50群,55株(56.12%)只检出PDC和OXA-50群。检出PDC、OXA-50群基因为国内首次报道。
携带PDC和OXA-50群基因是导致铜绿假单胞菌对β-内酰胺类抗菌药物耐药的重要原因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
铜绿假单胞菌常引起肺部、血流、皮肤软组织、腹腔和尿路感染等医院感染,是常见的临床分离菌[1]。近年来,耐碳青霉烯类药物和/或耐β-内酰胺复合制剂的铜绿假单胞菌检出率上升迅速,且所致的感染病死率高,故世界卫生组织(WHO)将其纳入对人类健康构成最大威胁的12种耐药菌目录中,并列为最高级别"优先1-危急"[2]。各种β-内酰胺酶的产生是造成铜绿假单胞菌对β-内酰胺类药物耐药的主要原因之一。尽管国内对铜绿假单胞菌β-内酰胺酶基因的研究较多,但普遍存在β-内酰胺酶基因检测项目不够全面与完善的问题[3,4,5,6,7,8,9,10]。本研究参考国外学者的铜绿假单胞菌相关研究报道[11,12,13,14,15,16]和对耐药铜绿假单胞菌的基因组测序报告[17,18,19,20,21,22],分析得出在耐药的铜绿假单胞菌中可能存在39种β-内酰胺酶基因。该研究根据美国基因库(GenBank)已有的最新基因序列在β-内酰胺酶基因家属或群序列的共有区设计引物,收集浙江省宁波市与杭州市两个地区临床分离的耐药铜绿假单胞菌,进行了39种β-内酰胺酶基因检测,以全面了解β-内酰胺酶类耐药基因的携带状况。
收集2018年3月至2019年5月在浙江省宁波市与杭州市两个地区6所医院住院患者首次发现感染时分离的98株耐药铜绿假单胞菌(至少对一类以上抗菌药物耐药),其中39株来自宁波地区3所医院,59株来自杭州地区3所医院。该研究经杭州市余杭区中医院伦理委员会审核通过(伦理批号2018001),且所有患者均签署知情同意书。
血琼脂平板、血液增菌培养基、菌种鉴定卡、Vitek 2-Compact全自动微生物鉴定系统购自法国生物梅里埃公司。微生物质谱检测系统、IVD细菌试验标准品、IVD HCCA基质、Eppendorf管购自美国Bruker Daltonik GmbH公司,乙腈和三氟乙酸购自美国Sigma-Aldrich公司,M-H琼脂购自英国Oxoid公司。PCR检测试剂盒和DNA Marker购自无锡市克隆遗传技术研究所。琼脂糖、乙二胺四乙酸(EDTA)、三羟甲基氨基甲烷(Tris)、溴化乙锭购自上海生工生物工程技术服务有限公司。S1000 PCR扩增仪、电泳仪购自美国Bio-Rad公司。Tanon 1600凝胶成像系统为上海天能公司产品。ABI 3730型毛细管全自动测序仪为美国Applied Biosystems公司产品。药敏试验质控菌株为大肠埃希菌ATCC25922、金黄色葡萄球菌ATCC 29213、铜绿假单胞菌ATCC27853和大肠埃希菌ATCC35218。抗菌药物购自中国食品药物检定研究院。耐药基因检测用PCR引物委托无锡市克隆遗传技术研究所设计并合成。
采用法国生物梅里埃公司Vitek 2-Compact全自动微生物鉴定系统及配套革兰阴性菌鉴定卡进行常规鉴定,并经美国Bruker Daltonik GmbH公司微生物质谱检测系统进行菌种质谱鉴定进一步确认,均为铜绿假单胞菌。
采用琼脂稀释法测定铜绿假单胞菌对8类14种抗菌药物的最低抑菌浓度(MIC)。结果判读参照2019年美国临床实验室标准化协会(CLSI)的判断标准[23]。耐药程度分类:多重耐药(MDR)、广泛耐药(XDR)及全耐药(PDR)。按2012年由欧洲与美国疾病预防控制中心(CDC)共同发起,欧美多国专家参与制定MDR、XDR及PDR定义的共识进行[24]。
挑培养菌落置入0.5 mL离心管内(内置浓度为200 ng/mL的蛋白酶K溶液500 μL),56 ℃保温2 h,95 ℃保温20 min,制备成基因检测的模板液,置于-20 ℃冰箱保存备用。耐药基因采用聚合酶链反应法(PCR法)检测。39种β-内酰胺酶基因在检测前根据美国GenBank已登录的最新基因序列在保守区设计引物,其中OXA基因分6个组群检测。PCR反应体系为:P1引物1 μL(1.0 μmol/L)、P2引物1 μL(1.0 μmol/L),dNTPs 2 μL (各2 mmol/L),10×PCR缓冲液2 μL,重组耐热DNA聚合酶1 U(不计体积),双蒸水9 μL,模板液5 μL,总反应体积为20 μL。基因扩增长度<500 bp者,热循环参数为:95 ℃预变性5 min,然后95 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,循环30个周期,并72 ℃延长至7 min。基因扩增长度≥500 bp者,热循环参数为:95 ℃预变性5 min,然后95 ℃ 30 s,55 ℃ 60 s,72 ℃ 60 s,循环30个周期,并72 ℃延长至7 min。产物经2%琼脂糖凝胶电泳,出现与阳性对照分子相当的目的条带为阳性。β-内酰胺酶基因检测PCR引物序列和目的产物长度见表1。引物的特异性通过靶基因扩增的产物DNA测序验证。

铜绿假单胞菌β-内酰胺酶基因检测PCR引物序列和目的产物长度
铜绿假单胞菌β-内酰胺酶基因检测PCR引物序列和目的产物长度
| β-内酰胺酶编码基因 | 引物序列(5′→3′) | 产物长度(bp) | |
|---|---|---|---|
| A类 | |||
| TEM | P1:AGGAAGAGTATGATTCAACA;P2:CTCGTCGTTTGGTATGGC | 512 | |
| SHV | P1:TGCGCAAGCTGCTGACCAGC;P2:TTAGCGYTGCCAGTGCTCGA | 305 | |
| CTX-M-1群 | P1:ATGGTTAAAAAATCACTGCGYCAGTTC;P2:TCACAAACCGTYGGTGACGATTTTAGCCGC | 876 | |
| CTX-M-2群 | P1:ATGATGACGCAGAGCATTCGCCGCTCA;P2:TCAGAAACCGTGGGTTACGATTTTCGC | 876 | |
| CTX-M-8群 | P1:ATGATGAGACATCGCGTTAAGCGG;P2:TTAATAACCGTCGGTGACGATTTTCGCG | 876 | |
| CTX-M-9群 | P1:ATGGTGACAAAGAGAGTGCAACGG;P2:TTACAGCCCTTCGGCGATGATTCTCGC | 876 | |
| CTX-M-25群 | P1:ATGATGAGAAAAAGCGTAAGGCGGGCG;P2:TTAATAACCGTCGGTGACAATTCTGGC | 876 | |
| PER | P1:AGTCAGCGGCTTAGATA;P2:CGTATGAAAAGGACAATC | 978 | |
| GES | P1:ATGCGCTTCATTCACGCAC;P2:CTATTTGTCCGTGCTCAGG | 846 | |
| VEB | P1:GCGGTAATTTAACCAGA;P2:GCCTATGAGCCAGTGTT | 961 | |
| CARB | P1:AAAGCAGATCTTGTGACCTATTC;P2:TCAGCGCGACTGTGATGTATAAAC | 588 | |
| KPC | P1:ATGTCACTGTATCGCCGTCTA;P2:TTACTGCCCGTTGACGCCCAA | 882 | |
| PME-1 | P1:GCGCGAACACTTGGCCCTCG;P2:CGCCGGCCTGCCAGTGCGGT | 380 | |
| BEL-1 | P1:CGACAATGCCGCAGCTAACC;P2:CAGAAGCAATTAATAACGCCC | 449 | |
| B类(金属β-内酰胺酶编码基因) | |||
| IMP | P1:CGGCCKCAGGAGMGKCTTT;P2:AACCAGTTTTGCYTTACYAT | 588 | |
| VIM | P1:CTTTACCAGATTGCYGATGG;P2:GGYAGRCCGTGCCCSGGAAT | 593 | |
| SIM | P1:ACAAGGGATTCGGCATCGTT;P2:TTATCTTGAGTGTGTCCTGG | 355 | |
| SPM | P1:CTGCTTGGATTCATGGGCGCG;P2:CCTTTTCCGCGACCTTGATCG | 786 | |
| GIM | P1:CCTGTAGCGTTGCCAGCTTTA;P2:CAGCCCAAGAGCTAATTGAGG | 562 | |
| AIM | P1:CGTCGCTTCACCCTGCTGGGCAGC;P2:AGGCGAGGCGACCGCCGTCAGGCC | 535 | |
| NDM | P1:TCAGCGCAGCTTGTCGGCCATGCG;P2:GCAACCGCGCCCAACTTTGGCCCG | 300 | |
| KHM | P1:ATGAAAATAGCTCTTGTTATATCG;P2:TCACTTTTTAGCTGCAAGCGCTTC | 726 | |
| DIM | P1:ATGAGAACACATTTTACAGCGTTA;P2:TCAATCAGCCGACGCGTTAGCGTT | 756 | |
| TMB | P1:TATGCCTCAGCGCTGACTAAT;P2:TCAGCGGTCGCCGTGATTGGC | 400 | |
| HMB | P1:TGACAGCACCATCGGCATTG;P2:TGCATCGCCCATTGTTCCAT | 320 | |
| FIM | P1:GCCGCCTTAACACCCGTCGT;P2:CATTCGATTAGAGTCGGCCG | 360 | |
| C类(AmpC酶编码基因) | |||
| DHA群 | P1:AACTTTCACAGGTGTGCTGGGT;P2:CCGTACGCATACTGGCTTTGC | 405 | |
| ACT群 | P1:TCGGTAAAGCCGATGTTGCG;P2:CTTCCACTGCGGCTGCCAGT | 302 | |
| CMY/LAT群 | P1:TGGCCAGAACTGACAGGCAA;P2:TTTCTCCTGAACGTGGCTGG | 462 | |
| CMY/MOX群 | P1:GCTGCTCAAGGAGCACAGGAT;P2:CACATTGACATAGGTGTGGTG | 520 | |
| ACC群 | P1:ACAGCCTCAGCAGCCGGTTA;P2:TTCGCCGCAATCATCCCTAG | 345 | |
| FOX群 | P1:AACATGGGGTATCAGGGAGAT;P2:CAAAGCGCGTAACCGGATTGG | 190 | |
| PDC | P1:CTGCCTGTGCGGCATCGCCG;P2:TCCTGGGCCAGGGCATAG | 300 | |
| D类 | |||
| OXA-10群 | P1:GTCTTTCRAGTACGGCATTA;P2:GATTTTCTTAGCGGCAACTTA | 822 | |
| OXA-13群 | P1:CGGCATTAGCTAGTTCAATTACAG;P2:AATGCACAAGATATTCAGGCGCAG | 564 | |
| OXA-18群 | P1:ATGCAACGGAGCCTGTCCAT;P2:CTGCGAATACCAGACGATGG | 360 | |
| OXA-20群 | P1:GAATCCCGGGCTCAGCAGCG;P2:CCACCAACCCATTTGACCAT | 480 | |
| OXA-46群 | P1:CCGTTCGTGATGAGTTCCAGG;P2:TCCGTTCTGTTTGGCGTATCA | 470 | |
| OXA-50群 | P1:ATGCGCCCTCTCCTCTTCAG;P2:GTAACCCAGGCGCGAGACAT | 420 | |
采用PCR全自动荧光法直接测序,PCR阳性产物经纯化后在美国应用生物系统公司提供的ABI 3730型毛细管全自动测序仪上进行测序(正反向测序),委托上海博尚生物技术有限公司完成。
读序工具软件为Chromas,所测序列采用Chromas中的BLAST Search程序进行同源性分析,并将新发现的基因核酸序列登录于GenBank。
采用SPSS 24.0软件对数据进行分析。计数资料以株(百分数)表示,采用χ2检验或确切概率法。以P<0.05为差异具有统计学意义。
98株耐药铜绿假单胞菌样本来源为:痰液45株(45.92%),血液18株(18.37%),脓液17株(17.35%),中段尿12株(12.24%),腹水2株(2.04%),胸水、腹透液、引流液和胆汁各1株(1.02%)。病区分布为:重症监护病房(ICU)31株(31.63%),呼吸内科18株(18.37%),神经外科11株(11.22%),老年病房9株(9.18%),普外科8株(8.16%),烧伤科7株(7.14%),肿瘤内科7株(7.14%),血液病房3株(3.06%),骨科2株(2.04%),耳鼻喉科2株(2.04%)。其中39株宁波地区分离株中,主要来源于脓液14株(35.90%),血液11株(28.21%)和痰液8株(20.51%)等;病区分布主要为ICU 11株(28.21%),烧伤科7株(17.95%)和呼吸内科6株(15.38%)等。59株杭州地区分离株中,主要来源于痰液37株(62.71%),尿液8株(13.56%)和血液7株(11.86%)等;病区分布主要为ICU 20株(33.90%),呼吸内科12株(20.34%)和神经外科7株(11.86%)等。
98株耐药铜绿假单胞菌中,80株(81.63%)为MDR菌,12株(12.25%)为XDR菌。绝大多数菌株对亚胺培南(94.90%)和美罗培南(82.65%)耐药,对头孢他啶、头孢吡肟的耐药率分别为76.53%和60.20%,对酶抑制剂复合剂哌拉西林/他唑巴坦、替卡西林/克拉维酸的耐药率分别为74.49%和90.82%。60%以上菌株对喹诺酮类环丙沙星(60.20%)和左氧氟沙星(63.27%)耐药。所有菌株对多黏菌素B敏感,多数菌株对氨基糖苷类药物(阿米卡星、妥布霉素、庆大霉素)敏感。宁波地区分离株对阿米卡星、妥布霉素和庆大霉素的耐药率高于杭州地区分离株(χ2=31.962、22.440和29.671,P<0.01),杭州地区分离株对氨曲南和亚胺培南的耐药率均高于宁波地区分离株(χ2=4.181和5.543,P<0.05),见表2。
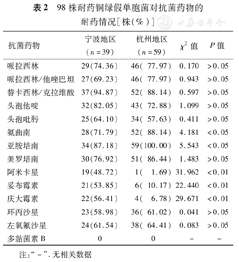
98株耐药铜绿假单胞菌对抗菌药物的耐药情况[株(%)]
98株耐药铜绿假单胞菌对抗菌药物的耐药情况[株(%)]
| 抗菌药物 | 宁波地区(n=39) | 杭州地区(n=59) | χ2值 | P值 |
|---|---|---|---|---|
| 哌拉西林 | 29(74.36) | 46( 77.97) | 0.170 | >0.05 |
| 哌拉西林/他唑巴坦 | 27(69.23) | 46( 77.97) | 0.943 | >0.05 |
| 替卡西林/克拉维酸 | 37(94.87) | 52( 88.14) | 0.597 | >0.05 |
| 头孢他啶 | 32(82.05) | 43( 72.88) | 1.099 | >0.05 |
| 头孢吡肟 | 25(64.10) | 34( 57.63) | 0.411 | >0.05 |
| 氨曲南 | 28(71.79) | 52( 88.14) | 4.181 | <0.05 |
| 亚胺培南 | 34(87.18) | 59(100.00) | 5.543 | <0.05 |
| 美罗培南 | 30(76.92) | 51( 86.44) | 1.483 | >0.05 |
| 阿米卡星 | 19(48.72) | 1( 1.69) | 31.962 | <0.01 |
| 妥布霉素 | 21(53.85) | 6( 10.17) | 22.440 | <0.01 |
| 庆大霉素 | 22(56.41) | 4( 6.78) | 29.671 | <0.01 |
| 环丙沙星 | 23(58.98) | 36( 61.02) | 0.041 | >0.05 |
| 左氧氟沙星 | 24(61.54) | 38( 64.41) | 0.083 | >0.05 |
| 多黏菌素B | 0 | 0 | - | - |
注:"-".无相关数据
对98株耐药铜绿假单胞菌进行39种β-内酰胺酶基因检测,共检出7种β-内酰胺酶基因,所有菌株均检出PDC和OXA-50群,27株(27.55%)检出KPC,9株(9.18%)检出TEM,8株(8.16%)检出OXA-10群,4株(4.08%)检出GES,4株(4.08%)检出CARB。所检出的β-内酰胺酶基因中TEM、GES、OXA-10群只在宁波地区分离株中检出,KPC只在杭州地区分离株中检出,见表3。PDC、OXA-50群、KPC基因PCR产物测序图基因已比对确认(图1,图2,图3)。



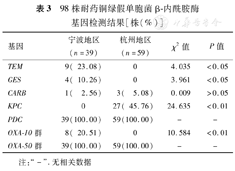
98株耐药铜绿假单胞菌β-内酰胺酶基因检测结果[株(%)]
98株耐药铜绿假单胞菌β-内酰胺酶基因检测结果[株(%)]
| 基因 | 宁波地区(n=39) | 杭州地区(n=59) | χ2值 | P值 |
|---|---|---|---|---|
| TEM | 9( 23.08) | 0 | 4.035 | <0.05 |
| GES | 4( 10.26) | 0 | 3.961 | <0.05 |
| CARB | 1( 2.56) | 3( 5.08) | 0.009 | >0.05 |
| KPC | 0 | 27( 45.76) | 24.635 | <0.01 |
| PDC | 39(100.00) | 59(100.00) | - | - |
| OXA-10群 | 8( 20.51) | 0 | 10.584 | <0.01 |
| OXA-50群 | 39(100.00) | 59(100.00) | - | - |
注:"-".无相关数据
98株耐药铜绿假单胞菌中,β-内酰胺酶基因携带模式共有7种,每株至少同时携带PDC和OXA-50群2种β-内酰胺酶基因。55株(56.12%)只检出PDC和OXA-50群,其余43株(43.88%)还携带1~2种β-内酰胺酶基因。杭州地区分离株PDC+OXA-50群+KPC基因携带模式的构成比高于宁波地区分离株(χ2=23.393,P<0.01),宁波地区分离株PDC+OXA-50群+TEM+OXA-10群和PDC+OXA-50群+GES基因携带模式的构成比高于杭州地区分离株(χ2=10.584和3.961,P<0.01或0.05),见表4。
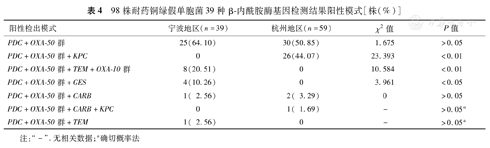
98株耐药铜绿假单胞菌39种β-内酰胺酶基因检测结果阳性模式[株(%)]
98株耐药铜绿假单胞菌39种β-内酰胺酶基因检测结果阳性模式[株(%)]
| 阳性检出模式 | 宁波地区(n=39) | 杭州地区(n=59) | χ2值 | P值 |
|---|---|---|---|---|
| PDC+OXA-50群 | 25(64.10) | 30(50.85) | 1.675 | >0.05 |
| PDC+OXA-50群+KPC | 0 | 26(44.07) | 23.393 | <0.01 |
| PDC+OXA-50群+TEM+OXA-10群 | 8(20.51) | 0 | 10.584 | <0.01 |
| PDC+OXA-50群+GES | 4(10.26) | 0 | 3.961 | <0.05 |
| PDC+OXA-50群+CARB | 1( 2.56) | 2( 3.29) | 0 | >0.05 |
| PDC+OXA-50群+CARB+KPC | 0 | 1( 1.69) | - | >0.05a |
| PDC+OXA-50群+TEM | 1( 2.56) | 0 | - | >0.05a |
注:"-".无相关数据;a确切概率法
铜绿假单胞菌常从接受器官移植、侵入性操作、免疫抑制治疗或重症监护免疫功能低下的患者中分离出,是引起医院感染的主要条件致病菌之一[25]。铜绿假单胞菌耐药性问题日趋严重。在过去的10年中,由于碳青霉烯类药物的广泛使用,临床上对碳青霉烯类药物耐药菌株的检出率快速上升。临床上对于某些耐药菌,如XDR、PDR铜绿假单胞菌感染的治疗方法极为有限[26]。本研究98株耐药铜绿假单胞菌感染患者病区分布主要为ICU、呼吸内科、神经外科和老年病房,有相对集中趋势,提示耐药铜绿假单胞菌在这些病区可能存在耐药克隆的传播,应引起高度重视。药物敏感试验显示,81.63%为MDR菌,且存在相当比例XDR菌株。菌株对碳青霉烯类药物亚胺培南和美罗培南的耐药率高达94.90%和82.65%,对头孢菌素、酶抑制剂复合剂、单环酰胺类等β-内酰胺类和喹诺酮类等抗菌药物均具有较高的耐药率。不同地区分离株耐药性比较,杭州地区分离株氨曲南和亚胺培南的耐药率高于宁波地区分离株,宁波地区分离株阿米卡星、妥布霉素和庆大霉素的耐药率高于杭州地区分离株。这可能是由于不同地区抗菌药物的使用不同而导致细菌产生不同的耐药性。
耐碳青霉烯类铜绿假单胞菌已经播散到世界各地,且对多黏菌素不敏感株也被发现[13]。近年来,国外研究报道显示,从耐药铜绿假单胞菌中不断发现一些新型的β-内酰胺酶基因,如FIM、PME、NDM、HMB、PDC、OXA-50群等[11,12,13,14,15,16]。而国内从耐药铜绿假单胞菌中主要检出TEM、CARB、GES、KPC、VEB、PER、IMP、VIM、OXA-10群等β-内酰胺酶基因[3,4,5,6,7,8,9,10]。该研究发现,39种β-内酰胺酶耐药基因研究中,共检出7种β-内酰胺酶基因,包括4种A类β-内酰胺酶基因(TEM、GES、CARB、KPC)、1种C类β-内酰胺酶基因(PDC)和2种D类β-内酰胺酶基因(OXA-10群、OXA-50群)。12种包含所有近年来国外新发现的B类β-内酰胺酶(金属酶)基因均未检出,提示携带金属酶基因不是本组铜绿假单胞菌对碳青酶烯类药物耐药的主要原因。在检出的β-内酰胺酶基因中,PDC和OXA-50群的分离率最高,均为100.00%,其次为KPC(27.55%)、TEM(9.18%)、OXA-10群(8.16%)、GES(4.08%)和CARB(4.08%)。GES型、KPC型β-内酰胺酶具有碳青霉烯酶活性。PDC和OXA-50群β-内酰胺酶均对β-内酰胺酶抑制剂(克拉维酸、他唑巴坦)不敏感,宁波与杭州两个地区6所医院98株铜绿假单胞菌临床分离株均检出C类β-内酰胺酶基因中的PDC型和D类β-内酰胺酶基因中的OXA-50群型,验证了本组菌株对含β-内酰胺酶抑制剂的哌拉西林/他唑巴坦、替卡西林/克拉维酸的敏感性低的遗传学背景。PDC、OXA-50群基因为国内首次检出,PDC、OXA-50群、KPC基因序列已登录于美国基因库(GenBank)(登录号分别为:MT444156、MT444155、MT444154)。
本研究发现耐药铜绿假单胞菌基因携带状况存在地区差异。TEM、GES和OXA-10群基因只在宁波地区分离株中检出,KPC只在杭州地区分离株中检出,而CARB、PDC、OXA-50群在宁波和杭州地区铜绿假单胞菌中均有检出。39种β-内酰胺酶基因携带状况研究显示,所有菌株均同时携带PDC和OXA-50群2种β-内酰胺酶基因,阳性模式有7种。其中55株(56.12%)只携带PDC和OXA-50群基因,其余43株(43.88%)除携带PDC和OXA-50群基因外,分别还携带1~2种β-内酰胺酶基因,且两个地区β-内酰胺酶基因谱存在一定的异质性,说明β-内酰胺类药物的大量应用使铜绿假单胞菌产生多种β-内酰胺酶,其与多重耐药性有密切关系。本研究同时还发现,部分菌株对碳青霉烯类药物耐药,但对头孢菌素敏感,其对碳青霉烯类药物的耐药可能是与膜孔蛋白(OprD2)缺失以及外排系统MerAB-OprM和MexCD-OprJ过度表达有关[27,28]。
本研究发现98株耐药铜绿假单胞菌中XDR菌占12.25%。XDR铜绿假单胞菌感染可供选择的抗菌药物很少,该类细菌对多黏菌素类的敏感性相对较高,但临床研究显示单用的治疗失败率较高,应避免单药使用。XDR铜绿假单胞菌感染通常采用2或3种药物联合治疗,如以多黏菌素为基础的联合、以抗铜绿假单胞菌β-内酰胺类为基础的联合、以环丙沙星为基础的联合以及双β-内酰胺类联合等[26]。阿维巴坦作为一种人工合成新的β-内酰胺酶抑制剂,除超广谱β-内酰胺酶(ESBL)外,对PDC、部分D类β-内酰胺酶及丝氨酸碳青霉烯酶KPC具有抑制作用,头孢他啶-阿维巴坦于2015年2月在美国批准上市。国外研究显示,对于非产金属酶的XDR铜绿假单胞菌感染(如产PDC、膜孔蛋白OprD2缺失、mexAB-oprM外排泵过度表达耐药机制),头孢他啶-阿维巴坦与磷霉素联合治疗是一种有效的治疗策略[29],所以基于耐药机制的抗菌药物联合用药,对XDR感染的治疗将会取得更佳的治疗效果。
MDR铜绿假单胞菌感染增多是抗菌药物选择压力、耐药基因水平传播和耐药克隆传播共同作用的结果。对耐药铜绿假单胞菌临床分离株进行β-内酰胺酶基因检测,能更全面地了解获得性耐药机制。本研究结果表明,菌株携带PDC和OXA-50群β-内酰胺酶基因,是本组耐药铜绿假单胞菌重要的流行病学特征,必须将医院感染防控措施与抗菌药物临床应用管理相结合,才能有效遏制耐药铜绿假单胞菌传播,减少耐药菌感染。本研究仍存在较多不足,如菌株数较少、未进行β-内酰胺酶基因的携带与表达、克隆传播以及介导耐药的研究,后续将进一步扩大菌株数进行更为深入的研究。
所有作者均声明不存在利益冲突



























