
腹腔镜辅助结肠癌根治术已被大家所接受。近年来,全腹腔镜左半结肠切除后腔内吻合术的应用逐渐增多。该方法具有小切口、疼痛轻和术后恢复快等优点,并且不会增加术后并发症的发生率,已被临床医生逐渐接受,各种腔内结肠吻合的方式也不断涌现。目前,腔内结肠吻合可采用手工端端缝合,也可借助吻合器端侧或端端吻合,尚无统一意见及标准。从文献来看,主流方式是直线切割闭合器行侧侧吻合,而术者应根据个人技术特点、肠管具体情况、患者客观经济状况灵活选择,制定个体化的吻合方式。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全腹腔镜下左半结肠切除后腔内吻合术具有小切口、疼痛轻以及术后恢复快等优点,并且不会增加术后并发症发生率,该方法已被临床医生逐渐接受,腔内结肠吻合的方式也不断涌现。目前,腔内结肠吻合可采用手工端端缝合,也可借助吻合器端侧或端端吻合。现对这几种吻合方式、技术要点及相关研究进展进行探讨。
2008年,Lipski等[1]报道了左半结肠癌术后手工吻合重建肠道,并将其命名为完全镜下免器械手工吻合(completely staple-free hand-sewn laparoscopic colonic anastomosis,CSHLCA),整个吻合耗时38 min。他们认为手工吻合可行,有一定优势,但也指出这种方法对技术要求更高,更适合于低收入人群及难以获得器械的地区。2011年,国内杜建军等[2]报道,在完全腹腔镜结肠切除术后,手工缝合重建肠道19例(其中乙状结肠8例),手工吻合时间为(49.5±29.4) min,未观察到吻合口并发症,但有1例出现腹腔轻度污染,保守治疗后治愈;因此他们认为,完全腹腔镜结肠切除术后,手工缝合重建是安全、可行的,但需要由具有丰富经验的腹腔镜外科医生实施。
1997年,Bergamaschi和Arnaud[3]报道了54例良性疾病的左半结肠手术,术后均采用腔内吻合,具体步骤:切断近端结肠,经下腹部33 mm戳卡置入抵钉座,镜下荷包缝合近端肠管断端后,由断端置入抵钉座,收紧缝线,由肛门置入吻合器,完成结肠端端吻合,标本处理后经33 mm戳卡处取出,取得满意效果;平均手术时间为125 min,术后并发症发生率9.2%,均为轻微并发症,无吻合口并发症。国内杜建军等[2]对乙状结肠切除术后结肠吻合,也采用此种方法,荷包缝合时间为(13.3±5.5) min,效果良好。
1994年,Darzi等[4]首次将反穿刺法应用于乙状结肠及降结肠腔内吻合手术中,吻合具体步骤:切断近端肠壁后,由近端结肠断端置入带缝线的抵钉座,然后距离预定切除线约2 cm缝合穿透肠壁,闭合器闭合近端肠管后,再将带穿刺头抵钉座拉出肠外,标本也可经肛取出,最后闭合器封闭远端,然后完成结肠端端吻合。见图1。作者指出,为了保护括约肌及直肠黏膜,对于较大标本不宜从肛门取出。2008年,Bucher等[5]采用腔内端侧吻合法:先不离断近端肠壁,在离断线远端肠管前壁开口,置入抵钉座后,在切除线近端2~3 cm系膜对侧近结肠带处开小孔,将抵钉座通过小孔拉出,缝合固定后,闭合器离断近段肠管(确保闭合开口),然后由肛门置入吻合器,行结肠端侧吻合,吻合时间为(14±3) min。2009年,Akamatsu等[6]也采用改进的反穿刺法完成了16例结肠癌手术,此法与Bucher方法类似,其区别在于拉出抵钉座的方法不同:置入带抵钉座于肠内后,距离预定切断线近端2~3 cm缝合穿透肠壁,然后拉出抵钉座,闭合器离断肠壁及开口,后续步骤相同。
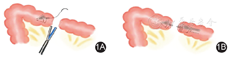

2012年,Roscio等[7]采用直线切割闭合器完成了8例横结肠、降结肠顺蠕动侧侧吻合,吻合具体步骤:近端远端肠壁均用闭合器离断,将两断端并拢并拉向左上腹,在距离结肠断端的合适距离、系膜对侧肠壁上分别开孔,将张开的直线切割闭合器分别置入两侧肠管内,使用切割闭合器完成结肠带对结肠带侧侧吻合后,用可吸收线连续缝合关闭共同开口,见图2;术后无严重并发症;故认为此种方法安全、可重复性强、容易掌握并适合推广使用。2014年,Araujo等[8]也推荐了此种方法,但认为此种方法需要有一定的腔镜技术后再实施。2015年,Ceretti等[9]介绍了单中心腹腔镜左半结肠癌根治术23例的吻合经验,其中7例采用此方法完成吻合,取得较好的效果,故认为此种术式更符合加速康复外科理念。2015年,Swaid等[10]在33例腹腔镜左半结肠癌根治术中采用此种方法行全腔镜下吻合,并与采用体外吻合的17例进行回顾性比较分析,结果显示,全腔镜下吻合者切口更短[(5.8±0.9) cm比(8.2±0.9) cm,P<0.000 01],住院时间短[(4.2±1.2) d比(6.3±1.9) d,P<0.000 1],而手术时间、淋巴结检出数、并发症发生率与腹腔镜辅助手术组差异无统计学意义。2016年,Carlini等[11]回顾性分析了单中心腔镜下左半结肠癌病例567例,其中20例为结肠脾曲,11例腹腔镜辅助腔外手工吻合,9例全腔镜下侧侧顺蠕动吻合,两种吻合方式在手术时间、术后淋巴结检出数以及并发症发生率方面与腹腔镜辅助手术患者差异无统计学意义(均P>0.05)。


2012年,Ikeda等[12]报道了采用逆蠕动侧侧吻合,吻合步骤:近端远端肠壁均用闭合器离断,将两端拉向中线,于肠壁断端系膜对侧处切开,进入肠腔,将张开的直线切割闭合器分别置入两侧肠管断端内,使用切割闭合器完成结肠带对结肠带侧侧吻合后,缝线2~3针间断缝合共同开口,提起缝合线后,以切割闭合器垂直于系膜关闭共同开口;见图3。此类方法闭合共同开口后,因其吻合口呈三角形,学者命名其为"三角吻合"。2014年,Iorio和Blumberg[13]采用此种方法进行腔内吻合,并采用病例对照研究的方法,比较了左半与右半结肠全腔镜下吻合后的并发症、住院时间及康复情况,研究纳入左半结肠癌35例、右半结肠癌70例,结果显示,全腔镜左半、右半结肠癌手术的上述指标差异并无统计学意义。2014,Wang等[14]采用此种方法对11例左半结肠癌患者术中进行吻合,经阴道取标本,取得较好的近期效果,为类似的患者提供了一种可选择的方法。2018年,王铁等[15]和苏昊等[16]均采用腔镜下三角吻合的方法,也取得较为满意的近期效果。与顺蠕动的方法相比,采用此种方式的优点在于,采用切割闭合器关闭共同开口,技术难度低,且减少了镜下缝合。


Overlap也是侧侧吻合的一种方式。2017年Zhou等[17]以及2018年王楠等[18]均报道了采用Overlap方法进行腔内结肠吻合,吻合步骤为分别在近端肠管结肠带的断端处和远端结肠距断端6 cm结肠带上开孔,进入肠腔,从尾侧将直线吻合器两侧臂分别置入远端和近端结肠肠腔内,牵拉远近端结肠系膜,使远端和近端结肠残端重叠、且结肠带对结肠带,击发后完成侧侧吻合,见图4。作者发现,与传统吻合组比较,Overlap吻合组患者总的手术时间缩短,术中出血量较少,腹壁切口长度更短,术后并发症两者并无差别。作者认为,此种方法的优点在于对系膜长度要求更低,可以由尾侧亦可由头侧置入闭合器,可根据操作方便灵活应用,吻合方式比较灵活。


目前学者普遍认为,全腹腔镜左半结肠切除后,结肠腔内吻合有着更微创、术后恢复快等优势。由于肥胖患者的腹壁更厚、系膜更短,故更适合腔内吻合。但镜下器械、吻合方式的选择尚无统一标准。
优点在于能免用器械,节省费用;缺点也比较明显,纯粹手工吻合对技术要求高,耗时更长。行手工吻合的医生也认为,结肠内细菌多、含量大,长时间暴露气腹会增加细菌播撒概率。因此,纯手工吻合造成腹腔污染机会可能会增高,需由经验丰富的腹腔镜外科医生实施。而文献报道中,全采用手工吻合的应用较少,需要大样本临床资料来说明其安全性[2]。
优点在于:(1)对结肠及系膜长度要求低;(2)更加符合生理;(3)类似于直肠-结肠吻合,吻合步骤熟悉。其缺点在于受制于肛门置入吻合器距离,如横结肠近脾曲或乙状结肠过长者,肛门置入吻合器无法达到结肠断端或置入困难。
优点在于:(1)侧侧吻合口不受肠腔内径限制;(2)避免肛门置入吻合器,不受远端结肠长度影响;(3)全程直线切割闭合器吻合,学习曲线短,手术时间短;(4)吻合方式多样灵活,可根据近、远端肠管及系膜长度选择不同方法。其缺点在于对于肠管及系膜长度有一定要求,尤其是在采用逆蠕动侧侧吻合时,此缺点更加明显。
综上,全腹腔镜左半结肠切除后结肠腔内吻合的方法目前尚未统一。从目前的文献来看,以直线切割闭合器行侧侧吻合是主流方式,而术者应根据个人技术特点、肠管具体情况、患者客观经济状况灵活选择,制定个体化的吻合方式。
所有作者均声明不存在利益冲突



























