
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
《中国中枢神经系统恶性胶质瘤诊断和治疗专家共识(简化版)》[1](以下简称共识)于2009年10月公布以来,深受大家欢迎。2011年9月共识编写组讨论决定进一步更新共识,增加相关内容,以满足广大临床医务工作者和患者之需,同时将其更名为《中国中枢神经系统胶质瘤诊断和治疗指南(2012)》(以下简称指南)。增加的内容有:毛细胞型星形胶质瘤、胚胎发育不良性神经上皮瘤(DNET)、节细胞瘤、节细胞胶质瘤、世界卫生组织(WHO) Ⅱ级胶质瘤(如弥漫性星形胶质瘤、少突胶质瘤和室管膜瘤等)、WHO Ⅲ级、Ⅳ级中的脑胶质瘤病、髓母细胞瘤和幕上神经外胚叶瘤等。指南的编写者中增加了神经病理学专家、神经影像学专家和康复治疗专家。指南的编写仍保持共识编写的程序,即:(1)多学科专家组成编写组;(2)编写组专家提出指南要解决的问题和范畴;(3)信息专家按问题搜索文献证据,除国外文献外,强调中文文献的搜索;(4)编写组专家阅读文献,按循证医学5级分类(表1)、随机对照研究"CONSORT"和指南"AGREE"的程序,多人针对问题进行磋商,评估文献的证据质量,达成推荐级别(表2),并结合中国国情和实际情况,写出指南推荐意见;(5)最后由编写组长协调和定稿。

循证医学
循证医学
| 级别 | 研究方法 |
|---|---|
| Ⅰ级 | 按特定病种或疗法收集所有质量可靠的随机对照试验(RCT)后,作出系统评价或荟萃分析或大样本多中心RCT |
| Ⅱ级 | 单中心大样本RCT |
| Ⅲ级 | 设对照组非随机分组的研究,病例对照和队列研究 |
| Ⅳ级 | 无对照的系列病列观察 |
| Ⅴ级 | 个案病例、描述性研究、专家意见 |

推荐级别
推荐级别
| 等级 | 推荐级别 |
|---|---|
| 强烈推荐 | Ⅰ级证据、多个一致性Ⅱ级证据 |
| 推荐 | Ⅱ、Ⅲ、Ⅳ级证据且结果多一致 |
| 可推荐 | Ⅱ、Ⅲ、Ⅳ级证据结果不一致 |
| 不推荐 | Ⅰ级证据否定,Ⅱ~Ⅳ级证据不一致占多数;较少或缺乏系统的经验 |
胶质瘤是指起源于神经上皮组织来源的肿瘤,是最常见的原发性颅内肿瘤,主要有四种病理类型:星形细胞起源肿瘤、少突胶质细胞起源的肿瘤、室管膜细胞起源的肿瘤和星形细胞-少突胶质细胞混合性起源的肿瘤[2]。世界卫生组织(WHO)中枢神经系统肿瘤分类中将胶质瘤分为Ⅰ~Ⅳ级,Ⅲ、Ⅳ级为恶性胶质瘤,占所有胶质瘤的77.5%。低级别胶质瘤(WHO Ⅰ~Ⅱ级)常见的有毛细胞型星形细胞瘤,多形性黄色星形细胞瘤,室管膜巨细胞星形细胞瘤等。除此之外,还包括混合型胶质神经元肿瘤,如节细胞胶质瘤、胚胎发育不良性神经上皮肿瘤等。近30年来,原发性恶性脑肿瘤发生率逐年递增,年增长率约为1.2%,在老年人群尤为明显。根据美国脑肿瘤注册中心(CBTRUS)统计,恶性肿瘤患病率约为29.5/10万。恶性胶质瘤约占原发性恶性脑肿瘤的70%,年发病率约为5/10万,每年新发病例超过14 000例,且男多于女,65岁以上人群发病率明显增高[3]。恶性胶质瘤中,间变性星形细胞瘤(AA,WHO Ⅲ级)和多形性胶质母细胞瘤( GBM,WHO Ⅳ级)最为常见,其中,GBM约占所有胶质瘤的50%,AA及GBM新诊断患者的中位年龄分别为45和64岁[4,5]。
胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。近年来,恶性胶质瘤发病机制研究的热点包括:等位基因的杂合性缺失及基因的遗传性变异研究,DNA错配修复,细胞信号通路紊乱(如EGFR及PDGF通路),PI3K/Akt/PTEN、Ras和P53/RB1通路基因突变和肿瘤干细胞研究等。
胶质瘤临床表现主要包括颅内压增高及神经功能缺失的症状及体征。目前,胶质瘤主要依靠CT及MRI检查获得影像学诊断,一些新的MRI序列,如磁共振弥散加权成像和弥散张量成像(DWI和DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)、功能磁共振成像(fMRI)更加广泛地应用于临床,对于提高诊断水平及判断预后有重要意义。PET、SPECT对于鉴别肿瘤复发与放射性坏死有一定帮助。最终,需要通过肿瘤切除术或活检术明确病理学诊断。形态观察仍然是病理学诊断的基础,一些分子生物学标志物对确定分子亚型、个体化治疗及临床预后判断具有重要意义,如O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)甲基化水平检测、染色体1p/19q杂合性缺失(1p/19q LOH)、异柠檬酸脱氢酶1(IDH1)及IDH2基因突变、BRAF基因突变;其他常用的分子标志物还有胶质纤维酸性蛋白(GFAP)、Ki-67抗原等(Ⅰ级证据,强烈推荐)。
胶质瘤治疗以手术切除肿瘤为主,结合放疗、化疗等综合治疗方法。手术可以缓解临床症状,延长生存期,并获得足够标本用以明确病理学诊断和分子水平研究。主张手术应安全、最大范围地切除肿瘤(Ⅰ级证据,强烈推荐),而fMRI、术中MRI(iMRI)、神经导航、皮层直流电刺激、术中唤醒麻醉等技术的应用进一步提高了疗效。放疗可杀灭或抑制残余的瘤细胞,延长患者生存期,分割外放射治疗已经成为恶性胶质瘤的标准疗法。胶质瘤具有原位复发的特点,且90%发生在距原发灶2 cm的范围之内,故优化局部放疗方案是治疗的焦点。近年来多种剂量分割方法、多种放疗方式(三维适形放疗、调强放疗、间质内近距离放疗、立体定向外科等)以及新放疗设备的应用,进一步提高了放疗效果。胶质瘤的化疗一直采用单药和多种药物联合应用的方案。欧洲癌症研究治疗组织(EORTC)和加拿大国立癌症研究院(NCIC)的大规模Ⅲ期临床试验证实,替莫唑胺(Temozolomide,TMZ)联合同步放疗,继以6周期TMZ辅助化疗可延长患者生存期,2年生存率由10.4%提高到26.5%。TMZ同步放疗联合辅助化疗已成为新诊断GBM的标准治疗方案。目前,欧洲和美国已批准TMZ和卡莫司汀生物降解聚合物(BCNU,Gliadel Wafer)用于恶性胶质瘤的治疗[3]。如何预知恶性胶质瘤对化疗药物的反应性,降低化疗耐药性是化疗的治疗焦点。内源性MGMT甲基化水平及1p/19q LOH可分别作为GBM和少突胶质细胞瘤预后的预测因素。目前,分子靶向药物治疗、免疫治疗、基因治疗等新疗法逐步应用于胶质瘤的治疗,但疗效尚需大样本、随机和对照研究检验。
现今,神经影像学及胶质瘤的治疗均取得了一定的进展,但胶质瘤患者的预后远不能使人满意。成人恶性胶质瘤的1及5年生存率分别约为30%和13%,间变性胶质瘤及GBM的中位生存时间分别为2~3和1年[5]。GBM预后差的主要原因在于其高复发率及化疗高抵抗性,其明确的预后相关因素包括:肿瘤的组织病理学特点、患者年龄和一般身体状况等。胶质瘤的治疗需要神经外科、放射治疗科、神经影像科、化疗科、病理科和神经康复科等多学科合作,采取个体化综合治疗,遵循循证医学证据(尽可能基于Ⅰ级证据),优化和规范治疗方案,以期达到最大治疗效益,尽可能地延长患者无进展生存期(PFS)和总生存期(OS),提高生存质量。患者的生存质量是最需要优先考虑的因素,是临床决策的基础。医生需要对患者进行密切随访观察,定期影像学复查。决定是否需要进一步临床治疗,还要考虑到患者的日常生活、社会和家庭活动、营养支持、疼痛控制、康复治疗、心理调控等问题,为患者提供最优化的综合治疗。
中枢神经系统胶质瘤的临床表现没有特异性,头痛为主要症状,低级别胶质瘤常以癫痫为首发症状,恶性胶质瘤可以合并颅内压增高的相应症状和体征,如恶心、呕吐和视物模糊。根据肿瘤部位和进展程度不同,可出现局灶性神经系统功能缺失的体征,如肢体瘫痪和语言障碍等。
CT:推荐。CT平扫可以发现病灶。胶质瘤表现为低密度,边界不清,但恶性胶质瘤伴有出血时呈高密度;肿瘤钙化在CT呈特异性高密度。增强扫描恶性胶质瘤有不同程度强化,低级别胶质瘤通常无强化或轻度强化;少数恶性胶质瘤可无明显强化。CT检查在胶质瘤鉴别诊断及确定肿瘤侵犯范围方面不如MRI检查。MRI:强烈推荐。MRI平扫:胶质瘤在T1W为等信号或低信号,T2W为不均匀高信号,恶性胶质瘤可伴有出血、坏死或囊变,瘤周水肿及明显占位效应,由于FLAIR(Fluid Attenuated Inversion Recovery)序列在发现病灶及病灶范围显示方面比T2W更加敏感,建议有条件单位增加FLAIR序列扫描(Ⅲ级证据)。MRI增强:恶性胶质瘤呈不规则结节状或花环状强化,低级别胶质瘤或胶质瘤病多无强化或轻微斑片样强化;少数恶性胶质瘤可无明显强化,少数低级别胶质瘤也可有明显强化。MRI平扫加增强检查不仅可鉴别胶质瘤与部分非肿瘤病变,避免不必要的外科手术,而且还对胶质瘤分级、明确胶质瘤侵犯范围,帮助立体定向肿瘤活检区域选择,有利于胶质瘤的手术切除和预后评估。
可供选择的其他影像学检查:推荐。(1) DW和DTI:用于胶质瘤鉴别诊断、评估肿瘤对神经传导束侵袭状况,明确肿瘤与皮层下传导束(如运动、感觉及视觉等)空间解剖关系,指导手术切除范围(Ⅳ级证据)。(2) MRS:通过评估肿瘤的代谢差异,鉴别胶质瘤的良恶性程度,判定肿瘤周围是否存在肿瘤细胞浸润,为胶质瘤分级提供重要信息(Ⅳ级证据),指导肿瘤活检区域选择,为胶质瘤切除范围提供指导。(3) PW:提供肿瘤血流状况及血脑屏障破坏程度,有利于胶质瘤术前诊断和鉴别诊断;评估胶质瘤血管生成状况,利于肿瘤新生血管抑制性药物的疗效评价;对肿瘤分级有参考价值;可指导肿瘤活检区域选择(Ⅳ级证据)。(4)BOLD-fMRI:用于胶质瘤术前功能定位,指导手术治疗,以求在保留重要功能区的前提下最大限度切除肿瘤(Ⅲ级证据)。(5) PET或SPECT检查:应用放射性标记的示踪剂评价肿瘤和正常脑组织代谢活性。有助诊断或指导活检靶点和手术切除范围。对肿瘤术前分级有一定价值。
CT:推荐。术中CT可以及时纠正术中胶质瘤移位。但是,由于CT扫描具有放射性,与MRI比其分辨率较低,故应用价值受到限制。MRI:强烈推荐。平扫或增强MR可实时发现肿瘤术中移位,明确胶质瘤侵犯范围,有利于最大限度手术切除肿瘤,提高患者生活质量,延长生存期(Ⅱ级证据)。BOLD-fMRI:强烈推荐。用于脑功能皮层定位,提高了肿瘤的全切除率,降低了术后神经功能障碍。
可供选择的其他影像学检查手段:推荐。(1) DTI:术中DTI可以显示肿瘤邻近传导束,对于决定手术切除及活检部位、避免传导束损伤,具有重要价值。(2) MRS:多体素MRS有助确定胶质瘤范围,减少肿瘤手术残留。(3) PW:明确血脑屏障破坏程度和肿瘤侵犯范围,减少术中肿瘤残留。
CT检查:推荐。胶质瘤术后早期(<72 h)行CT平扫,可发现颅内血肿、脑肿胀等并发症。胶质瘤术后软化和胶质增生CT平扫低密度,增强无明显强化。恶性胶质瘤残留或复发增强后呈不均匀强化,但CT不能鉴别胶质瘤复发和放射性坏死。MRI检查:强烈推荐。胶质瘤术后软化和胶质增生,MRI平扫T1W为低信号,T2W及FLAIR为不均匀高信号,无明显水肿及占位效应,MRI增强多无强化。恶性胶质瘤术后进展或复发,增强呈不均匀强化,但有时难与放射性坏死鉴别。MRS:强烈推荐。能够区分肿瘤术后胶质增生、肿瘤复发及放射性坏死,并可用于疗效评估。
推荐可供选择的其他影像学检查:(1) DW和DTI:对诊断胶质瘤复发有参考价值,可评估术后脑白质神经纤维束损伤。(2) PW:区分肿瘤术后胶质增生、肿瘤复发及放射性坏死或胶质瘤假性进展;可以评估胶质瘤疗效。(3) BOLD-fMRI:可显示肿瘤切除同侧功能区和对侧功能区的代偿情况,为以后脑功能的恢复情况提供客观评价。(4) PET或SPECT检查:可鉴别肿瘤复发与放射性坏死,但应用有局限性。
推荐。CT平扫肿瘤实质部分呈稍低密度或等密度,部分肿瘤有钙化,则呈高密度。出血及坏死少见,无或仅有轻度瘤周水肿。增强扫描多无强化或轻度不均匀强化。但毛细胞型星形细胞瘤、多形性黄色星形细胞瘤实质部分常明显强化;室管膜瘤及中央神经细胞瘤呈中等度不均匀强化。节细胞胶质瘤增强扫描表现不一,可以完全无强化、不均匀强化或弥漫性均匀强化。肿瘤囊性部分呈低密度,增强扫描无明显强化。约80%少突胶质细胞瘤可见结节状、斑片状或簇状钙化,室管膜瘤约50%可见钙化,多为点状钙化,中央神经细胞瘤钙化率可达50%~70%,节细胞胶质、WHO Ⅱ级星形细胞瘤及DNET也可发生钙化。CT检查有利于检出肿瘤内钙化,对术前定性诊断有很大帮助。
强烈推荐。实质性部分平扫通常表现T1W稍低信号、T2W及FLAIR稍高信号,可有囊变和钙化,囊变呈T1W及FLAIR低信号、T2W高信号,钙化T2W及FLAIR呈低信号,出血及坏死少见,瘤周水肿不明显。增强扫描肿瘤实性部分多无增强或仅有轻度不均匀增强,肿瘤囊性部分无强化。毛细胞型星形细胞瘤、毛细胞黏液型星形细胞瘤、多形性黄色星形细胞瘤实质部分常明显强化。多形性黄色星形细胞瘤常累及皮层及脑膜,邻近脑膜常可明显强化,约70%可呈现"脑膜尾征"。节细胞胶质瘤增强扫描不同程度强化。中央神经细胞瘤肿瘤实质部分T1W平扫呈等信号,增强呈中等度到明显强化,常位于室间孔区域,与透明隔关系密切,极少数可位于脑室外。室管膜瘤呈中等度不均匀强化,室管膜瘤起源于四脑室底壁,肿瘤形态常不规则,MRI多方向成像可以显示肿瘤沿四脑室"塑型",常通过四脑室的侧孔或正中孔向脑池内"钻孔样"生长为其特点,阻塞脑脊液循环通道时常见脑积水。DNET几乎均发生于幕上大脑皮层内或以皮层为主,常累及脑表面并向外膨出,颅骨受压变薄,常伴随皮层发育不良,可以显示肿瘤呈"楔形"分布的特点。毛细胞黏液型星形细胞瘤及室管膜瘤囊变少见,毛细胞型星形细胞瘤、多形性黄色星形细胞瘤、节细胞瘤、WHO Ⅱ级星形细胞瘤、WHO Ⅱ级少突胶质细胞瘤囊变较常见。毛细胞黏液型星形细胞瘤、室管膜瘤还可沿脑脊液播散。
MRI平扫及增强扫描是术前诊断及术后随访的首选检查技术,由于FLAIR序列在发现病灶及病灶范围显示方面比T2W更加敏感,建议有条件单位增加FLAIR序列扫描(Ⅲ级证据)。
(1) DW及DTI:推荐。在DW肿瘤通常为偏低信号,室管膜瘤可呈稍高信号。DTI可显示肿瘤周围的白质纤维束受推压移位或破坏中断。(2) MRS:推荐。肿瘤实质部分Cho升高,NAA降低,GBM可出现Lip和(或)Lac峰;DNET通常无明显异常。MRS对于肿瘤定性诊断及检测肿瘤的边界有一定价值。(3) PW:推荐。肿瘤的实质部分rCBV升高,特别见于高级别胶质瘤。(4) BOLD-fMRI:推荐。定位皮层功能区和功能区与肿瘤的关系。(5) PET:示踪剂FDG检查肿瘤代谢有时与正常脑白质相似,故宜用氨基酸示踪剂FET或MET,WHOⅡ级星形细胞瘤、室管膜瘤肿瘤常为高代谢改变,DNET、中央神经细胞瘤、节细胞瘤或节细胞胶质瘤则常为低代谢。
推荐。(1)平扫:肿瘤密度不均匀,常见出血、坏死和囊变。瘤周水肿和占位效应均较明显。胶质瘤病常常成弥漫性生长。小儿髓母细胞瘤常位于小脑蚓部,可突入四脑室;成人髓母细胞瘤多位于小脑,为圆形或椭圆形高密度影或略高密度影。原始神经外胚叶肿瘤(PNET)多位于幕上大脑半球的额顶、额颞、枕叶、胼胝体区,病灶常较大,实质性肿瘤,边界清晰,瘤周水肿较轻。(2)增强:不规则薄壁环形强化或不规则非均匀性厚壁环形强化。胶质瘤病多无强化或轻微斑块样强化。髓母细胞瘤多呈明显均匀强化、肿瘤内部斑片样强化;发生在小脑半球的肿瘤常增强不显著,可逆行性脑室内播散或沿脑脊膜扩散。PNET常为非均匀强化或不规则"印戒"样强化[7]。
强烈推荐。(1)平扫:通常为混杂信号病灶,T1W为等信号或低信号,T2W为不均匀高信号,伴有出血、坏死或囊变,瘤周水肿及占位效应明显。肿瘤常沿白质纤维束扩散。髓母细胞瘤T1W多为较均匀的低信号、T2W为等信号或略高信号,边缘清晰,可有小部分囊变,常压迫第四脑室,继发幕上脑积水。PNET多表现为T1W呈稍低信号,T2W呈稍高信号,或T1W、T2W均呈混杂信号强度。(2)增强:呈结节状或不规则环状明显强化。胶质瘤病多无强化或轻微斑块样强化。髓母细胞瘤大多数为明显均匀强化,少数呈中等强化;可见肿瘤沿脑脊液扩散。PNET可表现增强或不均一强化、不规则"印戒"样强化,偶见沿室管膜播散。
(1) DW和DTI: DW对肿瘤与脓肿的鉴别有参考价值;对高级别胶质瘤、髓母细胞瘤、PENT与单发脑转移瘤鉴别有参考价值;对推测瘤周水肿区肿瘤细胞浸润情况有一定诊断价值,对肿瘤分级有诊断价值。DTI能够反映胶质瘤对传导束的影响,亦可鉴别胶质瘤的良恶程度,为手术和放疗计划的制定及患者预后提供重要的指导信息。(2) MRS:高级别胶质瘤、髓母细胞瘤及PENT实体Cho峰均增高,NAA峰降低,出现Lip和(或)Lac峰。代谢物比值的测量如NAA/Cr、NAA/Cho、Cho/Cr比值可鉴别胶质瘤的良恶性程度,并判定恶性胶质瘤周围是否存在肿瘤细胞浸润,进而为胶质瘤分级提供重要信息。氨基乙磺酸峰明显抬高是髓母细胞瘤与其他小脑脑肿瘤鉴别之特征。多体素MRS有望对胶质瘤范围进行较准确定位,用以指导临床活检、手术及放疗。区分肿瘤术后瘢痕、肿瘤复发及放射性坏死;并应用于疗效评估。(3) PW:测量肿瘤区域脑血流容积,可反映有功能毛细血管量的多少,提示肿瘤的生物学活性。鉴别肿瘤组织与非肿瘤组织良恶性的信息,为疾病的鉴别诊断提供依据;指导临床活检以及疗效评估;肿瘤新生血管抑制性药物的疗效评估。(4) BOLD-fMRI:用于功能皮层的定位,判断肿瘤与功能皮层的关系,指导手术治疗。术后fMRI可显示脑功能的恢复和代偿情况。(5) PET或SPECT:可鉴别肿瘤与放射性坏死,对肿瘤术前分级评定和术中活检定位有辅助意义。11C-MET显像剂优于18F-FDG。
胶质瘤是一组具有向胶质细胞分化特征的神经上皮肿瘤的总称,是颅内最常见的原发性肿瘤。以Bailey和Cushing的胚胎学说和Kernohan的间变学说为框架,1979年WHO首次公布了《中枢神经系统肿瘤的组织学分型》,历经1993、2000和2006年多次修订,于2007年颁布了第4版《WHO中枢神经系统肿瘤分类》蓝皮书。目前,该蓝皮书是世界各国对中枢神经系统肿瘤进行诊断和分类的重要依据[2](Ⅰ级证据)。2008年公布了人类脑胶质瘤的癌基因图谱,并确定了在成瘤过程中RTK/RAS/PI-3K、P53及RB是3条关键的分子信号通路。根据基因表达谱的差异性,研究发现原发性胶质母细胞瘤包涵神经元前体型(Proneural)、神经元型(Neural)、经典性(Classical)和间叶型(Mesenchymal)4种分子亚型。约80%以上的低级别胶质瘤,包括星形细胞瘤、少突胶质细胞瘤、混合性少突星形细胞瘤以及继发性胶质母细胞瘤的患者有IDH1基因突变,应用IDH1突变型特异性抗体(mIDH1-R132H)的免疫组织化学方法能精确区分胶质增生和低级别胶质瘤。通过免疫荧光原位杂交技术发现约有80%以上的少突胶质细胞瘤有1p/19q LOH,提示患者预后良好并对烷化剂类化疗药物有效。通过免疫组织化学方法检测MGMT的水平、利用PCR技术检测MGMT启动子甲基化状态及胞嘧啶-磷酸盐-鸟嘌呤岛(CpG岛)甲基化表型状态对高级别胶质瘤患者的预后判断具有参考价值。
形态学改变仍然是病理诊断的基础。胶质瘤分子生物学标记对确定分子亚型、个体化治疗及临床预后判断具有重要意义,但必须清楚现有的生物学标志物并不是特异或专门针对某一种类肿瘤,随着科学技术的发展一定会涌现出更多的生物学标志物,因此在临床诊断时,应使用数种生物学标志物来进行综合评估。目前,对胶质瘤进行分子生物学检测的常用方法包括免疫组织化学技术、荧光原位杂交技术(FISH)、聚合酶链反应技术(PCR)、DNA测序技术和比较基因组杂交技术(CGH)等,有条件的医院推荐使用以下生物学标志物对胶质瘤进行选择性检测。(1)强烈推荐:①对胶质瘤GFAP免疫组织化学标记。GFAP为胶质细胞特有的一种中间丝蛋白,广泛分布于星形胶质细胞质和突起内。具有向星形胶质细胞分化特征的胶质瘤及60%~70%少突胶质细胞瘤对GFAP呈阳性表达(Ⅰ级证据)。② IDH1基因第132位点的杂合突变出现于80%以上的低级别胶质瘤,包括星形细胞瘤、少突胶质细胞瘤和混合性少突星形细胞瘤以及继发性胶质母细胞瘤,IDH1突变型的预后明显好于野生型。因此,IDH1基因突变是病理诊断和预后评估的重要参考指标。目前,检测IDH1基因突变的表达产物mIDH1R132H的特异性抗体已经商品化,可通过免疫组织化学方法对胶质瘤进行标记和鉴别诊断(Ⅰ级证据)。③细胞增殖活性标志物Ki-67抗原对胶质瘤进行免疫组织化学检测。Ki-67抗原是一种细胞增殖的核抗原,主要用于判断肿瘤细胞的增殖活性,Ki-67抗原除G0期以外,表达在所有的细胞活动周期(G1、S、G2和M)中。研究表明Ki-67增殖指数与肿瘤的分化程度、浸润或转移及预后有密切关系,是判断肿瘤预后的重要参考指标之一(Ⅰ级证据)。④对少突胶质细胞瘤进行1p/19q LOH检测。1p/19q杂合性缺失的患者对烷化剂类抗肿瘤药物敏感,无瘤生存期延长(Ⅰ级证据)。目前,检测1p/19q杂合性缺失的方法有PCR、FISH和CGH等,有条件的医院可选择开展。(2)推荐:①Olig2为碱性螺旋-环-螺旋转录因子,调控少突胶质细胞发育和分化,主要表达在少突胶质细胞核,采用免疫组织化学技术与其他抗体联合使用,对鉴别少突胶质细胞瘤及星形细胞来源的胶质瘤具有一定的参考价值。②上皮膜抗原(EMA)广泛分布于正常上皮细胞膜及上皮或间皮来源的肿瘤中。在室管膜瘤中,瘤细胞核旁呈特征性的点状(dot-like)阳性表达。③星形细胞肿瘤p53蛋白免疫组织化学标记。TP53是一种抑癌基因,分为野生和突变二种亚型,其基因的表达产物p53蛋白存在于多种肿瘤组织中。TP53基因突变或缺失是导致肿瘤发生的原因之一。同时,p53蛋白也是细胞凋亡的调控因子。在星形细胞起源的胶质瘤或继发性胶质母细胞瘤中,TP53基因突变率达65%以上(Ⅱ级证据)。④表皮生长因子受体(EGFR)及其变异vⅢ(EGFRvⅢ)对高级别胶质瘤进行免疫组织化学标记,EGFR是原癌基因c-erb-B1的表达产物,其过表达和突变体均与肿瘤发生发展有密切关系。EGFR是一种跨膜糖蛋白,相对分子质量为170。EGFR突变一般发生在胞外区,极少发生在跨膜区和酪氨酸激酶区,这些突变体广泛存在于肿瘤细胞而在正常组织中不表达。目前发现3种EGFR胞外缺失突变体:EGFRvⅠ、EGFRvⅡ和EGFRvⅢ,其中以EGFRvⅢ最常见。由于EGFRvⅢ仅表达于肿瘤组织,采用特异性EGFRvⅢ单抗检测高级别胶质瘤,作为靶向治疗的突破口,已应用于临床(Ⅲ级证据)。⑤胶质母细胞瘤的MGMT检测。MGMT为一种DNA修复酶。烷化剂类抗肿瘤药物,例如:BCNU、CCNU、DTIC、Procarbazine、替莫唑胺的作用机制是通过DNA甲基鸟嘌呤O6位发生致死交联而使细胞凋亡。MGMT可以将烷基从DNA甲基鸟嘌呤O6位转移到半胱氨酸残基,从而修复DNA的损害。因此,细胞内MGMT的水平直接反映了它能耐受的DNA损伤的程度。一般认为,没有或低水平表达MGMT的肿瘤细胞对烷化剂类药物有反应。反之,则可能耐药。利用免疫组织化学方法,检测胶质瘤细胞MGMT活性,操作简单易行,在基层医院均可开展。但是,MGMT在正常神经元、胶质细胞、淋巴细胞和血管内皮细胞有广泛表达,需要有经验的神经病理医生进行观察和计数。此外,提倡检测MGMT启动子甲基化聚合酶链反应(MSPCR)与免疫组织化学方法相结合,结果更可靠,对临床进行疗效观察和预后判断有一定帮助(Ⅰ级证据)。可是,低级别胶质瘤的MGMT酶的水平与术后辅助治疗及临床预后无关(Ⅲ级证据)。⑥神经元特异核蛋白(NeuN)特异性地与趋于成熟的神经元细胞核的抗原结合,该抗体可以与中枢神经系统多种类型的神经细胞反应,包括来自小脑、大脑皮层、海马锥体神经元、丘脑和脊髓的神经细胞;也可与周围神经系统的神经元反应,包括来自脊神经节和交感神经节。采用免疫组织化学技术,抗原性主要定位于神经细胞的细胞核,特异性强,对判断肿瘤中的神经元成分具有重要意义,主要用于胶质神经元肿瘤及神经细胞瘤的诊断及鉴别诊断。⑦毛细胞型星形细胞瘤的KIAA1549-BRAF融合基因检测,BRAF是位于7q34的原癌基因,至今发现约有60%~80%的毛细胞型星形细胞瘤患者伴有该基因突变,被认为是毛细胞型星形细胞瘤的分子生物学的特征性改变。通过FISH或RT-PCR等方法对KIAA1549-BRAF融合基因进行检测,在低级别胶质瘤的鉴别诊断中能发挥一定作用。此外,最近发现BRAFV600E错义突变常发生于小脑外毛细胞型星形细胞瘤、多形性黄色星形细胞瘤及节细胞胶质瘤。
髓母细胞瘤是婴幼儿及儿童颅内最常见的肿瘤之一,根据2007年WHO中枢神经系统肿瘤分类将它分为经典型和4种变异型,不同的组织学类型其临床预后各不相同。近年来,随着对髓母细胞瘤组织发生学及分子遗传学的深入研究,发现在肿瘤发生和发展过程中某些信号转导通路的活化可能与患者的预后及治疗有关。目前,根据信号转导通路相关的分子生物学标记,可将髓母细胞瘤分成若干种分子亚型,这种分类对于临床制定更优化的治疗方案及准确判断预后具有重要意义(Ⅱ级证据),但还有待于临床病理大样本量的进一步验证。(1) Wnt型:在髓母细胞瘤中约有15%的患者存在Wnt信号通路激活,Wnt型髓母细胞瘤的发病年龄约6~13岁(平均年龄约10岁),病理组织学类型几乎均属于经典型,总体预后良好。Wnt型髓母细胞瘤的分子遗传学特征是6号染色体缺失、CTNNB1基因突变(编码β-Catenin),当Wnt信号通路激活时,细胞质内的β-Catenin不能被磷酸化,转移至细胞核内聚集并激活c-myc、cyclinD1和Axin2等致癌基因。目前,可通过免疫组织化学方法来观察β-Catenin在细胞核内的聚集情况,用于Wnt型髓母细胞瘤的筛选。(2) Shh型:在髓母细胞瘤中约有25%的患者存在Shh信号通路激活,Shh型髓母细胞瘤的发病年龄大多发生在3岁以下的婴幼儿或成年人,病理组织学类型以促纤维增生/结节型最常见,其次是伴有广泛结节形成型和大细胞/间变型,Shh型髓母细胞瘤的预后根据年龄及病理组织学类型而异,婴幼儿、促纤维增生/结节型或伴有广泛结节形成型的患者预后较好,大细胞/间变型患者预后差。Shh型髓母细胞瘤的分子遗传学特征是9号染色体缺失,PTCH、SMOH和SUFU基因突变,当Shh-PTCH信号通路激活时,导致GLI转录因子活化,使GLI蛋白通过抑制或激活靶基因进一步调控细胞的增殖和分化。目前,通过免疫组织化学方法来检测GLI1、GAB1、Filamin A及YAP1的表达情况,可用于Shh型髓母细胞瘤的筛选。(3)非Wnt/Shh型:在髓母细胞瘤中约有60%的患者属于非Wnt/Shh型,该类型髓母细胞瘤好发于儿童,平均发病年龄约为8岁,病理组织学类型大多属经典型及部分属大细胞/间变型,容易发生播散或转移,预后差。非Wnt/Shh型髓母细胞瘤的分子遗传学特征是17、18号染色体异常及女性患者X染色体缺失,c-myc、MYCN基因扩增,目前可采用NPR3、KCNA1的免疫组织化学检查来进行筛选,最近研究发现伴有c-myc扩增的患者预后极差;p53有阳性表达的患者容易发生播散或转移。虽然,根据分子遗传学特征提出了髓母细胞瘤的分子亚型,但在临床诊断和治疗过程中,应综合考虑临床、组织形态学及分子表型等多方面因素。对于婴幼儿大部分属于Shh型,因此组织形态学的分类显得比较重要,可将促纤维增生/结节型或伴有广泛结节形成型的患者设为低危组;经典型,无播散或远处转移的患者设为中危组;经典型伴有播散或远处转移的患者设为高危组。对于年龄在3岁以上的患者,能区分出各种不同的分子亚型有较大意义,在无其他预后不良因素时,包括术后残留肿瘤直径<1.5 cm以下、无播散或远处转移,可将Wnt型患者可设为低危组;Shh型患者可设为中危组;非Wnt/Shh型患者可设为高危组,当存在其他预后不良因素时,以上3组均变为高危组。成年人髓母细胞瘤DNA拷贝数的异常与儿童髓母细胞瘤有显著差异,大约有25%的成年人髓母细胞瘤无基因组异常。最近研究显示,成年人髓母细胞瘤常发生CDK6扩增,3、4、19号染色体异常及6号染色体部分缺失。成年人Wnt型髓母细胞瘤与预后无关,伴有CDK6扩增,10、17号染色体异常的成年人髓母细胞瘤预后较差。
非典型畸胎样/横纹肌样瘤是一种罕见的高度恶性的胚胎性肿瘤,绝大多数发生于5岁以下的儿童,其组织学形态及构成成分复杂,免疫表型多样化,容易发生播散或转移。非典型畸胎样/横纹肌样瘤具有独特的分子遗传学特征,表现为22号染色体单体或缺失,位于22q11的SMARCB1(INI1/hSNF5)基因杂合性缺失导致INI1蛋白表达丧失。目前,可采用BAF47/INI1的抗体,通过免疫组织化学方法来鉴别非典型畸胎样/横纹肌样瘤。
Kernohan和Daumas-Duport提出的4级分类法,主要是根据细胞的间变学说和组织学类型被WHO采纳。但是,沿用至今实践证明因观察者自身的喜好和观察侧重点的不一致性,存在着很大的主观性和片面性。(1)强烈推荐:以下7项是胶质瘤分级的基本原则,已被广大神经病理医师所接受[2](Ⅰ级证据)。①瘤细胞密度;②瘤细胞的多形性或非典型性,包括低分化和未分化成分;③瘤细胞核的高度异形性或非典型性,出现多核和巨核;④具有高度的核分裂活性;⑤血管内皮细胞增生(出现肾小球样血管增生);⑥坏死(假栅状坏死)⑦Ki-67增殖指数升高。Ki-67的单克隆抗体MIB-1可用10%甲醛包埋的标本。(2)以星形细胞起源的胶质瘤为例:①WHO Ⅱ级:偶见细胞核的非典型性,一般不出现核分裂象,MIB-1增殖指数<5%。②WHO Ⅲ级:细胞密度增高,具有明显的细胞核异形性和分裂象,MIB-1增殖指数5%~10%。③WHO Ⅳ级:具备以上6项,MIB-1增殖指数>10%。
在胶质瘤的病理诊断过程中,病理科医师应获取最大程度的肿瘤组织标本,并由神经病理专科医师参与复检,有条件的医院可开展分子病理学检查,具体流程见图1。
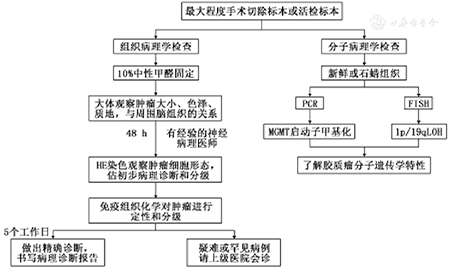

病理报告应包括以下内容:(1)简要的临床病史和神经系统体征;(2)肿瘤部位;(3)大体观察描写:包括肿瘤大小、性状、质地及与周边组织的关系;(4)组织形态学描写:包括细胞形态、分化特征及伴随改变;(5)根据实际情况,选择合适的标志物对肿瘤细胞进行免疫组织化学或分子遗传学分析。综合以上信息,做出准确的病理诊断、组织学类型及分级。
(1)安全全切肿瘤;(2)降低肿瘤细胞负荷,为辅助放化疗创造有利条件;(3)明确组织病理学诊断;(4)化疗药物筛选;(5)降低颅内压;(6)缓解神经功能障碍。
(1)肿瘤级别;(2)年龄(≤65岁比>65岁);(3)术前神经功能状况(KPS≥70比<70);(4)肿瘤切除程度(全切除比非全切除);(5)病灶部位和数量(额叶胶质瘤的预后优于颞叶和顶叶,脑叶胶质瘤的预后优于深部。病灶的部位和数量影响到肿瘤的可切除范围);(6)初发或复发(Ⅱ级证据;多个一致性Ⅲ级证据)。
(1)对于局限于脑叶的原发性高级别(WHO Ⅲ~Ⅳ级)或低级别(WHO Ⅱ级)恶性胶质瘤应争取最大范围安全切除肿瘤(强烈推荐)。胶质瘤通常呈膨胀性浸润性生长,但局部易受脑沟、脑回的限制,多沿白质纤维束走向扩展。基于胶质瘤膨胀、浸润性的生长方式及血供特点,推荐采用显微神经外科技术,以脑沟、脑回为边界,沿肿瘤边缘白质纤维束走向做解剖性切除,以最小程度的组织和神经功能损伤获得最大程度的肿瘤切除,并明确组织病理学诊断。(2)推荐对于:①优势半球弥漫浸润性生长;②病灶侵及双侧半球;③老年患者(>65岁);④术前神经功能状况较差(KPS<70);⑤脑内深部或脑干部位的恶性脑胶质瘤;⑥脑胶质瘤病,可酌情采用肿瘤部分切除术、开颅活检术或立体定向(或导航下)穿刺活检。肿瘤部分切除术具有比单纯活检术更高的生存优势。活检主要适用于邻近功能区皮质或位置深在而临床无法手术切除的病灶。活检主要包括立体定向(或导航下)活检和开颅手术活检。立体定向(或导航下)活检适用于位置更加深在的病灶,而开颅活检适用于位置浅表或接近功能区皮质的病灶。
在尽可能缩小肿瘤体积,降低肿瘤细胞负荷,并明确组织病理学性质后,实施个体化、规范化辅助放化疗。
(1)强烈推荐于手术后早期(<72 h)复查MRI,以手术前和手术后影像学检查的容积定量分析为标准,评估胶质瘤切除范围。高级别恶性胶质瘤的MRI的T1W增强扫描是目前公认的影像学诊断"金标准";低级别恶性胶质瘤宜采用MRI的T2W或FLAIR。(2)在不具备复查MRI条件的单位,推荐于术后早期(<72 h)复查CT平扫和增强。
影像引导外科新技术有助于实现最大范围安全切除恶性脑胶质瘤。推荐:常规神经导航、功能神经导航、术中神经电生理监测技术(例如,皮层功能定位和皮层下刺激神经传导束定位)、术中MRI实时影像神经导航。可推荐:荧光引导显微手术、术中B超影像实时定位、术前及术中DTI以明确肿瘤与周围传导束的空间解剖关系、术前及术中BOLD-fMRI以进行皮层功能定位。
(1)肿瘤切除程度是高级别恶性胶质瘤的独立预后因素之一,肿瘤全切除与手术后复发间期和生存时间密切相关(多个一致性Ⅱ级证据)。(2)目前倾向于认为最大范围安全切除肿瘤有助于延长低级别恶性胶质瘤的复发间期(Ⅱ级证据)。低级别恶性胶质瘤部分切除与全切除相比,病例复发风险是1.4倍,死亡风险是4.9倍(Ⅱ级证据)。但肿瘤全切除与手术生存时间的相关性研究还未获得Ⅰ级证据。(3)脑胶质母细胞瘤(GBM)术后早期MRI检查发现有肿瘤残余的病例死亡风险是无肿瘤残余病例的6.595倍(Ⅱ级证据)。(4) GBM大部切除术具有比单纯活检术更高的生存优势(Ⅲ级证据)。(5)活检的诊断准确率高于影像学诊断,但是受肿瘤的异质性、靶区选择等因素影响仍存在误诊率。一项回顾性分析显示,与开颅手术相比较立体定向活检的术后并发症较低(12.3%比3.7%),但误诊率高达49%(Ⅲ级证据)。另一项关于开颅手术切除比较立体定向活检治疗老年人HGG的随机对照研究显示[9](Ⅱ级证据),开颅手术切除肿瘤(包括全切除和次全切除)比立体定向活检可获得2.757倍的中位生存期(95%CI 1.004~7.568,P<0.05),但总收益有限,并且两者的恶化进展时间无明显差异。另有研究显示[10](Ⅲ级证据):活检的相关致残因素为:基底节损伤、丘脑损伤、糖尿病及手术当天的高血糖症。致残率为3.5%,致死率为0.7%,均与穿刺引起的出血有关。(6)恶性胶质瘤影像学全切除,有助于改善患者术后神经功能状况,并提高生存质量[11](Ⅲ级证据)。(7)高级别恶性胶质瘤达99%切除后,可以使肿瘤细胞负荷由109降低至107,术后辅助放化疗,有助于延长患者生存期(Ⅰ级证据)。(8)通过对恶性胶质瘤术后早期MRI的研究显示,术区周边环形强化主要与以下因素有关:①局部血脑屏障破坏;②肉芽组织增生;③血管自身调节功能紊乱引起的过度灌注。手术后72 h内复查MRI可以减少以上因素干扰,降低假阳性率。约80%的肿瘤复发灶源自于术后早期MRI检查发现的肿瘤残余部位(Ⅱ级证据)。(9)神经导航技术有助于提高胶质瘤的手术全切除率[12](多个一致性Ⅲ级证据)。功能神经导航可提高运动区恶性脑胶质瘤全切率,降低术后致残率,改善患者远期生活质量,并使患者术后死亡风险降低43.0%(Ⅱ级证据)。功能神经导航手术同样适用于皮层语言区和视觉区胶质瘤手术。分别采用常规MRI重建颅脑结构模型、fMRI-BOLD定位脑皮层功能区、DTI显示皮层下神经传导束,在明确病灶边界的同时精确定位邻近神经功能区。术中神经电生理监测技术是胶质瘤术中脑功能皮层和皮层下神经传导束定位的标准技术(Ⅱ级证据;多个一致性Ⅲ级证据)。已有研究采用术中神经电生理监测技术分别证实BOLD和DTI用于脑功能皮层和皮层下传导通路的可靠性[13](多个一致性Ⅲ级证据)。最新的术中MRI实时影像导航技术可以提高脑胶质瘤手术全切除率,改善临床预后。其有效性也已获得多个一致性Ⅱ级证据和Ⅲ级证据。
恶性胶质瘤术后放疗对生存有益。Kristiansen等[14]和Walker等[15]的2个多中心Ⅲ期临床试验结果表明:术后放疗组和支持治疗组生存时间分别为9和3.5个月;10.5和5.2个月,差异有统计学意义(Ⅰ级证据)。采用3D-CRT或IMRT技术可较好地保护正常脑组织,但其提高放疗剂量的效果在临床上尚未肯定。随着新一代烷化剂TMZ在治疗恶性胶质瘤中的作用,放疗和化疗的联合已经成为恶性胶质瘤的标准治疗。
术后早期放疗能有效提高恶性胶质瘤的疗效。研究表明:恶性胶质瘤患者生存时间与放疗开始时间密切相关(Ⅱ级证据)。目前常用的放疗总剂量为54~60 Gy,分割30~33次。Walker等[16]对按脑瘤协作组(BTCG)方案治疗的420例患者的数据进行了剂量-效应分析,总剂量从50 Gy提高到60 Gy时,治疗组患者的中位生存期也随之从28周延长至42周(Ⅰ级证据)。Bleehen等[17]分析了443例患者,同样显示总剂量60 Gy与45 Gy相比,生存期有明显的优势(12个月对9个月,P<0.01)(Ⅰ级证据)。
在一定的剂量范围内,增加肿瘤照射剂量并不能获益。多数研究表明,常规放疗总剂量>60 Gy,未显现益处。如美国肿瘤放射治疗组(RTOG)和东部肿瘤协作组(ECOG)将超过600例患者随机分成60 Gy和70 Gy组,中位生存期分别为9.3和8.2个月,差异无统计学意义(Ⅰ级证据)。但是少数研究显示高剂量具有益处,如Tanaka等[18]采用适形放疗分为60 Gy、70~80 Gy高剂量组,GBM的2年生存率分别为11.4%、38.4%;AA的2年生存率分别为44.1%、78.1%,5年生存率分别为14.7%、51.3%。在一项随机前瞻性试验中,Souhami等[19]分析了203例GBM患者,在常规放疗(60 Gy)辅以BCNU化疗后,比较接受和未接受立体定向放射外科(SRS)的疗效,照射剂量根据肿瘤大小从15~24 Gy不等,中位生存期未见显著差异(13.5和13.6个月)(Ⅰ级证据)。常见放疗加近距离放疗不增加疗效。如Laperriere等[20]报道,一组行外照射(50 Gy,25次,n=69),另一组为外照射后加125I立体定向植入,使肿瘤周围最低剂量达60 Gy(n=71)。中位生存期在两组差异无统计学意义(13.8和13.2个月,P>0.05)(Ⅱ级证据)。Selker等[21]报道的另一项随机前瞻性试验(Brain Tumor Cooperative Group National Institutes of Health)BTCG8701的结果,也支持以上结论(Ⅰ级证据)。
分割方式的改变对生存率无影响。2004年Carsten等[22]对超分割或加速超分割的21项临床研究进行了总结,结果均未显示改变分割方式较常规分割放疗有提高生存的优势(Ⅰ级证据)。许多研究也得出相似的结果(Ⅰ级证据)。
采用3D-CRT或IMRT技术提高放疗剂量在临床尚未显示一致的优势。Chan等[23]采用IMRT剂量达70~90 Gy,未见获益(Ⅱ级证据)。尽管3D-CRT或IMRT具有提高靶区适形度,更好地保护正常组织,可给予更高的放疗剂量,而且不增加周围组织危险的优势,但这些提高剂量方法的疗效尚未得到证实,在应用时应慎重。
总之,采用不同的方法增加照射剂量,改变剂量分割方式均不能确认从中获益。因此,目前仍强烈推荐采用常规分割的X线外照射,总剂量通常为54~60 Gy。
虽然GBM有广泛播散可能,但是多个研究仍推荐局部放疗。Kita等[24]报道:全脑放疗(WBRT)40 Gy并局部补量18 Gy和局部放疗56 Gy在生存时间上差异无统计学意义(Ⅰ级证据)。Phillips等[25]报道36例局部照射60 Gy/30次和32例全脑照射35 Gy/10次,中位生存期分别为10.3、8.7个月(P>0.05)(Ⅰ级证据)。
目前有关高级别胶质瘤放射治疗靶区的确定有争议,争议的焦点主要是最初的临床靶区(CTV1)是否需要包括瘤周的水肿区。RTOG推荐CTV1需包括瘤周水肿区外2 cm区域,给予46 Gy;缩野的CTV2需在GTV外扩2 cm,剂量至60 Gy[26]。欧洲癌症研究和治疗组织(EORTC)推荐的CTV设定并不强调一定要包所有瘤周水肿区。最新的Ⅲ期临床试验RTOG 0525/EORTC26052-22053的结果经COX分析显示:总生存时间(OS)与所采用的两种放疗靶区设定方法(EORTC/RTOG)无关[27]。最近两项关于GBM放疗靶区设定的研究表明,CTV1过大并不能减少射野边缘或野外复发率,反而会增加脑受照体积[28](Ⅱ级证据)。美国M D Anderson医院的设定方法是CTV1为GTV外扩2 cm,并不刻意去包全瘤周水肿区,照射剂量为50 Gy;而缩野的CTV则仅包括GTV外0.5 cm,给予10 Gy,结果:局部失败方式与RTOG设定方法相似(野边缘及野外复发均为10%),但明显减少了脑组织的照射体积。意大利Sant'Andrea医院提出一套类似于M D Anderson医院的靶区设定方法,CTV1也是在GTV外扩2 cm,若CTV1体积>250 cm3,则CTV1照射至50 Gy后缩野至GTV外1 cm(CTV2)剂量至60 Gy,其结果与M D Anderson医院一致。Sant'Andrea医院这套靶区设定方法已被欧洲几项多中心随机研究所采纳[29]。
(1) GBM:强烈推荐TMZ 75 mg/m2化疗同步放疗,继6个周期的TMZ化疗。在放疗中和放疗后应用TMZ,显著延长了患者的生存,这一现象在MGMT基因启动子甲基化的患者中最明显。同时也有文献报道,MGMT基因启动子甲基化的GBM患者其TMZ治疗效果受P53表达影响,因此在GBM综合治疗中要充分考虑分子遗传学的变化(参见本指南GBM化疗一部分)。(2) AA,AO,AOA:Ⅰ/Ⅱ期试验初步显示了TMZ在治疗WHO Ⅲ级肿瘤的作用(Ⅱ级证据)。1p和19q杂合性缺失的患者对化疗和放疗更敏感,预后更好已被研究证实。Li等研究表明,IDH1突变也影响AO、AOA的预后。但即使在这类患者中,仍未确定联合化放疗比单纯放疗有生存优势,目前研究TMZ、放疗、1p/19q三者关系的2项大型临床随机试验正在进行中。AA由于其生物学行为和GBM非常相似,治疗策略上可推荐STUPP方案(参照GBM)。AO、AOA应根据患者具体情况,包括一般状态、分子生物学标记、治疗需求等采用个体化治疗策略,治疗选择包括术后单纯放疗,放疗结合TMZ同步和(或)辅助化疗等。
胶质瘤经放和(或)化疗后,可出现多种影像学变化,如无进展,早期进展,假性进展,复发,放射性坏死等。(1)假性进展的定义:胶质瘤患者放疗后,特别是联合TMZ同步治疗后,常很快出现原有增强病灶体积变大,或出现新的增强病灶,但未经任何进一步治疗即可逐渐消退,由于这一表现在影像上酷似肿瘤进展,故称此现象为假性进展。(2)假性进展的临床特征:假性进展属于与治疗相关的反应,与肿瘤进展无关,发生率与放疗剂量有关。假性进展的发生多见于治疗结束后2个月内,且多无临床症状和体征,多数假性进展病变即使不予治疗也可缩小或保持稳定。(3)假性进展的发生率:缺乏MGMT的细胞对TMZ敏感性增加,同时有研究显示TMZ联合放疗时,MGMT低表达者假性进展发生率明显高于高表达者。TMZ联合放疗后假性进展发生率高于单纯放疗,单纯放疗后有9%的患者发生假性进展;而TMZ联合放疗则有21%~31%的患者出现假性进展。(4)鉴别:临床症状和体征的变化不能预测复发和假性进展。由于胶质瘤放化疗后包括假性进展、复发和坏死等多种反应的并存,使PW、MRS、PET等影像学检查有限。必要时应活检。(5)处理:对早期无体征和临床症状的进展性影像学病变,原则上应继续使用TMZ辅助化疗。如患者有明显临床症状,或增强病灶短期快速增大,应对症脱水治疗并考虑手术干预。
大脑胶质瘤病(GC)是少见的原发脑恶性肿瘤[30]。2007年WHO将GC归类于神经上皮组织肿瘤中的星形细胞肿瘤,确定GC的诊断标准为:一种弥漫性的胶质瘤,至少累及3个脑叶,通常双侧大脑半球和(或)深部脑灰质受累,可累及脑干、小脑、甚至脊髓。绝大部分GC呈现星形细胞表型,少数为少枝胶质细胞瘤和混合性少枝星形细胞瘤。GC通常是侵袭性肿瘤,绝大部分GC的生物学行为相当于WHO分级的Ⅲ级。GC的标准治疗并未确定,目前治疗主要依赖于放疗和(或)化疗。
手术仅用于GC诊断不明确时,进行活检。放射治疗作为GC的主要治疗手段,主要见于一些回顾性分析:接受放疗后中位生存为11~24个月[31,32]。M D Anderson医院回顾性分析了30例接受放射治疗的大脑胶质瘤病患者,发现87%的患者获得影像学改善或者稳定,70%的患者出现临床症状改善[31]。美国加州大学对22例患者进行了长达10年的随访,结果放疗和(或)化疗组与未治疗组间差异有统计学意义[33]。但是,仍需要进行多中心前瞻性临床试验来进一步明确放疗的作用。
目前有关GC放疗重要参数,如照射野和照射剂量的研究非常少。M D Anderson医院报道30例GC,局部野设计为异常区域外放2~3 cm,局部野与全脑照射在中位无进展生存时间和中位总生存时间方面差异均无统计学意义(均P<0.05)。且随访发现失败的部位仅在MRI的T2加权像上异常信号区域内。因此作者建议,在MRI的T2加权像异常信号区域外放2~3 cm作为局部照射野的靶区[31]。在照射剂量方面,多数研究采用局部总剂量54~60 Gy,或者全脑40~45 Gy[31]。M D Anderson医院采用平均照射剂量为54.9 Gy,高剂量组(>54 Gy)和低剂量组(≤54 Gy)的中位无进展时间和中位总生存时间均差异无统计学意义[31]。Kim等[32]也报道放疗的剂量(>55 Gy或≤55 Gy)生存期无差别。由于GC治疗体积较大,推荐剂量必须要考虑临床获益与放射毒性的平衡,因此平均剂量为55 Gy较为合适。
化疗是有效的治疗手段,部分研究结果甚至显示化疗作为一线治疗优于放疗。德国Glas等[33]分析了来自3个中心的12例GC患者,采用丙卡巴肼和CCNU联合化疗(PC方案)作为初始治疗,中位无进展生存时间和中位生存时间分别为16和37个月。基于该试验结果,作者又进行了Ⅱ期临床研究——NOA-05[34],这是首项关于GC的前瞻性多中心临床研究,对35例初治的GC患者采用PC方案化疗6个周期,8个月无失败生存率为50.3%,中位无进展生存时间为14个月,进展后12例患者接受了挽救性放疗,中位总生存时间为30个月,该试验的生存结果与法国(n=17)采用PCV方案的研究(中位PFS为16个月;中位OS为25.6~37个月)相似[35]。在化疗方案的选用上,目前也没有标准方案,常用的方案包括单药TMZ化疗、PCV或PC方案联合化疗,也有学者尝试用TMZ作为GC的一线治疗。Levin等[36]报道了11例采用TMZ作为初始治疗,客观反应率为45%,中位无进展生存时间为13个月,中位总生存时间为29个月。但是在一些关于GC的小样本研究中,采用TMZ获得令人失望的疗效[37]。一项仅有摘要的回顾性分析共纳入46例患者,中位PFS为9个月,中位OS为14个月。基于这些研究,德国的很多神经肿瘤中心优先采用PC而不是TMZ作为GC患者的初治方案[34]。有学者探讨化疗作为一线治疗的辅助治疗能否进一步提高疗效。如Kong等[38]回顾性分析了单中心45例GC患者,术后均接受了局部放疗,中位放疗剂量为58 Gy,19例接受辅助化疗(采用TMZ、PCV或亚硝脲类)的患者平均生存时间为24.2个月,而未接受辅助化疗的患者为13.1个月(P<0.05),无进展生存时间分别为16和6个月(P<0.01),作者认为放疗后辅助化疗可以提高GC患者的生存。
上述研究多为Ⅳ级证据的小样本回顾性分析,放化疗方案多样,很难从中得出明确结论。需要多中心的前瞻性临床研究,比较放疗和(或)化疗作为一线治疗的疗效,和其他高级别胶质瘤一样,综合治疗是GC治疗的发展方向。
低级别胶质瘤根据其病理类型分为WHO Ⅰ和Ⅱ级。WHO Ⅰ级的病理类型主要为毛细胞性星形细胞瘤,常见于儿童,小脑为好发部位,预后最好,其10年总生存率在80%左右。WHO Ⅱ级的病理类型主要包括弥漫性星形细胞瘤、少突-星形细胞瘤和少突胶质细胞瘤,成人多见,其预后因病理类型不同而变化较大,10年总生存率分别为17%~49%。手术是治疗LGG的重要手段,但对术后放疗的最佳时机和远期放射性神经毒性的风险一直存在争议。目前通常的做法是根据患者预后风险性高低来制订治疗策略。
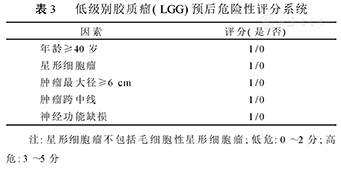
年龄、术前神经功能状态、病理类型、肿瘤大小和肿瘤部位是影响低级别胶质瘤预后的最重要因素[39](Ⅰ级证据)。Pignatti等对两项大型多中心随机研究(EORTC 22844和22845)进行分析,以EORTC 22844试验数据建立了临床预后因素模型,经EORTC 22845试验数据验证和证实,年龄≥40岁、星形细胞瘤、肿瘤最大径≥6 cm、肿瘤跨中线和术前神经功能缺损是独立的预后不良影响因素,按这些因素建立的低危组和高危组,其中位OS时间分别为7.7和3.2年(Ⅰ级证据),见表3。这一结果也被另一项大型多中心研究(Intergroup 86-72-51)所证实(Ⅰ级证据)。此外,1p和19q杂合性缺失(LOH)是少突来源的LGG患者预后较好的独立预后因素[40](Ⅰ级证据)。手术是LGG的首选治疗方法,许多回顾性研究表明肿瘤广泛切除具有明显的生存获益。NCCTG/RTOG/ECOG一项前瞻性Ⅲ期临床研究显示,肿瘤全切比次全切明显改善了5年总生存率(88%对56%,P<0.01)[41](Ⅰ级证据)。Sanai等[42]总结了1990至2007共10项关于LGG切除范围的研究,其中7项研究均显示肿瘤的切除范围是影响OS的独立预后因素,肉眼完全切除者的生存期比次全切除者平均延长了30个月(Ⅰ级证据)。
低级别胶质瘤(LGG)预后危险性评分系统
低级别胶质瘤(LGG)预后危险性评分系统
| 因素 | 评分(是/否) |
|---|---|
| 年龄≥40岁 | 1/0 |
| 星形细胞瘤 | 1/0 |
| 肿瘤最大径≥6 cm | 1/0 |
| 肿瘤跨中线 | 1/0 |
| 神经功能缺损 | 1/0 |
注:星形细胞瘤不包括毛细胞性星形细胞瘤;低危:0~2分;高危:3~5分
低级别胶质瘤手术切除后早期放疗还是观察曾存有不同的意见。目前,前瞻性随机对照研究显示术后早期放疗可明显延长患者的PFS,但对OS并无明显改善(Ⅰ级证据)。即使如此,对放疗的最佳时机迄今仍不清楚。在EORTC主持的多中心随机对照Ⅲ期临床研究(EORTC 22845)中,311例低级别胶质瘤术后患者被随机分为早期放疗组(即术后不超过8周给予放疗)和延迟放疗组(即术后选择观察,待肿瘤进展时给予放疗),结果显示早期放疗组的PFS比延迟放疗组延长了2年(5.3年对3.4年,P<0.01),癫痫控制率提高了16%(75%对59%,P<0.05),但两组OS差异无统计学意义(7.4年对7.2年,P>0.05)。尽管这个研究未能证明早期放疗可明显改善患者的总生存期,对患者的远期并发症也未作出评价,但至少阐明了以下两个问题:(1)由于肿瘤在复发或进展时,会使患者出现新的神经功能缺损症状,而术后放疗的早期介入,可明显延长肿瘤复发或进展的时间,这意味着也可明显延长患者发生神经功能缺损的时间,并可有效地控制癫痫的发作,提高患者的生活质量,这对于预后不良、生存期较短的患者尤为重要。(2)延迟放疗组有35%的患者在长达7.8年的中位随访期间一直无肿瘤进展,无需术后早期放疗,这个结果提示对于年纪较轻且预后较好的患者,可选择术后观察的方法,以避免发生远期放射性神经毒性的潜在风险。
强烈推荐低级别胶质瘤放疗的总剂量为45~54 Gy,其依据主要来自于以下两项大型前瞻性对比研究的结果。一项是EORTC的随机对照试验(EORTC 22844),379例低级别胶质瘤患者术后放疗被随机分为45 Gy组和59.4 Gy组,两组间5年OS(58%和59%)和PFS(47%和50%)均差异无统计学意义[43](Ⅰ级证据)。另一个随机对照试验是由NCCTG联合RTOG和ECOG完成的,203例低级别胶质瘤患者术后放疗被随机分为50.4 Gy组和64.8 Gy组,两组间5年OS差异无统计学意义(72%和64%,P>0.05),但高剂量组的2年严重放射性坏死发生率(5%)却高于低剂量组(2.5%)(Ⅰ级证据)。放疗分次剂量一般推荐为1.8~2.0 Gy,研究认为分次剂量超过2 Gy会增加低级别胶质瘤患者发生远期认知能力障碍的风险[44](Ⅱ级证据)。
由于大多数低级别胶质瘤的注射造影剂MRI图像不增强,因此确定其大体肿瘤靶区(GTV)主要是根据MRI FLAIR或T2图像上的异常信号区域[45]。对于术后患者应行MRI复查以确定肿瘤残留,并以此作为确定GTV的依据,而术前MRI则作为参考。绝大多数研究都是以GTV外扩1~2 cm边缘作为低级别胶质瘤的临床靶区(CTV)[41,43],以此定义的CTV放疗后,仅有8%的复发病变位于野外或野边缘(Ⅱ级证据);而CTV过大不但不能改善疗效[46],反而会增加迟发性神经毒性发生的风险[44]。研究显示,应用11C-蛋氨酸(MET)-PET/CT有助于确定低级别胶质瘤术后残留肿瘤的范围和监测治疗后的反应[47](Ⅲ级证据)。
与常规二维放疗相比,3DCRT和IMRT技术在靶区剂量的覆盖率、适形性及对正常组织保护方面均具有明显的优势,尽管目前尚未有证据显示3DCRT和IMRT可提高低级别胶质瘤的疗效,但临床随访结果表明,适形放疗可降低晚期并发症的发生率(Ⅱ级证据)。有少量回顾性研究应用立体定向放射外科(SRS)、立体定向放射治疗(SRT)和立体定向/组织间近距离治疗(SBT)技术治疗初发或复发的低级别胶质瘤,对不能手术切除或治疗后复发的小体积肿瘤显示出较好的疗效[48,49],但其疗效是否优于标准分割的适形放疗尚不清楚。由于SRS或SRT的分次剂量大,以及SBT累积剂量效应持续时间较长(>9个月),靶区周围正常组织和结构发生迟发性放射损伤的潜在风险较高,因此,临床上大都不推荐这些技术作为初发低级别胶质瘤手术切除后的首选治疗方式。
远期神经毒性主要表现为认知能力障碍和脑组织局灶性坏死。脑坏死被认为与放疗剂量有关,但使用LGG标准剂量治疗后很少发生[43]。而影响患者认知能力障碍的因素很多,包括放疗总剂量、分次剂量、照射体积、化疗药物、抗癫痫药物、肿瘤部位、肿瘤复发以及原先存在的神经系统病变等,这些因素之间是否存在相互作用还不清楚。因此,临床上很难区分患者的认知能力障碍是由放疗还是其他因素以及多种因素综合作用的结果。此外,由于认知能力障碍的发生率会随着治疗后时间的延长而逐渐增加,因此需要进行长期随访才能得出结论。最近,Douw等[50]通过长达12年的平均随访时间的追踪调查,发现接受过放疗的LGG患者的注意力逐渐下降,而那些没有接受过放疗的患者,其认知功能则保持稳定(Ⅱ级证据)。因此,在制订治疗计划时,还应充分考虑这种由放疗引起的远期风险。
一项随机对照研究(RTOG 9802)比较了单纯放疗与放疗后加PCV 6个疗程辅助化疗治疗初发高风险(肿瘤次全切除/活检或年龄≥40岁)WHO Ⅱ级胶质瘤患者的疗效差异,放疗+化疗可明显提高5年PFS(63%和46%,P<0.01),但未能改善OS(72%和63%,P>0.05)。进一步分析发现,辅助化疗具有延迟获益效应,即在治疗后的头2年里,两组的PFS和OS基本相似,而在2年后放疗+化疗能显著改善后3年PFS(74%和52%,P<0.01)和OS(84%和72%,P<0.05),但放疗+化疗组的3~4级毒性反应明显增加(67%和9%)(Ⅰ级证据)。TMZ对术后或治疗后进展的低级别胶质瘤有效,毒性也明显较PCV方案低(Ⅲ级证据)。延长低剂量TMZ用药时间较TMZ标准方案可能更有优势,尤其对于MGMT未甲基化的低级别胶质瘤患者,但可能会增加毒性反应(Ⅲ级证据)。
2007年WHO分类中,室管膜肿瘤被分为室管膜瘤(WHO Ⅱ级)、间变性(恶性)室管膜瘤(WHO Ⅲ级)、黏液乳头状室管膜瘤(WHO Ⅰ级)与室管膜下室管膜瘤(WHO Ⅰ级)4个类型。手术是室管膜肿瘤的首选治疗方法,手术的切除程度与预后呈正相关,完全切除的预后明显优于次全切除和其他治疗方式。放疗是术后辅助治疗的最重要手段,通常采用局部放射治疗。而对复发或年幼不宜行放疗的患者,可选择化疗作为辅助治疗,但是否延长生存仍不清楚。
室管膜瘤的初始治疗应首选最大程度地安全切除肿瘤,必要时可行二次手术。Rodríguez等[51]报道室管膜瘤接受手术(包括完全和部分切除)的10年生存率显著高于未接受手术病例(62.7%对48.6%,P<0.01),提示手术在室管膜瘤的治疗中起了重要的作用。室管膜瘤的预后与手术的切除程度密切相关,患者接受完全切除后生存显著优于接受不全切除者(Ⅲ级证据)。Merchant等[52]报道153例儿童室管膜瘤手术并术后放疗的长期结果,完全切除病例的7年EFS和OS分别为77.3%和88%,显著优于近全切除及次全切除病例(34.2%和52.4%,P<0.01)。WHO Ⅰ级的黏液乳头状室管膜瘤与室管膜下室管膜瘤,侵袭性低,多数可以通过单纯手术治愈。
推荐放疗是目前室管膜瘤术后最主要的辅助治疗,虽然缺乏临床随机研究的证据,但许多回顾性研究显示辅助放疗可显著提高了肿瘤控制以及生存率,5年生存率为33%~88%。对于间变性室管膜瘤,绝大部分的文献结论一致,认为术后辅助放疗应成为标准治疗(Ⅳ级证据)。然而,对于室管膜瘤,特别是接受了肿瘤完整切除的病例,放疗的作用仍有争议。Rodríguez等[51]对SEER数据库共2408例室管膜瘤病例做了分析,发现未行放疗是肿瘤部分切除患者的不良预后因素(HR 1.748,P<0.05),然而亚组分析发现,肿瘤完整切除后接受放疗并没有提高生存率,作者建议对于完整切除的室管膜瘤可予以观察,待复发后再行延迟放射治疗(Ⅳ级证据)。
放疗范围一直有争议。不少研究报道室管膜瘤病变累及脑脊髓的发生率相对较低,且局部放疗和全脑全脊髓放疗的疗效相当。Swanson等[53]报道44例接受术后放疗的室管膜瘤病例,有95%复发在瘤床,仅有5%出现脊髓播散,Vanuytsel等[54]回顾性分析了93例接受术后放疗的室管膜瘤病例,发现绝大部分死亡原因仍是原位复发,扩大野照射并没有提高无进展生存,作者推荐局部放疗。对于间变性室管膜瘤,早期有研究者推荐全脑全脊髓照射(CSI),或者全脑照射(WBRT)后,对于幕上离脑脊液通路较远且未发现软脊膜转移的病变予以局部加量。然而,随后的研究证实,局部复发是首要的失败方式,在没有局部复发情况下,脊髓种植很少见,接受局部或者全脑全脊髓放疗,两者的失败模式无显著差异。Vanuytsel等[55]报道间变性室管膜瘤接受CSI后出现脊髓转移率为9.4%(5/53),而未接受CSI者为6.7%(2/30),此结果提示,全脑全脊髓预防性照射可能并不能防止肿瘤的全脑和脊髓转移。其他类似的研究也认为,常规使用CSI或者WBRT并不能改善生存,因此,目前推荐对脊髓MRI和CFS检查均阴性的病例行肿瘤局部照射;对于上述检查阳性的病例,必须行CSI(Ⅳ级证据)。关于靶区的确定,研究显示切除范围扩大1~2 cm是安全有效的。Merchant等[52]报道了一项前瞻性Ⅱ期临床试验,受试者接受手术及术后三维适形放疗。CTV定义为肿瘤或者瘤床边缘外放1 cm,PTV为CTV外放0.5 cm。总剂量为54 Gy或59.4 Gy(85.6%患儿采用)。结果获得了很好的疗效,7年的局部控制率、无事件发生生存率(EFS)和OS分别为87.3%、69.1%和81%,该研究同时也报道了放疗的长期损伤,CRT与常规放疗相比显著降低了认知功能的损伤[56]。2011年NCCN指南推荐CTV为GTV外扩1~2 cm,颅内肿瘤局部剂量为54~59.4 Gy,分次剂量为1.8~2 Gy。
仅有的一项随机研究显示,室管膜瘤患者术后化疗无显著效果,但对于复发或年幼不宜行放疗的患者,化疗仍不失为重要的辅助治疗手段,尤其是<3岁的儿童室管膜瘤(Ⅲ级证据)。Grundy等[57]报道了一项前瞻性Ⅱ期临床试验,对于80例<3岁的室管膜瘤术后患者,先予以化疗,待出现局部复发时再予以放疗,取得较好的效果,5年OS和EFS分别为63.4%和41.8%,该研究提示辅助化疗对室管膜瘤有效,可以推迟幼儿接受放疗的时间以减少放疗损伤,但是否提高生存率仍不清楚。目前应用于室管膜瘤的化疗方案主要包括以铂类为基础的方案,或依托泊苷和环磷酰胺等(参见室管膜瘤化疗)。
髓母细胞瘤(MB)的主要治疗方法有手术、放疗和化疗。该病的绝大部分研究基于儿童,成人患者的研究非常少,且没有随机研究。因此应该根据患者复发的危险度分层,以选择辅助治疗。标准的照射方式为:全脑全脊髓放疗(CSI)+后颅凹加量。化疗在MB治疗中占有重要的地位,特别是对<3岁的低龄患儿,化疗通常是主要的辅助治疗。NCCN分组的因素为:大细胞或者间变性的髓母细胞瘤、幕上PNET、肿瘤播散、无法切除的肿瘤或者术后残留肿瘤>1.5 cm2。CSI不可避免地产生以生长发育迟缓和内分泌障碍为主的后遗症,特别是对低龄患儿更为突出,在不降低肿瘤控制和患者的远期并发症可接受的同时,选择合适的照射剂量和化疗方式,是目前研究的重点。
一致意见认为手术应作为常规首选治疗,以明确诊断,减轻症状以及尽量提高肿瘤局部控制,同时应该根据影像学和手术资料按修正的Chang系统进行分期,并根据肿瘤复发的危险度分层,以选择辅助治疗。MB放疗敏感,脱落肿瘤细胞易随脑脊液播散转移,全脑全脊髓+后颅凹加量照射是标准的治疗方式被强烈推荐(Ⅰ级证据)。为更准确地评估肿瘤切除程度,术后MRI平扫+增强检查应在24~72 h进行,脊髓MRI平扫+增强检查建议在术后2~3周后,以避免手术的干扰。
患者在辅助治疗前应根据复发的危险度分层,以选择辅助治疗。包括一般风险组和高风险组。一般风险组:(1)年龄>3岁;(2)术后肿瘤残留<1.5 cm2,肿瘤局限在后颅凹,无远处转移;(3)蛛网膜下腔无播散,无中枢外血源性转移(M0,表4);三者同时具备。高风险组:(1)年龄≤3岁;(2)术后肿瘤残留:≥1.5 cm2;(3)任何肿瘤远处播散和转移的证据;三者有一即为高风险。

髓母细胞瘤转移的分期
髓母细胞瘤转移的分期
| 分期 | 转移情况 |
|---|---|
| M0 | 无蛛网膜下腔或血行转移 |
| M1 | 镜下发现脑脊液有肿瘤细胞 |
| M2 | 小脑、大脑蛛网膜下腔或第三、四脑室的结节状或片状种植转移 |
| M3 | 脊髓蛛网膜下腔的结节状或片状种植转移 |
| M4 | 脑和脊髓外转移 |
有2种治疗方式:CSI剂量30~36 Gy+后颅凹加量至55.8 Gy,或CSI剂量23.4 Gy,后颅凹加量至55.8 Gy,放疗同时单药长春新碱每周化疗1次,并放疗后行多药联合化疗(参见指南相关化疗内容)。CSI所导致的后遗症主要表现为:绝大多数生存患者有明显生长迟缓和内分泌障碍,主要与垂体腺和下丘脑受照和剂量有关,但引起上述不良反应的具体剂量尚不清楚。Thomas等将126例一般复发风险组的MB患儿随机分为2组,CSI减量组接受CSI剂量23.4 Gy/13 F的照射;常规剂量组接受CSI剂量36 Gy/20 F的照射,所有患者在接受CSI后均对后颅窝加量至54 Gy。中期分析发现:减量组复发的比率明显增加,从而中止了临床试验,终期分析显示,减量组5年无复发生存率为52%,标准剂量组为67%(P<0.05)。研究者认为单纯降低CSI的剂量将增加早期复发率,并降低5年无复发生存和总生存(Ⅱ级证据)。
通过CSI减量放疗,以期达到控制肿瘤生长的同时减少认知的不良反应,在低龄儿童更重要。3岁以上的儿童剂量为23.4 Gy/40 d内完成,后颅窝加量54~55.8 Gy。同时单药长春新碱每周化疗1次,放疗后行多药联合化疗(长春新碱+顺铂+洛莫司汀即甲基CCNU或顺铂+长春新碱+异环磷酰胺),5年PFS达80%以上(Ⅰ级证据)。Oyharcabal-Bourden等[58]研究了136例3~18岁患者,术后先行4周期以依托泊苷+卡铂为主的化疗,在术后90 d后行放疗,后颅凹的剂量为55 Gy,全脑全脊髓的剂量为25 Gy。中位随访6.5年,该研究结果表明5年总生存率达到了73.8%,而5年无复发生存率也到达了64.8%。Ris等[59]对减量放疗联合化疗能否减少中枢神经系统的损伤进行了研究,43例一般危险组患儿术后接受CSI剂量23.4 Gy和32.4 Gy的后颅凹加量,然后接受辅助化疗,长期随访发现,患者认知能力指标与标准剂量CSI的历史数据对照,均有提高。
后颅凹加量时的照射靶区和总剂量:一项对一般危险度的MB患者的多中心前瞻性研究显示:CSI剂量23.4 Gy,全后颅凹36 Gy,原发灶加量至55.8 Gy的照射模式,仍可获得很好的肿瘤控制。Garton等[60]比较了标准的治疗方案与仅后颅凹+全脊髓照射时的疗效,结果后者近90%失败。Tarbell等[61]报道了后颅凹剂量<53 Gy与>53 Gy的治疗研究,结果局部复发率分别是50%±13%和18%±7%,差异有统计学意义,显示减少后颅凹的照射剂量可导致肿瘤局部复发率增高。
强烈推荐:CSI+后颅凹加量,CSI剂量36 Gy/20 F,后颅凹加量至55.8 Gy。大多研究认为,术后放疗联合化疗能提高高风险组患者的无瘤生存率。1990年Tait等[62]报道了欧洲15个国家46个治疗中心的多中心前瞻性随机分组研究,286例髓母患者随机分为手术+放疗组和手术+放疗+化疗组,结果显示后者无瘤生存率高于前者,两者差异有统计学意义,但后组出现了晚期复发,对一些手术残留较多的高危患者还是有生存优势。Rutkauskiene等[63]对18例3~18岁的高危患者,CSI 30 Gy后颅凹加量至56~60 Gy;同步化疗使用VCR 1.5 mg/m2(最高2 mg),1次/周;放疗结束后6周继续化疗,CCNU+ DDP+VCR方案治疗8周期。完全缓解(CR)率:放疗组33.3%,放化疗结合100.0%。复发率分别为100%和11.1%,中位生存时间为17和47个月,2年PFS分别为0%和88.9%。Evans等[64]将233例MB患者随机分为2组,一组术后单纯放疗,一组放疗同时联合CCNU+VCR+泼尼松化疗,结果5年无事件生存率在单纯放疗组50%,放疗联合化疗组59%,两组差异无统计学意义,但分层分析发现,对于高危险组的MB患者,联合化疗组的5年无复发生存率为48%,而单纯放疗组的则为0%,提示对于高危组患者,术后放疗联合化疗是必要的。Packer等[65]研究了63例儿童高危组MB患者,所有患者均接受术后CSI和后颅窝加量照射,放疗完成后接受CCNU+卡铂+VCR方案的化疗,5年无进展生存率全组为85%。以上研究表明,手术+放疗+化疗能够提高高危患者的无进展生存率,可能成为标准治疗方案(Ⅲ~Ⅳ级证据)。
由于采用常规二维照射技术的毒副反应较大,一些研究者采用三维适形技术或调强技术减少照射体积。Fukunaga-Johnson等[66]研究了5例患者耳蜗的剂量分布,所有患者接受36 Gy的CSI,并对后颅窝加量18~20 Gy。结果表明,采用三维适形技术患者的耳蜗部位被65%的等剂量曲线包绕,而常规二维照射技术耳蜗剂量可高达101%。Huang等[67]采用IMRT技术对后颅窝加量,患者随机分为常规放疗组和IMRT组,结果IMRT组中13%患者有3~4度的听力损害;常规放疗组64%患者3~4度的听力损害。目前认为三维放疗较常规固定野照射技术有以下优势:减少了筛板区的漏照和低剂量区所导致的复发;可以减少脑干、颞叶、内耳、下丘脑-垂体和甲状腺等的照射剂量;在减少正常组织受照射量的前提下,可以提高肿瘤床的剂量来进一步提高疗效。
低龄儿童的治疗:与较大年龄儿童相比,婴幼儿MB的生存率不佳。低龄时接受过CSI,不论是否行化疗,获得长期生存的患者可见到严重的持续存在的后遗症,实际是不可接受的。如何利用术后化疗替代或推迟放疗,成为研究重点。有研究表明,肿瘤局限的3岁以下患儿术后单纯化疗与年长儿术后放化疗的生存率相近。Rutkowski等对43例3岁以下MB患儿进行术后单纯化疗,肿瘤无转移者5年总生存率为93%,有转移者为77%,患儿平均智商降低但仍明显高于术后放疗组,表明单纯术后化疗对无转移的婴幼儿有重要意义(Ⅳ级证据)。
近来国际大组随机对照试验(RCT)提示辅助化疗能增加恶性胶质瘤患者的生存时间[29]。国内学者也报道成人恶性胶质瘤患者在手术后同步放化疗组生存率明显优于单纯放疗组。利用化疗可以进一步杀灭实体肿瘤的残留细胞,有助于提高患者的无进展生存时间及平均生存时间。综上所述,化疗在恶性胶质瘤治疗中的作用目前越来越被重视。
(1)绝大多数化疗药物作用于分裂活跃的肿瘤细胞,且遵循一级药代动力学原则,即每次化疗药物只能杀灭一定数量的肿瘤细胞。当肿瘤体积较小时,分裂细胞的比例最大,化疗效果最好。因此,在化疗前,应在保留脑功能的前提下,尽量切除肿瘤,以减轻肿瘤负荷。(2)术后尽早开始化疗,并可与放疗同步进行化疗,以取得较好的肿瘤控制结果。(3)联合化疗。因为胶质瘤的瘤内异质性,使得一个实体病灶中含有药物敏感性不同的亚克隆。因此选择作用机制不同及毒性不重叠的药物进行联合化疗,可提高疗效。(4)充分化疗,采用最大耐受化疗剂量并以尽可能短的间歇期以获得最佳的治疗效果(剂量密度原则)。(5)合理的化疗疗程,并注意保护患者的免疫力。(6)根据病理诊断和分子标志物检查结果,选择化疗药物。(7)某些抗肿瘤药物(如BCNU、顺铂)可能会导致抗癫痫药物的血清浓度降低,而诱发癫痫发作;因此要注意化疗药物、抗癫痫药物的相互影响。(8)由于抗癫痫药物诱导肝酶活性增强,降低了某些经P-450肝酶途径代谢的抗肿瘤药物的血清浓度(如伊立替康、洛莫司汀、长春新碱、他莫昔芬、紫杉醇、依托泊苷);因此,在应用这类抗癫痫药物时,应酌情调整化疗药物的剂量。
目前恶性胶质瘤的主要化疗药物有:(1)亚硝脲类:代表药物为洛莫司汀(CCNU),卡莫司汀(BCNU),以及欧洲及日本的尼莫司汀(ACNU)。亚硝脲类具有高脂溶性及良好的血脑屏障穿透力。该类药物主要使肿瘤细胞DNA在多位点烷基化,导致DNA交联并发生单链或双链断裂以及谷胱苷肽耗竭,最终抑制DNA修复及RNA合成。该类药物的主要毒副作用为骨髓抑制,这种毒性是延迟的和蓄积性的,且有不可逆的肺纤维化。在TMZ作为一线标准化疗方案之前,亚硝基脲类单药或联合方案如PCV方案常用于恶性胶质瘤的一线化疗。(2)替莫唑胺(TMZ):是甲基化药物,亦被认为是二代烷化剂,是恶性胶质瘤化疗的一线药物。该药口服吸收后自动分解并形成有活性的5-(3-甲基三嗪-1-基)咪唑-4-酰胺(MTIC),MTIC进一步分解为5-氨基-咪唑-4-酰胺(AIC)与重氮甲烷,重氮甲烷被认为是活性的烷基化物质,其细胞毒性是对DNA甲基化,甲基化发生主要在鸟嘌呤O6和N7位置,导致错配系统修复失败,使得DNA子链有缺口形成,最终阻碍DNA复制启动而致细胞凋亡。该药透过血脑屏障较好,脑脊液的药物浓度几乎是血浆浓度的30%。本药的代谢物主要通过肾脏排泄。本药可以单药化疗亦可进行联合化疗及与放疗同时进行。本药的主要毒副作用为恶心、便秘、疲乏以及中度的骨髓抑制,该骨髓抑制是非蓄积性的,一般1~2周内即可恢复。(3)丙卡巴肼(PCBZ):是一种口服烷化剂,在肝酶的代谢下生成中间体再生成活性产物氧化偶氮甲基化合物,后者使DNA甲基化从而抑制细胞分裂。本药虽可进行单药化疗,但多为联合化疗PCV(PCBZ+CCNU+VCR)的组成部分。本药的主要毒副作用为骨髓抑制、恶心、疲乏和皮疹。(4)长春碱及鬼臼毒类药物:长春碱类主要来源于长春花植物(夹竹桃科),其的代表药物有长春新碱(VCR)和长春碱(VLB)。该类药物是细胞周期特异性化疗药物,本药主要作用于微管蛋白,阻止聚合作用和诱导细胞分裂中期停顿。本药常用于联合化疗,是PVC化疗方案的化疗药物之一。该类药物有一定的外周神经毒性。在鬼臼毒类化疗药中,代表药物为替尼泊苷和依托泊苷。替尼泊苷是鬼臼毒的半合成衍生物,为高度脂溶性药物,分子质量小易通过血脑屏障,且毒性较低,替尼泊苷主要作用于DNA拓朴异构酶Ⅱ,其作用机制是通过干扰DNA拓扑异构酶Ⅱ使得DNA单链和双链断裂,诱导肿瘤细胞停滞在G2期,另外该药还与微管蛋白结合阻止微管形成。本药多作为联合化疗的一部分。主要的毒副反应为消化道和血液毒性。在喜树碱类化疗药物中,代表药物是伊立替康及拓扑替康。喜树碱类药物是通过抑制细胞存活中一种必需酶DNA拓朴异构酶Ⅰ(Topo Ⅰ)来实现其细胞毒作用的。研究表明,多种肿瘤细胞(包括胶质瘤细胞)的拓扑酶Ⅰ(Topo Ⅰ)含量高于正常组织,尤其在S期肿瘤细胞中活性大幅提高。伊立替康使拓扑异构酶Ⅰ失活,引起DNA单链断裂,阻碍DNA复制和RNA合成,最终抑制细胞分裂。本药物主要剂量限制性毒性为迟发性腹泻与中性粒细胞减少。少数患者出现急性胆碱能综合征。(5)铂类抗肿瘤药物:代表药物为顺铂及卡铂,属细胞周期非特异性药物,具有细胞毒性。其在细胞低氯环境中迅速解离,以水合阳离子的形式与生物大分子结合,主要靶点为DNA,可形成DNA链内交联、链间交联、DNA-蛋白质交联,破坏DNA的复制及抑制肿瘤细胞的分裂。与蛋白的结合可致蛋白交联和构象改变,影响膜结构;与膜磷脂作用可改变其构象,影响膜流动性、通透性;药物还可结合胞内金属硫蛋白等及谷胱甘肽等小分子,抑制酶活性;药物与骨架蛋白作用影响微丝、微管自组装过程可抑制癌细胞的DNA复制过程,并损伤其细胞膜上结构,该类药物有较强的广谱抗癌作用,为治疗多种实体瘤的一线用药及二线用药(如针对复发胶质瘤)。肾毒性是顺铂的剂量限制性毒性,临床可采取水化、利尿剂稀释尿液和使用巯基化合物减小肾毒性损害;顺铂的另一剂量限制性毒性是神经损伤。铂类药物的另一常见不良反应表现为胃肠道反应,用5-HT 3受体拮抗药昂丹司琼、格拉司琼等以及地塞米松可明显减轻恶心、呕吐症状。(6)以VEGF为靶标的分子靶向药物:贝伐珠单抗(Bevacizumab,阿瓦斯汀Avastin):本药治疗新发胶质瘤尚无循证医学依据,在复发胶母细胞瘤及复发性间变性胶质瘤治疗中已被美国食品药品管理局(FDA)批准,并被美国国家综合肿瘤网(NCCN)指南推荐(具体参见本指南《复发的治疗与随访》章节)。
(1)化疗与放疗同步进行:2002年的一项高质量的荟萃分析指出化疗和放疗同步进行可以为患者带来益处:联合治疗的患者比单纯放疗患者的中位生存时间延长2个月,同时2年生存者的比例也提高了5%(Ⅰ++级证据)。相似的结果早在1993年便被证实[68](Ⅰ-级证据)。2005年由Stupp等组织的一项大规模RCT发现,TMZ联合放疗较单纯放疗可延长患者中位生存时间2.5个月,同时2年生存者的比例提高了16%,5年生存者的比例由2%提高至9.8%[29](Ⅰ++级证据)。同年的由Athanassiou等[69]组织另一项RCT也证实TMZ联合放疗较单纯放疗可明显延长多形性胶质母细胞瘤患者生存时间(从7.7个月延长到13.41个月)。没有足够的证据表明联合治疗中采用多药化疗方案要比单药方案要好。1998年一项RCT指出,采用多药方案的患者生存概率似乎较单药方案的患者要大,但是两者差异无统计学意义[70](Ⅰ+级证据),故不提倡多药方案。Shapiro等[71]也没有发现BCNU单药和以BCNU为基础的多药方案之间的区别(Ⅰ+级证据)。同样,Chang等[72]和Prados等[73]也没有发现差异(Ⅰ-级证据)。(2) TMZ:对于新诊断的GBM患者,强烈推荐TMZ同步放疗联合辅助化疗方案(2个RCT支持,1个Ⅰ++级证据1个Ⅰ-级证据),该方案被NCCN指南、加拿大GBM共识、英国卫生与临床优秀成果研究所(NICE)以及澳大利亚成人胶质瘤临床诊疗指南推荐,目前被认为是新诊断的多形性胶质母细胞瘤的标准治疗方案。国内学者也发现了类似的结果(Ⅲ级证据)。该方案具体是:放疗的整个疗程应同步化疗,口服TMZ 75 mg/m2,疗程42 d。应在放疗前约1 h给药;放疗过程中,在不接受照射日仍应按照相同时间用药。放疗结束后4周,辅助TMZ治疗,用药方法:150 mg/m2,连续用药5 d,28 d为1个疗程,同时检测血液系统指标,若耐受良好,则增量至200 mg/m2。一般在3个疗程的辅助化疗后应该进行临床和影像学的评估,若有假性进展,则推荐继续服药至6个疗程。对于治疗中有持续改善的患者可以考虑延长治疗周期。若3个疗程后有复发,则建议再手术或改用其他化疗方案。一项荟萃分析表明,TMZ用于恶性胶质瘤患者主要有以下益处:①延长生存时间;②延长肿瘤无进展期;③对生活质量没有明显的负面影响;④较低的早期不良事件发生率。TMZ的不良反应有:恶心、呕吐、脱发、皮疹、疲劳、便秘、白细胞、红细胞、血小板减少、抽搐、虚弱和肝功能异常等。由于恶性胶质瘤患者的生存期总体上较短,故目前尚无长期毒副作用的文献报道。对于高龄的恶性胶质瘤患者,有研究指出TMZ也有益处。Brandes等[74]发现对于65岁以上GBM者,放疗联合TMZ比单独放疗或放疗联合甲基苄肼有明显的生存益处(Ⅲ级证据)。Glantz等[75](Ⅲ级证据)也发现年老患者使用TMZ与标准的分次放疗同样有效。新近挪威胶质瘤临床试验组发起了一项对>60岁老年胶母细胞瘤患者进行5/28标准方案化疗对比放疗的Ⅲ期临床试验,2010年公布的结果表明,两者的治疗效果大致相当[76]推荐对于间变性星形细胞瘤术后辅以化疗(如类似GBM的TMZ方案,ⅡB证据),但是目前尚无大规模的随机对照研究的结果。(3) PCV方案:间变性少突胶质细胞瘤和间变性少突-星形细胞瘤化疗要比恶性星形细胞瘤敏感。这些肿瘤患者若有染色体1p 19q的联合缺失,则对PCV化疗方案(洛莫司汀110 mg/m2,d1+甲基苄肼60 mg/m2,d8~21+长春新碱1.5 mg/m2,d8,29)反应率要明显高于1p 19q未缺失者(100%对23%~31%)。两项大规模的Ⅲ期临床试验推荐放疗后使用PCV方案进行化疗(Ⅰ级证据)。虽然目前关于间变性少突胶质细胞瘤和间变性少突-星形细胞瘤的化疗都采用PCV方案,但TMZ因为不良反应少也备受重视,但有关TMZ在Ⅲ级胶质瘤的RCT目前仍在进行中,且尚没有PCV和TMZ之间比较的研究结果。不推荐对初发的恶性间变性室管膜瘤进行化疗,仅在复发时可以考虑化疗。(4)亚硝脲类化疗药物:Stewart对12项RCT分层荟萃分析结果表明,对高级别胶质瘤患者进行化疗可以延长生存期(Ⅰ++级证据)。Wolff等对504项队列研究,共24 193例患者(72%为GBM,22%为间变性星形细胞瘤)分析,结果以尼莫司汀(ACNU)为基础的化疗中,患者生存受益为8.9个月,以洛莫司汀(CCNU)化疗的患者生存受益为5.3个月。提示,以ACNU及CCNU为基础的化疗效果优于以BCNU为基础的化疗。德国肿瘤协会神经肿瘤研究组的随机对照临床试验[77](Ⅰ级证据),以亚硝脲类药物为主的联合化疗,GBM的全组平均OS为16.5个月,而间变性胶质瘤为60个月,上述结果明显优于以往肿瘤放射治疗研究组(RTOG)结果。亚硝脲类化疗药物进行恶性胶质瘤化疗的具体用法是:①PCV方案(洛莫司汀+甲基苄肼+长春新碱);8周为1个疗程,不超过6个疗程。口服CCNU 110 mg/m2,d1;每日口服甲基苄肼(PCB)60 mg/m2,d8~21;静脉给药长春新碱(VCR)1.4 mg/m2(最大剂量2 mg),d8,d29。②ACNU方案:ACNU单药治疗方案:ACUN静脉用药100 mg/m2,每6周为1个疗程,不超过6个疗程。该方案目前已较少应用。ACNU联合用药方案:每6周为1个疗程,共4~5个疗程。ACNU静脉用药90 mg/m2,D1;替尼泊苷(teniposide,VM-26),每日静脉用药60 mg/ m2,d1~3。(5)化疗局部应用:局部瘤腔植入的含卡莫司汀(BCNU)的生物可降解聚合物(Gliadel Wafer,美国Guilford公司),一项随机对照的Ⅲ期临床试验显示,对新诊断的恶性胶质瘤患者平均生存时间从11.6个月提高到13.9个月(Ⅰ+级证据)。该移植片能在肿瘤切除术后的数周内缓慢释放,从而杀灭残留的肿瘤细胞。这个临床试验入组的患者随后又被长期随访验证发现有着较好的预后[78](Ⅲ级证据)。英国的NICE指南提出该移植片仅仅用于肿瘤切除程度在90%以上[3]。目前国际上尚无BCNU移植片和TMZ口服的大规模随机对照研究[3],由于该移植片尚未在我国上市,故还没有其对国人安全性和有效性的报道。(6)动脉用药和骨髓移植:一项RCT研究表明,动脉使用BCNU对恶性胶质瘤进行化疗既无效又不安全。与静脉使用该药相比,动脉内化疗反而缩短了生存期(Ⅰ+证据)。但亦有通过动脉介入方法给药也取得了较好的效果的报告(Ⅲ级证据)。国内学者采用选择性动脉介入方法,用BCNU或ACNU灌注治疗高级别胶质瘤,取得了较满意结果[79](Ⅳ级证据)。但这些阳性结果尚无大规模随机对照研究结果的支持,并且费用高、技术要求也高,目前不建议推广。目前没有证据表明高剂量化疗时需要常规辅助自体骨髓移植。通过对22例患者的研究,Mbidde等[80]发现高剂量化疗时辅助自体骨髓移植能稍微延长生存时间,但是长期生存者的比例似乎没有增加(Ⅱ级证据)。Fine和Antman[81]也指出自体骨髓移植没有充分的证据支持(Ⅳ级证据),在此指南中也不推荐常规使用。(7)基因标志物:MGMT是一个重要的DNA修复酶,其与烷化剂的耐药有关,近年来研究证实MGMT活性是影响预后的重要指标。MGMT启动子的甲基化能沉默该基因,降低DNA修复能力,从而使肿瘤细胞对TMZ更敏感。一项随机化研究指出同样使用TMZ的GBM患者,若MGMT启动子有甲基化,则其中位生存时间明显长于无启动子甲基化的患者(21.7个月对12.7个月,Ⅰ级证据)[29]。放射肿瘤治疗组新近完成的全球多组中心临床药物研究(RTOG 0525)结果进一步证实MGMT启动子甲基化的重要性。我们在这里推荐有条件的单位尽快开展MGMT启动子的甲基化PCR检查,以便更好地开展恶性胶质瘤的个体化化疗。间变性少突胶质细胞瘤和间变性少突-星形细胞瘤有染色体1p 19q联合缺失者,不但对化疗敏感,而且生存期也明显延长。
以往低级别胶质瘤的化疗一直存在争议。随着新化疗药、肿瘤分子遗传学研究的深入和RCT的开展,化疗在低级别胶质瘤患者中的作用得到重视。
Pignatti等对两项大型多中心随机研究进行分析,以EORTC 22844试验数据作为基础建立了临床预后因素模型,用EORTC 22845试验数据对其验证并得到证实。多因素分析显示:年龄≥40岁、星形细胞瘤、肿瘤最大径≥6 cm、肿瘤跨中线和术前神经功能缺损是预后不良的独立影响因素,并以这些因素建立预后危险性评分系统,按分数高低分为低危组(0~2分)和高危组(3~5分),两组的中位OS分别为7.7和3.2年。对于低级别胶质瘤如能做到手术全切除,预后较好的低危患者则可以观察,但由于半数患者最终会继续进展,所以须密切随访。推荐术后对低级别胶质瘤的高危患者进行放疗和化疗。对肿瘤进展和复发的患者,能手术的患者应再次手术。以往没有进行放疗的患者可以选择放疗,已经行放疗的患者应进行化疗。如果化疗后肿瘤继续进展,需考虑:(1)选择另一种化疗方案;(2)考虑再次放疗;(3)更好的支持疗法。
紫杉醇、CPT-11、顺铂、卡铂、替尼泊苷、PCV和TMZ对低级别胶质瘤有效。在TMZ应用于临床之前PVC曾是低级别胶质瘤化疗的首选。TMZ具有肯定的疗效,不但可以延长患者的无进展生存期和总生存期,而且有助于癫痫的控制,提高患者的生活质量,因此推荐TMZ作为低级别胶质瘤化疗的首选药物。对于初治的低级别胶质瘤高危患者,贯序接受放疗和化疗是否能够提高无进展生存期和总生存期,高级别循证医学证据不多。对于复发低级别胶质瘤患者卡铂和替尼泊苷可以提高治疗的总体疗效。
在低级别少突胶质细胞瘤患者中,1p/19q缺失者对化疗有相当高的反应率,且70%的少突胶质细胞瘤和50%少突星形细胞瘤可检测到1p/19q的联合缺失。因此推荐有条件的单位进行1p/19q的检测,若联合缺失者可以先化疗。IDH1基因第132位点的杂合突变出现于80%以上的低级别胶质瘤,包括星形细胞瘤、少突胶质细胞瘤和混合性少突星形细胞瘤以及继发性胶质母细胞瘤,IDH1突变型对治疗的反应及预后明显好于野生型。但目前尚无充足的证据提示IDH1/IDH2突变对化疗的指导作用。
1988年有报道使用PVC对少突胶质细胞瘤有效,并将PVC作为首选化疗药物(Ⅳ级证据);此后紫杉醇、CPT-11、顺铂、卡铂、替尼泊苷、PCV或TMZ相继应用于临床。1993年美国东南部肿瘤协作组比较了未能全切除的低级别胶质瘤患者单独放疗与放疗+CCNU化疗比较,结果表明放疗+化疗的联合治疗有提高总生存的趋势[82]。2008年Shaw等报道RTOG9802临床试验结果,提示低级别胶质瘤高风险人群(年龄>40岁,肿瘤未能全切除者54 Gy多分割放疗后+PCV方案化疗6程后),2年总生存率、5年无进展生存率和5年总生存率有明显提高的趋势(P=0.06)(Ⅱ级证据)。2003年的研究表明,卡铂和替尼泊苷可以提高复发肿瘤的疗效,毒副作用在可控范围(Ⅲ级证据)。2001年Chinot等首次报道了TMZ在少突胶质细胞瘤中的治疗效果,与PCV比较,TMZ有良好耐受性,毒副作用较小,疗效不亚于PCV。2003年EORCT26971临床试验结果表明,由于其化疗毒性较低,治疗客观有效率较高,TMZ可作为未行过化疗的低级别少突胶质瘤复发者的化疗的首选治疗(Ⅱ级证据)。2007年Kaloshi等回顾性地分析了TMZ标准化疗方案(5/28 d疗法)治疗单中心149例进展的低级别胶质瘤(仅进行过手术治疗,而未进行过放疗)的疗效,平均用药14个疗程。53%的患者为化疗有效反应,37%病情稳定,中位无进展生存期28个月,86例1p19q杂合子缺失检测中42%患者存在1p19q缺失,1p19q缺失的患者TMZ疗效明显好于无1p19q缺失的患者,包括无进展生存期和总生存期,同时该研究证明,TMZ对于初治的进展性低级别胶质瘤有显著效果(Ⅳ级证据)。
2009年Kesari等发表新诊断及复发的低级别胶质瘤Ⅱ期临床药物试验,表明TMZ的长疗程方案(75 mg·m-2·d-1,连续给药7周,停药4周,11周为1个疗程,继续下一个疗程直至肿瘤进展或毒副作用产生)比标准的5/28 d方案,患者没有出现化疗不耐受。12个月的无进展生存率、中位PFS和中位OS均有明显的提高。同时MGMT启动子甲基化组相对于MGMT启动子非甲基化组、1p19q缺失组相对于1p19q无缺失组在中位PFS和OS均有显著的提高(Ⅲ级证据)。2007年Pouratian等回顾性分析了25例没有行放射治疗的低级别胶质瘤患者采用长期低剂量TMZ化疗(每周期采用TMZ 75 mg·m-2·d-1剂量连续应用3周,休息1周)的疗效,结果发现,6个月无进展生存率92%,1年无进展生存率72%。其疗效优于标准的5/28 d化疗方案,且多数患者能够获得良好耐受(Ⅳ证据)。
中枢神经系统肿瘤是儿童最常见的实体肿瘤,胶质瘤占60%。儿童胶质瘤包括低级别胶质瘤(WHOⅠ~Ⅱ级:如毛细胞型星形细胞瘤、毛细胞黏液型星形细胞瘤、室管膜下巨细胞型星形细胞瘤、多形性黄色瘤型星形细胞瘤和弥漫性星形细胞瘤等);高级别胶质瘤(WHO Ⅲ~Ⅳ级:AA、间变性少突胶质细胞瘤、间变性少突星形细胞瘤和GBM);而弥漫性内生型脑干胶质瘤(DIPG),大脑胶质瘤病由于其预后差,也归于高级别胶质瘤。手术切除是大部分胶质瘤的首选治疗方法,对位置深在如脑干胶质瘤以及不能全切的肿瘤,辅助放化疗有着重要作用。由于放疗对3岁以下的婴幼儿可能影响其认知、生长和内分泌功能,甚至可导致胶质瘤的恶性发展,因此,化疗的作用显得尤为重要。对于儿童低级别胶质瘤,首先应争取在安全前提下最大限度的手术切除。手术全切者无需其他辅助治疗,出现复发时行放化疗。如果肿瘤未能全切,则需要进行化疗。对于儿童高级别胶质瘤,也应争取在安全前提下最大限度的手术切除,无论切除程度如何术后均推荐行放化疗。>3岁可直接行放化疗,<3岁者建议先行化疗,3岁后再行放疗。高级别胶质瘤的化疗效果不佳,贝伐珠单抗等新型生物制剂已用于临床,但确切的疗效有待大规模临床试验验证。脑干胶质瘤尤其是DIPG一般不采用手术治疗。放疗可以改善神经系统症状,但不能改善预后;化疗和其他治疗方法(包括免疫治疗、生物治疗等)的效果不明确,尚有待大规模RCT研究加以验证。
TMZ在成人高级别胶质瘤与复发胶质瘤中有良好疗效,但在儿童中的总体疗效不佳,且疗效不一致,可能与生物遗传学上的差异有关。儿童胶质瘤患儿中MGMT启动子甲基化与预后相关,因此推荐有条件的单位进行MGMT甲基化检测。
支持推荐意见的证据:(1)儿童低级别胶质瘤:1997年Packer等[83]证实长春新碱+卡铂(560 mg/m2,每4周1个周期)对术后进展的低级别胶质瘤有良好疗效,耐受性好,毒副作用小,可以有效阻止儿童低级别胶质瘤的进展,为以后的放疗争取更多的时间(Ⅳ级证据)。2008年Ater等[84]介绍了COG A9952 Ⅲ期临床试验结果,结果提示,长春新碱+卡铂(CV方案)与6-硫鸟嘌呤+丙卡巴肼+洛莫司汀+长春新碱(TPCV方案)均对于儿童低级别胶质瘤术后残留(未行放疗)的控制发挥作用,CV方案的中位无进展时间为3.2年,而TPCV方案的中位无进展时间为4.9年。两个方案的毒副作用大致相当(Ⅱ级证据)。2010年Massimino等[85]比较了低剂量顺铂(25 mg·m-2·d-1)和依托泊苷(100 mg·m-2·d-1)联合化疗与大剂量顺铂(30 mg·m-2·d-1)和依托泊苷(150 mg·m-2·d-1)的疗效,PFS和OS无明显差异,且低剂量组毒副反应明显降低。因此低剂量顺铂/依托泊苷化疗可作为儿童低级别胶质瘤的有效治疗方案(Ⅳ级证据)。2007年Gururangan等[86]进行的一项Ⅱ期临床试验评估了口服TMZ对复发低级别胶质瘤的效果,选取了26例之前曾接受过手术或放化疗、平均年龄10岁的视路胶质瘤(OPG)患者,给予患者TMZ 200 mg·m-2·d-1,连续5 d,4周为1周期。结果显示,总的肿瘤控制率(包括部分反应、轻微反应和病情平稳)为54%,2年PFS 49%,2年OS 96%,毒性反应较少。结果表明,TMZ方案具有较好的疗效及良好的耐受性(Ⅲ级证据)。2003年Kuo等[87]报道了对13例手术未完全切除且有进展的儿童低级别胶质瘤给予TMZ化疗的疗效。其中4例为标准TMZ疗法(150 mg·m-2·d-1,5/28 d 1周期);另外9例为低剂量长疗程TMZ疗法(75 mg·m-2·d-1,连续42 d,56 d 1周期);结果表明,TMZ在儿童低级别胶质瘤中有效,尤其是对于已经放化疗过的患者。低剂量长疗程较标准疗法的毒副作用低(Ⅲ级证据)。(2)儿童高级别胶质瘤及复发胶质瘤:1989年CCG-943临床试验,将58例儿童高级别胶质瘤随机分成单纯放疗组以及放化疗组(长春新碱、CCNU和泼尼松龙),随访5年EFS分别为16%和48%,差异有统计学意义,该试验是证实PVC化疗在儿童高级别胶质瘤辅助治疗中有疗效的第一个临床随机试验(Ⅱ级证据)。后来的大规模临床试验CCG-945,则研究70例病理确诊为高级别胶质瘤的患儿,其中A组术后采用PCV方案(长春新碱1.5 mg/m2、CCNU 100 mg/m2、泼尼松40 mg·m-2·d-1连续14 d与放疗同步,然后维持化疗8个周期),B组术后采用8合1方案;结果两组PFS及OS无显著差别。表明8合1方案较传统剂量的PVC方案并无明显优势(Ⅱ级证据)。HIT-91临床试验将高级别胶质瘤患儿随机分成:先化疗后放疗组(异环磷酰胺、VP-16、甲氨蝶呤、顺铂和阿糖胞苷),先放疗后化疗组(CCNU、长春新碱和顺铂),结果中位生存期分别为5.2和1.9年,表明在尽可能全切除的前提下化疗越早患者获益更多(Ⅱ级证据)。2011年,公布的COG临床试验ASNS0126将107例各种类型的高级别胶质瘤进行TMZ同步放化疗,或者放疗后TMZ辅助化疗。随访结果与CCG-945临床试验结果相比较,发现TMZ的两种治疗方案在3年无事件存活率和总生存期上与PCV方案间无明显差别[87](Ⅲ级证据)。该结果与1998、2002和2007年公布的临床试验结论相吻合。总体上,TMZ在高级别胶质瘤治疗中,对儿童的疗效远不如成人(Ⅲ级证据)。(3)脑干胶质瘤:Kim报道的一项多中心研究选取了17例新发DPG患儿(平均年龄8岁),采取的化疗方案为TMZ+沙利度胺,结果在完成治疗的12例患者中,总的肿瘤控制率达到92%,总反应率83%,中位PFS 7.2个月,中位OS 12.7个月,该研究提示,TMZ+沙利度胺方案对脑干胶质瘤的治疗是安全且有效的[88](Ⅳ级证据)。2010年Chiang等[89]的单中心研究表明,对10例脑干胶质瘤进行放疗+TMZ辅助化疗,另外8例进行同步放化疗+TMZ辅助化疗,结果两组PFS无差异,表明TMZ的同步放化疗+辅助化疗并不比单纯放疗+辅助化疗疗效更好(Ⅲ级证据)。2011年,COG开放标签Ⅱ期临床试验(ASNS0126)报道,对新诊断的63例桥脑DIPG予以TMZ同步放化疗(90 mg·m-2·d-1,42 d)和TMZ辅助化疗(90 mg·m-2·d-1,连续5 d,28 d 1周期,10个周期),结果1年无进展生存率14+/-4.5%,低于CCG-9941的无化疗的1年无进展生存率21.9%+/-5%。表明TMZ化疗不能改善桥脑弥漫性内生型胶质瘤的治疗效果[90](Ⅲ级证据)。
髓母细胞瘤是中枢神经系统恶性程度较高且预后差的肿瘤,主要好发于10岁以下儿童,多位于小脑蚓部,生长迅速且具有高度软脑膜转移倾向,成人髓母细胞瘤较为少见,发病率仅为百万分之0.5,主要好发于小脑半球。由于其高度恶性且手术不易切除,术后通常需要进行放、化疗。化疗是髓母细胞瘤手术切除后的重要辅助治疗。
(1)一般风险组儿童:一般风险组儿童通常指:①年龄>3岁;②术后肿瘤残留<1.5 cm3,肿瘤局限在后颅凹而无远处转移;③蛛网膜下腔无播散,无中枢外血源性转移(M0)及蛛网膜下腔转移者;其5年生存率介于54%~89.8%,其中绝大部分5年生存率超过70%,临床上可见到存活超过20年的患者。对一般风险组儿童目前常用的化疗药物主要有CCNU(洛莫司汀),长春新碱、丙卡巴肼、顺铂、卡铂和VP16。化疗在放疗后4~6周给予,6个疗程为标准化疗。全身系统性大剂量化疗对提高髓母细胞瘤的生存率方面疗效肯定,特别是与放疗结合治疗时,能明显降低肿瘤复发率,改善患者预后。支持推荐意见的证据:儿童癌症研究组(CCG-942)对传统的放疗和放疗后行长春新碱、CCNU、泼尼松所作的比较研究显示,髓母细胞瘤辅助化疗有良好的效果[64]。虽然两组总生存率差异无统计学意义,但是残余肿瘤体积较大者或发病时已有转移的者行放疗后化疗的比只行传统放疗的生存率有所提高(放疗+化疗组57%,传统放疗组19%,无进展生存分别为46%和0%;Ⅰ级证据)。在SIOP Ⅰ期的多中心随机对照研究中,标准放疗后予以长春新碱+CCNU化疗较之单纯标准放疗有更高生存率[62](Ⅰ级证据)。在随后的Ⅱ期临床研究中将153例患者分为4组(标准放疗组、减量放射组、术后化疗+标准放疗组、术后减量化疗+减量放射组),结果表明术后标准化疗+标准放疗组的无瘤复发率最高(75%),而术后减量化疗+减量放射组的无瘤复发率最低,仅为41%(Ⅱ级证据)。Packer等[91]报道Ⅲ期临床治疗结果,患者被随机分为:CCNU+顺铂+长春新碱组和顺铂+长春新碱+环磷酰胺两组。5年无瘤生存率分别为81%和86%。研究表明,患者的年龄、放疗方案及肿瘤侵袭脑干等因素对治疗结果无影响,化疗可显著提高患者的术后无瘤生存率。但环磷酰胺可引起感染和继发肿瘤,CCNU可引起水电解质紊乱,须警惕烷化剂带来的毒副作用(Ⅰ级证据)。Taylor等[92]比较单纯放疗与化疗+放疗的治疗效果,化疗方案为第一轮应用长春新碱+VP16+卡铂,第二轮为长春新碱+VP16+环磷酰胺。结果表明,两组化疗患者5年生存率均超过70%,但单纯放疗组无瘤生存率为60%,而化疗组的无瘤生存率高达74.2%。再次证实联合化疗在治疗儿童髓母细胞瘤中的重要作用(Ⅰ级证据)。多个研究结果显示,通过化疗可以减轻放疗的不良反应。Zeltzer等[93]研究了减量放疗后加联合化疗的治疗结果,化疗用药方案为CCNU(75 mg/m2)+顺铂(75 mg/m2)+长春新碱。放疗剂量为全脑全脊柱降至23.4 Gy,局部放疗降至36 Gy。全组59例患者中5年无复发生存率为80%。在获得较好疗效的同时降低了放疗的不良反应。值得注意的是尽管为低剂量放疗,但放疗始终在髓母细胞瘤术后的辅助治疗中具有重要作用,很多想单纯依靠化疗治疗髓母细胞瘤的研究的结果都令人失望(Ⅰ级证据)。德国HIT的临床试验比较了放疗后持续化疗与放疗之前短期化疗(即夹心化疗方法)的治疗结果。持续化疗方案为CCNU+顺铂+长春新碱,共8个疗程,每6周1次。夹心化疗药物为异环磷酰胺、顺铂、甲氨蝶呤、VP16及阿糖胞苷。研究结果显示,一般风险组中3~6岁的患者两组生存率差异无统计学意义,而在6~18岁中持续化疗组生存率为82%,夹心化疗方案组生存率仅62%,明显低于持续化疗组(Ⅰ级证据)。CCG研究中的研究也证明夹心疗法化疗的疗效不如放疗后化疗的疗效[93](Ⅰ级证据)。(2)高风险组儿童:高风险组患者是指:年龄≤3岁;术后肿瘤残留:≥1.5 cm3;有肿瘤远处播散和转移的证据(M1-4)的患者。有转移的髓母细胞瘤均归为高风险组,这类髓母细胞瘤的治疗至今仍是难题。多种化疗方案均没有获得理想的治疗结果。泼尼松+CCNU+长春新碱,卡铂/VP16等化疗方案可用于高风险儿童的髓母细胞瘤患者。没有证据支持夹心化疗法对高风险髓母细胞瘤患儿有效。支持推荐意见的证据:Prados等报道39例原始神经外胚层肿瘤,其中有25例为髓母细胞瘤,25例中9例为高风险髓母细胞瘤,在放疗之后继续给予CCNU、顺铂和长春新碱联合化疗,高风险组中4例在治疗2年内出现肿瘤复发[73](Ⅲ级证据)。Zeltzer等[93]随机将患者分为放疗之前采用泼尼松+CCNU+长春新碱治疗和放疗前后都给予8种化疗药物治疗两个组。研究表明总体疗效较差,但泼尼松+CCNU+长春新碱化疗方案好于8种药的联合化疗方案(Ⅱ级证据)。Verlooy等[94]采用低剂量放疗前后8种化疗药物以及卡铂/VP16治疗高风险组患者,平均5年无进展生存率为50%,其中M1期5年生存率为56%,M2/M3的生存率仅为44%(Ⅱ级证据)。有学者认为,夹心化疗不但对提高髓母细胞瘤生存率无益处,反而推迟放疗时间并增加了肿瘤继续进展的风险。在Taylor等[92]的SIOP研究中,联合化疗药物为长春新碱、卡铂和VP-16,而后替代为卡铂、VP-16和环磷酰胺。结果表明肿瘤残余、转移程度及性别对生存期无影响,患者5年无进展生存率仅为34.7%(Ⅰ级证据)。德国的HIT临床试验中对高危患者采用大剂量环磷酰胺合并夹心化疗方案,也没有获得良好疗效,M2/M3期的5年生存率仅为30%(Ⅰ级证据)。
成人髓母细胞瘤起源于小脑外颗粒细胞层,而小脑外颗粒细胞层主要位于小脑软膜下分子层表面,因此成人髓母细胞瘤多位于小脑表面,位于小脑蚓部及第四脑室者较少。与儿童中线的肿瘤相比小脑半球的肿瘤不易通过脑脊液转移,因此成人髓母细胞瘤的预后明显好于儿童髓母细胞瘤。与儿童患者比,成人髓母细胞瘤患者的身体耐受力强,为术后早期足量放、化疗提供了必要的条件,这也是成人患者预后好于儿童患者的原因之一。成人髓母细胞瘤的术后化疗能显著提高患者的生存率,术后放化疗的患者治疗效果明显优于术后单纯放疗者[94,95,96,97]。常用化疗方案为CCNU、长春新碱及泼尼松或CCNU+长春新碱+丙卡巴肼。但后者化疗毒性较高,尤其是骨髓抑制造成全血细胞降低,放疗后化疗的不良反应更加明显,常导致辅助化疗药物不能足量运用,甚至中断化疗,因此有学者提出放疗前后行顺铂+VP16的夹心化疗方案并获得疗效。
支持推荐意见的证据:Padovani等[95]统计了法国多中心253例成人髓母细胞瘤的临床资料,术后辅助放疗和化疗的5和10年的总生存率分别为78%和55%。而Brandes等[96,97]统计的454例成人髓母细胞瘤的5年和10年总生存率分别为65%和22%。分析这两组的治疗结果发现,前者较高的总生存率与该组中有142例接受了联合化疗有关。Abacioglu等[98]回顾性研究了30例成人髓母细胞瘤的治疗结果,所有患者术后接受放疗治疗,33%的患者因属于高危病例而在放疗后接受了联合化疗,化疗方案为CCNU、长春新碱及泼尼松。结果表明,全组5年生存率及无瘤生存率分别为65%及51%,其中化疗组及未化疗组的5年无瘤生存率分别为69%及60%。虽然两者差异无统计学意义,但化疗组属高危患者且较未化疗组的无瘤生存率略高(Ⅲ级证据)。Silvani等[99]在成人髓母细胞瘤治疗中给予夹心化疗疗法,将传统的CCNU+长春新碱+丙卡巴肼方案改为顺铂+VP-16的方案,以减少毒副作用。研究结果令人满意,入选的28例成人髓母细胞瘤5年无瘤生存率及5年生存率分别为57.6%和80%。虽然有学者认为在放疗之前予以化疗会推迟放疗开始的时间,有可能造成肿瘤复发,但该作者认为只要精确安排化疗时间,并不会影响放疗的治疗结果。因此,不同于小儿髓母细胞瘤对夹心化疗的反应,在成人髓母细胞瘤中可以采用夹心化疗法(Ⅱ级证据)。
3岁以下低龄儿童的髓母细胞瘤由于初次诊断时多已伴有播散性转移,因而有较高的复发率,是预后不良的主要原因,所以,将婴幼儿患者普遍归于高危组患者。婴幼儿各系统发育不成熟,对放疗耐受性差,虽给予低剂量全脑全脊髓放疗及局部后颅窝放疗,其复发率仍然较高,并可增加婴幼儿的放射性损伤,所以放疗不是治疗婴幼儿髓母细胞瘤的理想选择。大剂量冲击化疗是延缓或避免婴幼儿术后颅脑脊柱放射治疗的有效方法,特别是对存在术后肿瘤残余及肿瘤转移的婴幼儿患者。对于手术全切且无转移的婴幼儿患者,单纯大剂量化疗可取得满意疗效,可以代替放射。但是婴幼儿髓母细胞瘤的化疗仍存在诸多问题,无论是单纯给予铂类化疗药物或是VP16甚至联合化疗,其治疗效果与儿童高危患者的治疗效果相似,均不理想,需要进一步进行多中心的临床试验研究。
支持推荐意见的证据:Finlay领导的Head Start I研究中,对患者先予以低剂量的诱导化疗(卡铂、噻替派和VP-16),随后给予大剂量的化疗药物(顺铂、长春新碱、VP-16和环磷酰胺)并在必要时予以自身骨髓移植作为术后主要治疗方案。研究发现,患者对诱导化疗耐受性较好且随访中诱导化疗效果显著,2年无瘤进展率及生存率分别为38%和62%。在Ⅱ期临床研究中在诱导化疗药物中又加入大剂量的甲氨蝶呤,发现诱导化疗对研究队列中有髓母细胞瘤播散的所有婴幼儿均有疗效,其3年无瘤进展生存率和总生存率分别为49%和60%,作者指出在诱导化疗药物中加入大剂量甲氨蝶呤能提高患者对诱导化疗的效果[100](Ⅰ级证据)。目前Ⅲ期临床试验正在进行中,主要是把诱导治疗方案变为口服VP16和TMZ,更便于临床应用。Geyer等[101]入选92例婴幼儿髓母细胞瘤中,1/3/患者有肿瘤转移。他们随机将患者分成两组,一组给予长春新碱、顺铂、环磷酰胺和VP-16,另外一组给予长春新碱、异环磷酰胺、卡铂和VP-16,两组均未给予放射治疗。总体5年无瘤生存率仅为32%,两组分别为37%和26%。作者认为单纯大剂量化疗药物治疗婴幼儿髓母细胞瘤的效果并不理想。但在此研究队列中存在髓母细胞瘤转移患者,这对单纯大剂量化疗治疗髓母细胞瘤疗效评价存在影响(Ⅰ级证据)。2005年Ridola等[102]在SFOP临床研究中共入选79例<5岁的髓母细胞瘤患儿,术后将患者共分为3组,即肿瘤全切无转移组(R0M0)、肿瘤残余无转移组(R1M0)及转移组(RxM0)。先予以3组低剂量的诱导化疗药物(分别是卡铂+丙卡巴肼、VP-16+顺铂和长春新碱+环磷酰胺持续16周)作为术后的主要辅助治疗方案。若出现肿瘤进展或复发则再予以大剂量化疗药物加颅脑脊柱放射治疗作为补救治疗措施。研究发现,R0M0组患者与R1M0组患者相比,5年肿瘤无进展生存率分别为41%和0%,这说明低剂量的诱导化疗仅对手术全切且无转移的患者部分有效,而肿瘤残余者低剂量诱导化疗并不能抑制肿瘤的进展。而接受大剂量化疗+放射治疗之后其3组5年生存率分别为73%、41%和13%,可见大剂量化疗+放疗能明显提高患者的生存率,并且作者认为在手术切除无转移的患者中可单给予大剂量化疗而不需要进一步放射治疗(Ⅰ级证据)。Rutkowski等[103]研究了在辅助化疗中加入大剂量脑室内应用甲氨蝶呤替代放射治疗对婴幼儿髓母细胞瘤的效果。共43例婴幼儿入选,其中12例存在转移。入选的患者给予不同的化疗方案,包括环磷酰胺+长春新碱或者大剂量的甲氨蝶呤和长春新碱、卡铂+VP-16。其5年无瘤生存率和生存率分别为58%和66%。其中无肿瘤残余无转移患者的5年无瘤进展率较有肿瘤残余及有远处转移的患者均要高,分别为93%、56%和38%。此研究中接受化疗的患者其神经系统各项功能评价较之其他研究中接受过颅脑脊柱放射治的患者均有改善(Ⅲ级证据)。最近德国的一项多中心研究表明,单独行辅助化疗的治疗效果与髓母细胞瘤的病理类型有关。典型髓母细胞瘤对联合化疗反应较差,而促结缔组织增生型效果较好,两组5年无进展生存率分别为30%和95%,可见临床病理类型不仅可以作为判断髓母细胞瘤预后的标准之一,还可以作为化疗敏感性的评价标准[104](Ⅰ级证据)。
室管膜肿瘤发病率较低,占所有原发脑内肿瘤的3%。本病多见于儿童及青年,约占儿童颅内肿瘤的10%,继星形细胞瘤和髓母细胞瘤之后居儿童原发颅内肿瘤第3位。好发部位依次为第四脑室、侧脑室、第三脑室。儿童室管膜肿瘤约绝大多数发生于颅内,而成人室管膜肿瘤则多见于脊髓。本病的治疗原则为手术切除+放射治疗(无中枢神经系统播散的室管膜瘤,术后只针对瘤床行局部放疗;而对于经MRI或CSF检查证实有脊髓转移的患者,应行全脑全脊髓放疗)。1996年Evans等发表的随机对照Ⅲ期临床试验结果表明对于儿童后颅窝室管膜瘤患者,全脑全脊髓放疗+PCV联合化疗组(洛莫司汀+长春新碱+泼尼松龙)对比单独全脑全脊髓放疗组并未延长生存(Ⅱ级证据)。化疗在成人初发室管膜瘤辅助治疗中的作用报道不一,缺乏临床RCT研究的明确结论。复发者建议化疗,具体参见本指南《复发的治疗与随访》章节。对于间变性室管膜瘤(WHO Ⅲ级)患者,在手术及放射治疗后,可以进行化疗,可选择的化疗主要方案包括:以铂类为主联合化疗以及依托泊苷,亚硝脲类化疗。
复发高级别胶质瘤的最佳治疗方式缺乏统一意见。贝伐珠单抗被认为是复发胶质母细胞瘤的标准治疗方案,但是这种观点还没能得到大家认可。我们认为,在复发恶性胶质瘤的治疗过程中年龄、全身状态、病史、肿瘤大小、肿瘤位置、肿瘤的MGMT甲基化状态、1p/19q位点状态,以及患者先前所接受治疗的种类和数量,这些都应考虑到的重要因素。另外,复发的病灶必须与联合放化疗引发的"假性进展"相鉴别,目前可以应用MRS,PET,SPECT以及活检等方法进行鉴别。对于复发肿瘤出现明显占位效应且一般状态良好的患者,应该首先考虑外科手术治疗,手术切除可以缓解占位效应,减少糖皮质激素的应用,延长患者的生存期,但是外科手术应该与其他治疗手段结合使用。对于在第一次治疗过程中没有进行TMZ联合放化疗的复发高级别胶质瘤患者,可以采用标准化的TMZ联合放化疗及辅助化疗方案(Stupp方案)[29]。在接受放射治疗和TMZ治疗均失败后,参加有关的临床试验性治疗就成了他们最佳的选择,这些正处在临床实验阶段的治疗方法包括:剂量-强度TMZ疗法、靶向分子抑制剂疗法、抗血管生成疗法、基因疗法、免疫疗法和脑内注射靶向免疫毒素等。这些治疗方法尚处于研究阶段。对于那些不适合进行临床试验治疗或者没有条件、途径接受临床试验治疗的患者,我们推荐贝伐珠单抗联合另外第2种药物(如依立替康)进行治疗。对于已经接受了放射治疗却病情仍有进展的间变型少突胶质细胞瘤患者,可以选择应用PCV化疗方案或者TMZ,其中1p/19q位点缺失的少突细胞肿瘤对于治疗的反应比较明显。我们不推荐将卡氯芥作为首选化疗方案。对于那些骨髓储备功能差或者对化疗耐受性差的患者,可以考虑选择高精度放射治疗(如立体定向放射外科治疗)或贝伐珠单抗联合化疗。
(1)复发GBM:①对于前期未进行标准化TMZ联合放化疗方案的患者,推荐应用TMZ联合放化疗加6~12个周期的辅助TMZ化疗。在治疗前如有条件,推荐检查肿瘤的MGMT甲基化状态。②对于先期应用标准TMZ治疗却病程仍有进展的患者,可以应用TMZ剂量增强方案(Ⅲ级证据)。③加入临床实验,这些临床实验包括:靶向分子抑制剂疗法,抗血管生成疗法,基因疗法,免疫疗法和脑内注射靶向免疫毒素疗法等。④对于TMZ耐药的患者,可以应用贝伐珠单抗联合应用依立替康(患者骨髓储备功能良好)(Ⅲ级证据)。对于已经使用抗血管增生疗法的复发胶质母细胞瘤,此治疗方法无效。⑤根据患者情况,还可以应用其他一线治疗方案(如PCV方案)或二线、三线化学疗法,如基于铂类药物的方案等,应注意的是铂类药物单独使用疗效有限。(2)复发的间变星型细胞瘤:同复发胶质母细胞瘤。(3)复发间变少突胶质细胞瘤:同复发胶质母细胞瘤(在治疗前推荐检测胶质瘤1p/19q缺失状态)。
推荐:VEGF为靶标的分子靶向药物——贝伐珠单抗(Bevacizumab,阿瓦斯汀Avastin)用于复发高级别胶质瘤的治疗(Ⅱ级证据)。高级别胶质瘤往往是一种富含血运的肿瘤,常伴有血管内皮生长因子(VEGF)和血管内皮生长因子受体(VEGFR)的过表达,因此为临床实施抗血管治疗提供理论基础。贝伐珠单抗是人源化抗VEGF单克隆抗体,2004年获得FDA批准上市,用于一线治疗晚期结直肠癌。在一项入组167例复发胶质母细胞瘤(GBM)的Ⅱ期临床试验中[105],患者分别应用贝伐珠单抗单药(10 mg/kg)或贝伐珠单抗(10 mg/kg)联合伊立替康(340 mg/m2或125 mg/m2)化疗,结果显示6个月PFS率分别为42.6%与50.3%,作用时间4.3~5.6个月。另外用药后类固醇类药物的用量均有所减少或保持稳定。虽然Ⅲ或Ⅳ度的不良反应比较常见(贝伐珠单抗单药组为46.4%),患者多具有良好的耐受性,常见的不良反应包括高血压、癫痫、血栓形成。
贝伐珠单抗(10 mg·kg-1·2周-1或15 mg·kg-1·3周-1)的研究结果显示,患者6个月无进展生存率为29%~64%[106]。除了单一用药,贝伐珠单抗还可与其他药物(TMZ、卡铂等)联合应用。近来发现贝伐珠单抗治疗的患者可短暂好转后恶化,肿瘤迅速增大和转移播散。这是因为抗VEGF治疗虽然抑制血管生成,同时也降低对肝细胞因子(HGF)信号通路的抑制。HGF具有刺激细胞增殖和迁移功能。由于HGF信号通路活跃,促使肿瘤增殖和迁移。因此,贝伐珠单抗宜与其他化疗药联合应用。Reardon等[107]应用依托泊苷联合贝伐珠单抗治疗复发高级别胶质瘤,但治疗效果并无进一步提高,患者的毒副作用却更为严重,有部分患者应用贝伐珠单抗疗效不佳。
综上所述,抗血管靶向药物对复发高级别胶质瘤有利有弊,尚需更多的研究结果以明确最佳的治疗剂量及模式。
(1)髓母细胞瘤:髓母细胞瘤易复发,76%的复发发生于首次治疗后2年内,5年复发率低危患儿为20%,高危患儿超过50%。髓母细胞瘤可发生脊髓播散和颅外转移,随访时应予以注意。髓母细胞瘤复发后的平均生存时间是1~41个月,放疗后复发的病例预后极差,大部分患儿会在复发后的18个月内死亡,常规化疗无法控制疾病的进展。髓母细胞瘤复发治疗在很大程度上受既往放化疗的限制。复发后的处理:首次治疗未行放疗者推荐手术(限于局部复发)+放疗(年龄低于3岁不推荐放疗)+化疗,放疗(低剂量,同步长春新碱)结束后选择环磷酰胺、顺铂、塞替派、长春新碱、Etoposide等多元化疗[108](推荐,多个Ⅳ级证据)。对首次治疗已接受全脑脊髓放疗者再次予以放疗需慎重。有报道大剂量化疗联合自体干细胞对复发髓母细胞瘤有较好效果[108],但也有报道显示结果并不明确(Ⅳ级证据)。(2)室管膜瘤:儿童室管膜瘤首次治疗后的复发率占43%~72%,大多数发生在术后5年内,复发后的生存期为8.7~24个月。室管膜瘤有脊髓播散的可能。对于复发肿瘤手术再次切除可显著延长患者生存期并改善预后。术后若条件允许,推荐放射治疗(Ⅲ级证据)。TMZ对儿童复发室管膜瘤效果不显著,目前最有效的化疗药物有:顺铂和依托泊苷,化疗单药缓解率为12.9%,联合化疗缓解率为17.4%(推荐,多个Ⅳ级证据)。(3)星形细胞瘤:复发可选择顺铂+依托泊苷(推荐,多个Ⅳ级证据);Ⅲ~Ⅳ级肿瘤较少见,多位于幕上半球,预后较差,化疗对其复发的疗效的研究尚少。大剂量化疗联合自体干细胞的观点未被广泛接受。
(1)随访的定义和目的:由于胶质瘤的治疗是系统的综合治疗,在治疗过程中的复查广义上也是随访,但我们这里的随访特指常规抗肿瘤治疗结束后对患者进行临床随访和影像学复查。通过随访,可以评估肿瘤的控制情况,监测肿瘤引起或治疗引起的病征变化,为患者及家属提供精神心理方面的医学支持,指导患者的功能康复和改善患者的生存质量。(2)随访内容:对患者进行临床基本情况复查,主要包括全身情况、认知和精神心理状况、神经系统体征及体格检查、必要的辅助检查以及影像学复查(强烈推荐)。中枢神经系统胶质瘤的随访应有多领域专家的参与,来自神经外科、放疗和化疗、神经内科、影像、精神心理、护理与康复治疗等专科(推荐)。评估肿瘤的控制情况首选MRI平扫(T1、T2或Flair、DW)及T1增强扫描,除非有禁忌[109](强烈推荐,Ⅰ级证据)。采用MRS、灌注MRI、PET/CT可辅助区别放射性坏死与肿瘤进展[110](推荐,Ⅱ级证据)。随访过程中,监测和处理由肿瘤或治疗引起的病征,包括控制瘤周水肿及类固醇激素的使用和类固醇激素的不良反应监测,抗癫痫药物的选择、减量与停药时机,放疗和化疗的近期及远期不良反应等[111](推荐,Ⅱ级证据)。对中枢神经系统肿瘤所致的患者意识、精神心理和认知状态、神经功能障碍及生存质量的评估,应采用国际通用的评定手段、量表与技术进行(参考中枢神经系统胶质瘤的康复治疗章节)[112](推荐,Ⅱ级证据)。(3)随访的时间和间隔:目前无高级别证据来确定随访的时间及间隔。一般来说,高级别星形细胞瘤患者常规随访间隔为1~3个月;低级别星形细胞瘤为3~6个月。还应该结合肿瘤、切除程度和肿瘤残余情况、有否新症状出现、是否参加了临床试验、患者的依从性和健康状态等定出个体化的方案。成人低级别幕上星形细胞瘤、少突胶质细胞瘤应每3~6个月随访1次,持续5年;以后每年至少随访1次(可推荐,Ⅲ级证据)。间变性星形细胞瘤、胶质母细胞瘤在放疗后2~6周应随访1次,以后每1~3个月随访1次,持续2~3年,再以后随访间隔可适当延长(可推荐,Ⅲ级证据)。成人颅内室管膜瘤应每3~4个月随访1次,持续1年;以后每4~6个月1次,持续2年;再以后每6~12个月进行1次。若术前脊髓影像学有阳性提示或存在脑积水的患者,从首次随访开始,影像学检查就应包括脊髓MRI检查(可推荐)。成人髓母细胞瘤和幕上PNET的随访应每3个月进行1次脑MRI检查,每6个月1次脊髓MRI,持续2年;以后每6个月1次脑MRI,每年1次脊髓MRI,持续3年;再以后,每年1次脑MRI。髓母细胞瘤可能发生中枢神经系统外的播散,随访中应予注意(可推荐)。
大量临床观察及基础研究表明,以运动疗法为主的康复治疗有助于损伤中枢功能及结构的重建[113](Hu YS 2010)。关于脑卒中、脑外伤后脑损伤康复治疗的有效性已有较多临床研究,脑肿瘤术后康复治疗临床研究的有效性也有所报道。
1.中枢神经功能障碍评估方法,可采用国际上常用的功能评定手段、量表与技术进行评定,包括,Glasgow昏迷量表(GCS)、Brunnstrom量表、Fugl-meyer量表、汉密顿焦虑量表(HAMA)、波士顿失语诊断性失语检查法(BDAE)、洼田饮水试验、简易智力状态检查法(MMSE)、认知与精神测定量表、改良Asworth量表、Barthel量表、功能独立性量表(FIM)以及SF-36生存质量量表等。
2.中枢神经功能障碍的康复治疗的方法:个体化方案的综合治疗,包括物理治疗(PT)、作业治疗(ST)、言语治疗(ST)、康复工程,抗痉挛治疗、康复护理、营养支持、娱乐治疗、镇痛、心理治疗和中国传统医学治疗,并可配合相关的药物治疗等。推荐早期康复,中枢神经系统胶质瘤术后或其他治疗后,患者生命体征稳定后即可开始。(1)物理治疗:以运动疗法为主,包括关节活动度练习、正确体位的摆放、肌力训练、耐力训练、呼吸训练、平衡及协调性训练、步态训练等。不推荐磁、电等物理因子常规剂量治疗(推荐,Ⅱ级证据)。(2)作业治疗:包括改善生活活动自理能力的训练,增加躯体感觉和提高运动功能的训练,实用性活动训练,娱乐治疗及辅助支具等(推荐,Ⅱ级证据)。(3)言语及吞咽治疗:言语障碍包括失语症及构音障碍,需要一系列针对性的言语治疗。吞咽障碍治疗包括直接治疗及间接治疗。直接治疗包括选择合适的不同质地的食物及进食方法。间接治疗可以应用冰刺激有关部位。(4)认知障碍治疗:认知障碍主要表现为结构和视空间功能、记忆力、执行功能、定向力、注意力障碍等。规范的认知康复有助于认知功能的改善。认知康复治疗结束后即刻,与对照组相比,患者认知功能的自我报告评分明显改善,神经心理评分可无明显变化。认知康复治疗结束后6个月,患者自我报告的认知功能改善可不明显,客观认知项目如注意力及言语记忆有明显改善。这可能与患者需要一个较长康复治疗和学会技能应用于日常生活有关(强烈推荐,Ⅰ级证据)。(5)康复工程:矫形器(orthosis)等辅助器是以减轻肢体运动功能障碍为目的的一种体外装置。其基本作用为:稳定与支持、固定与保护、替代与矫正畸形、减轻轴向承重、改善功能。应用矫形器等辅助器可改善患者的日常生活。(6)抗痉挛治疗:痉挛所致的肢体挛缩限制了受累关节的活动或者出现疼痛,妨碍康复而且可能限制了患者的恢复潜力。正确体位摆放、肢体被动伸展和关节活动度训练可以缓解痉挛。口服或局部注射抗痉挛药物也可同时应用。挛缩矫正方法还包括夹板疗法、手术纠正。(7)心理康复:应用心理学理论和技术,通过言语和非言语方式与患者沟通,消除或减轻患者心理痛苦,改变不良认知和行为方式。同时应对患者的家属进行教育,协助患者心理康复,必要时给予药物对症治疗。(8)其他康复治疗方法:患者在进行手术,术后放疗或化疗期间,充分的营养支持和护理,必要的娱乐治疗,使用镇痛药物等是很有必要的。(9)中国传统医学的应用:针灸、推拿和拳操在促进脑胶质瘤患者的康复中均有一定的作用。
3.康复的模式:目前国内推广应用的脑卒中三级康复治疗体系,可以应用到中枢神经系统胶质瘤患者的康复中。一级康复是指患者早期在医院急诊室或神经外科的早期康复治疗;二级康复是指患者在康复病房或康复中心进行的康复治疗;三级康复是指在社区或家中继续进行的康复治疗[113](强烈推荐,A级证据)。
(注:由于关于脑胶质瘤康复治疗的多中心、随机、大样本、前瞻研究较少,故本文部分参考了脑卒中康复的研究结果)。
胶质瘤诊断主要依据患者临床症状、神经系统体征及神经影像学表现(强烈推荐)。(1)临床诊断:临床表现是胶质瘤诊断的基础。胶质瘤可见于各年龄段,但髓母细胞瘤和弥漫性脑干胶质瘤在儿童期较高发。临床病程依据肿瘤的组织生物学行为而异,例如GBM约半数患者病程在3~6个月,AA的病程平均6~24个月,而一般星形细胞瘤生长缓慢,病程较长,平均可达1.5~3.5年。临床表现多取决于肿瘤生长部位,引起相应表现,低级别胶质瘤(WHO Ⅰ~Ⅱ级),尤其是少突胶质细胞瘤癫痫常为首发症状,高级别胶质瘤(WHO Ⅲ~Ⅳ级)主要表现为颅高压症状与局灶性神经症状。有头晕、头痛、恶心呕吐、肢体无力、言语障碍与认知改变等。明显意识障碍可发生于病程晚期。神经系统检查可发现肢体瘫、感觉障碍、视野缺损、视乳头水肿与其他颅神经损害等。小脑性共济失调可见于幕下肿瘤。偶有肿瘤沿蛛网膜下腔播散至脊髓种植,而导致截瘫伴大小便功能异常。(2)影像学诊断:影像学表现是胶质瘤诊断和鉴别的主要依据,而且可提供初步的病理性质,利于制定手术等治疗方案,应根据各单位实际情况酌情选用下列检查方法:①MRI平扫与增强:低级别胶质瘤(WHO Ⅰ~Ⅱ级)主要采用T2W或水抑制T2W(FLAIR)影像(强烈推荐);高级别胶质瘤(WHO Ⅲ~Ⅳ级)主要采用T1W增强影像(强烈推荐)。可作为胶质瘤影像诊断、明确胶质瘤侵袭范围、指导手术切除、勾画放疗靶区与疗效随访的"金标准"。②CT:对于不能采用MRI的病例(例如,体内有顺磁性金属植入物),或者不具备MRI设备的单位,可采用平扫和增强CT扫描(推荐)。③MRS:提供肿瘤和脑组织代谢物成分变化,以曲线和数字表示。用于胶质瘤与脓肿、炎症或其他非肿瘤性病变的诊断和鉴别诊断(强烈推荐)。也可用于残留或复发胶质瘤与治疗相关性坏死的鉴别诊断及用于脑深部肿瘤穿刺活检的靶点规划(推荐)。由于现有证据有限,目前不推荐MRS用于胶质瘤治疗后真性进展与假性进展的鉴别诊断。④PWI:测量肿瘤以及脑组织血流状况及血脑屏障破坏程度。用于胶质瘤的分级与鉴别诊断、残留或复发胶质瘤与治疗相关性坏死的鉴别诊断以及脑深部肿瘤穿刺活检的靶点规划(推荐)。可尝试用于胶质瘤治疗后真性进展和假性进展的鉴别诊断,但现有证据还不充分。⑤DW:鉴别诊断以及评估肿瘤的侵袭状况(推荐)。⑥PET-CT:评估肿瘤以及脑组织代谢活性。用于胶质瘤与炎症,残留或复发胶质瘤与治疗相关性坏死的鉴别诊断。⑦fMRI:脑皮质功能成像。用于运动区胶质瘤的个体化手术计划与导航(强烈推荐);用于语言区胶质瘤的手术规划(推荐)。⑧DTI:肿瘤周围的白质纤维束成像。用于运动区和视觉皮质区胶质瘤的手术计划与导航(推荐);与fMRI结合,确定弓状束,用于语言区胶质瘤的手术规划(推荐)。
(1)术前处理原则:①首先需对患者的全身情况及检查结果做出完整的评估,包括患者是否需要接受手术、手术的方式或替代治疗手段,以及手术可能带来的利弊等,并与患者或家属进行充分沟通和告知,最终由患者或家属选择和决定治疗方案(推荐)。②胶质瘤体积较大或瘤周脑水肿严重等导致明显颅高压者,术前宜给予甘露醇等脱水剂和糖皮质激素,维持瘤周脑组织血脑屏障稳定,降低颅内压,并积极手术准备(推荐)。③脑积水明显且预期手术后未能解除脑积水者可先行脑脊液分流术(推荐)。④一般状况欠佳者宜先给予对症支持治疗(推荐)。⑤术前有癫痫发作病史者,围手术期宜给予抗癫痫药物治疗(推荐);术前无癫痫发作史者,围手术期预防用抗癫痫药的临床价值还不明确。部分抗癫痫药物(如苯妥英钠、苯巴比妥和卡马西平等)可降低化疗药物的疗效,不作为首选。⑥功能区脑胶质瘤患者,除了神经系统检查外,可采用神经心理检测了解潜在的认知功能障碍。(2)手术原则:①无论低级别(WHO Ⅰ~Ⅱ级)或高级别胶质瘤(WHO Ⅲ~Ⅳ级),手术切除是首选治疗方案。应安全最大范围切除肿瘤,即:即在最大程度保存正常神经功能的前提下,最大范围手术切除肿瘤病灶,取得最精确而全面的病理诊断标本(强烈推荐)。不能安全地实施全切除肿瘤者,可酌情大部或部分切除肿瘤,以降低颅内压、缓解局灶神经功能障碍、降低瘤细胞负荷、明确病理诊断,为后续放化疗创造有利条件(推荐);脑深部胶质瘤可行立体定向(或导航下)穿刺活检术,以明确肿瘤的病理诊断(推荐)。②术中快速病理诊断可指导手术方案,提供多点多量的组织样本为术后作全面的病理诊断,包括IDH1、免疫组化、MGMT基因启动子甲基化状态和1p/19q杂合子分析等(推荐)。③术后24~72 h内复查头颅MRI(低级别者平扫;高级别者增强),用以定量评估肿瘤切除范围,并作为后续治疗的基准(强烈推荐)。在不具备复查MRI条件的单位,推荐术后早期(<72 h)复查头颅CT(推荐)。④手术辅助技术:包括导航、功能导航、术中MRI、术中神经电生理监测、术中超声、术中荧光造影和唤醒开颅技术等(推荐)。(3)放疗原则:①低级别胶质瘤(WHO Ⅰ~Ⅱ级):原发性低级别胶质瘤手术全切除后,对于低危因素者可以暂时不作放疗,定期随访;一旦肿瘤进展再选用放疗、化疗或再次手术。不能全切者,或虽全切除但属于高危因素者(年龄≥40岁、纯星形细胞瘤、瘤体直径>6 cm、肿瘤过中线、除了癫痫之外另有神经功能缺失)需放疗,临床靶体积(CTV)为术前及术后MRI FLAIR/T2W的异常信号区域(GTV)+外放1~2 cm(强烈推荐)。使用3D-CRT或IMRT技术(推荐)。标准剂量为45~54 Gy,常规分割(1.8~2.0 Gy/次)的X线外照射(推荐)。术后早期开始放疗(推荐)。不推荐SRS(X-刀,γ-刀)。②高级别胶质瘤(WHO Ⅲ~Ⅳ级)。术后2~4周左右尽快开始放疗(推荐)。常规分割(1.8~2.0 Gy次,5次/周,总剂量60 Gy/30~33次)6~10 MV的X线外照射(强烈推荐)。对于老年或一般状态不好的患者,采用快速低分割方案(总剂量40~50 Gy,3~4周完成)(推荐)。如果肿瘤范围很广或WHO Ⅲ级胶质瘤,总剂量可以略降至55~57 Gy。不推荐SRS(X-刀,γ-刀)作为高级别胶质瘤术后首选的治疗方式。靶区的确定:CTV1为术前及术后MRI T1W增强区域+FLAIR/T2W的异常信号区域+外放2 cm,还应注意包括可能含有肿瘤的解剖扩展区域(例如,相关白质纤维束)。缩野加量时的CTV2为T1W增强区域+外放2 cm。采用3D-CRT或IMRT技术(推荐)。肿瘤局部放疗(推荐)。放/化疗联合:GBM和AA:采用TMZ同步放/化疗联合辅助化疗方案(强烈推荐)。假性进展:假性进展是放疗后出现的亚急性放射反应,影像学特征酷似真性肿瘤进展,但临床症状轻微,且具有自限性。假性进展属于治疗性反应,放疗基础上联合化疗(例如,TMZ同步放/化疗)假性进展发生率增加(>20%),出现假性进展的时间提前(<3个月);较高的放疗剂量可能会促进假性进展发生;MGMT低表达患者接受TMZ同步放/化疗后,发生假性进展概率较高。假性进展的出现提示放化疗敏感,应继续辅助化疗。但假性进展与肿瘤复发鉴别较困难,需定期随访头颅MRI,动态观察临床表现,以鉴别影像学异常是肿瘤进展或非肿瘤病变。一般3个月内出现影像学进展的患者不应纳入复发恶性脑胶质瘤。③髓母细胞瘤:全脑全脊髓照射(CS)+后颅凹加量照射(PF)(强烈推荐)。照射分割剂量1.8 Gy/次。CS 30~36 Gy,PF加量至54~60 Gy(强烈推荐)。靶区的确定:全脑全脊髓照射野(CS):全脑照射野+全脊髓照射野(强烈推荐)。后颅窝加量照射野(PF):GTV=瘤床术腔+残留病灶,CTV=GTV+1 cm,计划靶体积(PTV)=CTV+0.5 cm,覆盖整个后颅窝。放/化疗的联合:有蛛网膜下腔转移者在放射治疗中每周同步应用VCR(按1.2 mg/m2)化疗(强烈推荐)。辅助化疗推荐应用:甲基苄肼+VCR(长春新碱)。④室管膜瘤:室管膜瘤(WHO Ⅱ级)手术全切除者,可以暂时不作放疗,定期随访,一旦肿瘤进展再选用放疗、化疗或再次手术。室管膜瘤部分切除和间变室管膜瘤(WHO Ⅲ级),术后需放疗(推荐)。局部总剂量为54~59.4 Gy。全脑全脊髓照射时,总剂量为30~36 Gy,随后对局部脊髓病变照射到45 Gy(推荐)。靶区的确定:CTV为GTV加上1~2 cm的间距。GTV为术前肿瘤侵犯的解剖区域加上术后MRI信号异常区域。(4)化疗原则:①低级别胶质瘤(WHO Ⅰ~Ⅱ级)原发性低级别胶质瘤手术全切除后,低危因素者可以暂不作化疗,定期随访;一旦肿瘤进展再选用化疗、放疗或再次手术。不能全切者,或虽全切除但属于高危因素者,进行放疗后辅助化疗(推荐)。有条件的单位对低级别胶质瘤的患者进行1p19q缺失及IDH1/IDH2突变的(推荐)。首次化疗采用TMZ 5/28标准方案(推荐)。复发/进展性治疗:可选用:TMZ;亚硝脲类;PCV联合方案;铂类化疗药(二线或三线疗法)。②高级别胶质瘤(WHO Ⅲ~Ⅳ级):新诊断的多形性胶母细胞瘤(GBM,WHO Ⅳ级):TMZ同步放/化疗联合辅助化疗方案:放疗期间每天口服TMZ 75 mg/m2,疗程42 d。放疗结束后,辅助TMZ治疗,以5/28标准方案进行,TMZ 150~200 mg/m2,6个疗程(强烈推荐)。无条件用TMZ的胶母细胞瘤患者建议ACNU(或其他烷化剂药物BCNU,CCNU)90 mg/m2,d1,VM 26 60 mg/m2,d1~3,每6周1个疗程,建议4~6疗程(推荐)。有条件的单位对高级别胶质瘤的患者进行MGMT启动甲基化及IDH1/IDH2突变的检测(强烈推荐)。复发/补救治疗:可选用TMZ;贝伐珠单抗+化疗药物(依立替康、BCNU和TMZ);亚硝脲类;PCV联合方案;环磷酰胺;或铂类化疗药。新诊断的间变性胶质瘤(AA、AO、AOA WHO Ⅲ级):AA采用TMZ同步放/化疗联合辅助化疗方案(同GBM)(强烈推荐)。AO和AOA采用TMZ同步放/化疗联合辅助化疗方案(推荐)。放疗联合亚硝脲类化疗药物:PCV(洛莫司汀+甲基苄肼+长春新碱)联合方案或ACNU方案(推荐)。复发/补救治疗:可选用TMZ;亚硝脲类;PCV联合方案;贝伐珠单抗;贝伐珠单抗+化疗药物(伊立替康、BCNU、TMZ);依立替康;环磷酰胺;铂类化疗药;或依托泊苷。③髓母细胞瘤:对无蛛网膜下腔转移的儿童髓母细胞瘤术后进行化疗(推荐),但不能替代放疗,不推荐放疗前后进行夹心法化疗。有蛛网膜下腔转移的儿童髓母细胞瘤的化疗疗效不理想,没有证据支持夹心法化疗能提高总体疗效。成人髓母细胞瘤术后进行化疗,夹心法化疗能够提高总体治疗效果(推荐)。<3岁的婴幼儿髓母细胞瘤术后单独给予化疗,大剂量冲击化疗可延缓或避免婴幼儿术后放疗所带来的近期及长期并发症(推荐)。
(1)随访原则:鼓励患者及家属与主诊的外科、放疗以及化疗医师密切联系,定期随访。高级别脑胶质瘤放疗中以及放疗后1个月各随访1次MRI,以后每3月随访1次MRI。低级别脑胶质瘤第1年每3个月随访1次MRI,第2~5年每半年随访1次MRI,5年后每年1次。化疗期间需定期随访血常规、尿常规、血生化指标、肝肾功能以及心电图等。髓母细胞瘤和室管膜瘤有脊髓沿脑脊液播散的风险,必要时须行脊髓MRI检查。(2)复发患者的再治疗原则:复发性胶质瘤依据患者的实际情况可再手术切除(推荐)。不适合再手术的患者,若间隔时间较长可酌情再接受放疗和(或)化疗(推荐);化疗失败者,可改变化疗方案和(或)选用分子靶向治疗。有条件者,推荐其自愿加入临床试验治疗。此外,尽可能维持复发患者的身心健康,保持生活质量。
对于伴有神经系统功能障碍患者,应该尽早进行康复治疗。
组长:周良辅(复旦大学附属华山医院神经外科)、王任直(中国医学科学院北京协和医学院北京协和医院神经外科)
组员(按姓名拼音字母排列):鲍圣德(北京大学第一医院神经外科)、陈忠平(中山大学附属肿瘤医院神经外科)、范建中(南方医科大学南方医院康复科)、冯晓源(复旦大学附属华山医院放射科)、傅震(南京医科大学第一附属医院神经外科)、高培毅(首都医科大学附属北京天坛医院神经影像中心)、胡永善(复旦大学附属华山医院康复科)、江涛(首都医科大学附属北京天坛医院神经外科)、雷霆(华中科技大学同济医学院附属同济医院神经外科)、李新钢(山东大学齐鲁医院神经外科)、卢亦成(第二军医大学长征医院神经外科)、马林(解放军总医院放疗科)、马文斌(中国医学科学院北京协和医学院北京协和医院神经外科)、毛颖(复旦大学附属华山医院神经外科)、漆松涛(南方医科大学南方医院神经外科)、邱晓光(首都医科大学附属北京天坛医院放疗科)、盛晓芳(复旦大学附属华山医院伽玛医院放疗科)、王茂斌(首都医科大学宣武医院神经外科)、汪寅(复旦大学附属华山医院病理科)、王运杰(中国医科大学附属第一医院神经外科)、吴浩强(香港中文大学医学院神经病理科)、吴劲松(复旦大学附属华山医院神经外科)、吴少雄(中山大学附属肿瘤医院放疗科)、夏廷毅(解放军总医院放疗科)、杨学军(天津医科大学总医院神经外科)、姚瑜(复旦大学附属华山医院神经外科)、毛庆(四川大学附属华西医院神经外科)、于金明(山东省肿瘤医院放疗科)、赵世光(哈尔滨医科大学第一附属医院神经外科)、张建民(浙江大学医学院附属第二医院神经外科)、章翔(第四军医大学西京医院神经外科)、周定标(解放军总医院神经外科)。
后记:(1)本指南对证据的推荐意见是基于当前公开发表的中英文文献资料,尚未收录其他语种、会议汇编以及未公开发表的文献。因此,可能存在选择性偏倚。(2)由于中枢神经胶质瘤的诊断和治疗以及相关学科在不断发展,本指南有时限性,编写组将与时俱进,更新指南。(3)本指南供临床医生和有关部门参考应用,但是,不做法律依据。应结合临床和患者具体情况应用。不当应用本指南所产生的不良后果,编写组不负任何法律责任。(4)本指南的编写得到默沙东(中国)公司的支持和协助,在此表示感谢。





























