版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性肾脏病(chronic kidney diseases,CKD)是危害人类健康的重大疾病,全球CKD患病率8%~16%[1,2,3,4]。2012年我国流行病学调查结果显示,CKD患病率为10.8%,患者总数约为1.19亿[2];至2017年患者人数上升至1.32亿[5],已成为我国严重的公共卫生问题。
高钾血症是CKD患者常见的代谢并发症之一,也是CKD晚期主要死亡原因之一。由于高钾血症的发生隐匿,缺乏特异性治疗手段,临床上对CKD患者引起的高钾血症普遍认识不足。为了促进临床医师对CKD患者高钾血症的风险认知与管理,由该领域相关专家组成工作组制定本《慢性肾脏病高钾血症风险评估及管理专家建议》(以下简称"本建议"),对CKD患者高钾血症的风险评估及管理提出建议,以期做到早发现、早诊断、早治疗,改善患者的预后。
高钾血症虽然是CKD最主要的代谢并发症之一,但临床表现多无特异性。早期多表现为乏力、恶心、心动过缓。随着血钾的升高会出现肢端麻木、肌无力、血压降低、神志恍惚、嗜睡,严重者可引起呼吸困难、低血压、心律不齐,如不及时治疗,严重的高钾血症会导致心脏骤停甚至死亡[6,7]。
日本一项大型真实世界队列研究分析了临床实践中高钾血症的发生率,结果显示,高钾血症在总人群中发生率约为6.8%,在CKD患者中为22.8%[8]。美国一项针对245 808例有血清钾数据患者的回顾性队列研究显示,随着CKD的进展,高钾血症发生率逐渐升高,其中在CKD 4~5期患者中的发生率高达40%以上[9]。
高钾血症的危害主要包括:(1)加快肾脏病进展,持续、反复发生的高钾血症较单次高钾血症明显促使血清肌酐升高或增加终末期肾病进展风险[10]。(2)增加心血管相关死亡和全因死亡风险。有研究表明,血钾>5.0 mmol/L与长期不良事件相关;血钾>6.0 mmol/L,可使患者死亡风险增加30倍[11]。G3a期患者血清钾5.1~5.4、5.5~5.9和≥6.0 mmol/L的3年病死率分别为10.31%、11.43%和22.64%[8]。(3)导致肾素-血管紧张素-醛固酮系统抑制剂(renin-angiotensin-aldosterone system inhibitors,RAASi)减量甚至停药。在RAASi治疗患者中,轻度高钾血症者(5.1~5.4 mmol/L)中38%存在药物减量或停药;中重度高钾血症者(≥5.5 mmol/L)中47%存在药物减量或停药[12]。(4)导致患者紧急住院、心血管事件等诸多不良后果,其中高钾血症患者6个月内的住院风险是非高钾血症患者的2.11倍,需要重症监护的风险是4.77倍;发生室性心律失常风险是2.29倍,心脏骤停风险是3.26倍[13]。(5)高钾血症严重时需要进行心电监护并采取急救[14],给患者带来沉重的经济负担。
高钾血症不仅发生率高,随着患者病情的逐步进展,其复发风险也逐步增加,且复发间隔时间逐渐缩短,给临床治疗带来困难,并导致心血管相关死亡风险和全因死亡风险的增加[15,16],已成为CKD终末期患者的重要死亡原因。
近年来临床上已开始提出将高钾血症诊断临界值前移。在最新发布的《中国慢性肾脏病患者血钾管理实践专家共识》中推荐血钾>5.0 mmol/L即可诊断高钾血症[17]。高钾血症诊断标准前移有利于加强临床医师对高钾血症的重视,提高警惕并综合各种高危因素,整体评估患者的风险。本建议推荐血清钾≥5.0 mmol/L作为高钾血症的诊断标准。
在CKD患者中,钾摄入与排泄的失衡是造成高钾血症的根本原因。其主要危险因素包括代谢性酸中毒、未及时透析治疗、透析不充分、使用保钾利尿剂和RAASi等[9,23,24,25]。通过对高钾血症危险因素的分析与典型患者的特征描述,有助于临床医师更好地识别CKD患者是否存在发生高钾血症的高危因素,并针对高风险人群进行积极地筛查与管理。
研究显示,75岁以上G3~5期CKD合并心力衰竭、糖尿病、正在服用升血钾药物(如RAASi)[9,26,27,28]的患者是高钾血症高风险人群。其他因素还包括使用钙调磷酸酶抑制剂[29]、非甾体抗炎药[29]、经常使用中药煎剂。CKD患者常合并糖尿病、心血管疾病等慢性病,存在多种干扰钾排泄的危险因素。RAASi也是引起CKD患者并发高钾血症最主要的药物[30],其可增加CKD患者约7%的高钾血症发生率[31]。此外,中药煎剂的使用也可增加高钾血症的风险,包括中药本身含钾量高以及中药抑制钾的排出。此外,中国人群的饮食谱中高钾食物较多[32]。其他高危因素还包括其他保钾利尿剂、钾补充剂等[30]。
因此,CKD患者高钾血症的成因相当复杂,有必要针对常见的因素进行分析,筛选出影响较大的高危因素,以利于高钾血症的早期识别与积极管理。
由于高钾血症临床表现缺乏特异性,其在我国的诊断率与治疗率均较低。加之高钾血症的长期持续与反复发作,以及对CKD患者预后的不良影响,加强对高钾血症发生风险的筛查与评估显得尤为必要,对疾病预后也具有重要意义。
近年来,有学者通过对高钾血症的危险因素进行分析并构建预测模型,对CKD患者发生高钾血症的风险进行评估。Bandak等[37]基于6.9万例CKD患者的随访数据建立风险评估模型,对患者1年内发生高钾血症的风险进行预测。但该模型为对数线性模型,计算较为复杂,临床应用具有一定的困难。Johnson等[28]对5 171例CKD患者的随访数据进行回顾性分析,通过对危险因素进行评估,构建风险评分系统,对高钾血症的发生风险进行预测,该系统操作简便,临床实用性较强。
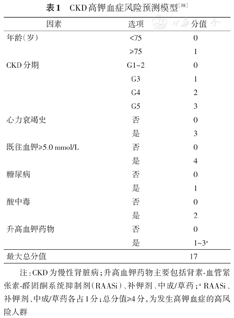
尽管国内外越来越重视CKD高钾血症风险的评估,但目前国内尚缺乏一种方便实用的筛查工具。本建议专家组在借鉴国际相关风险评估模型的基础上,通过对14个研究中心,847例CKD患者的回顾性研究,探索并验证各因素与发生高钾血症的关联,兼顾使用的便捷性,初步构建了慢性肾脏病高钾血症风险预测模型,将各项目对应得分相加的总分值作为风险评分,总分值≥4分为发生高钾血症的高风险人群(表1)[38]。
要做到对CKD高钾血症的早发现、早干预,就必须对CKD患者的血钾监控"关口前移",并进行分级管理。对于已发生过高钾血症的患者,血钾管理的重点是减少复发,维持血钾稳定,避免因血钾波动而造成相关风险。对于未发生过高钾血症的患者,预防高钾血症的发生是管理的重点,而进行高钾血症风险的提前评估是关键。
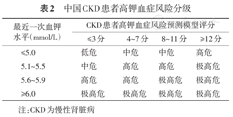
本建议推荐采用"慢性肾脏病高钾血症风险预测模型"(表1)对CKD患者进行高钾血症的风险评估,并结合最近一次的血钾水平,将风险人群分为:低危、中危、高危、极高危四个等级,即便既往未发生过高钾血症,若提示为中高风险人群,也应该加强监测(表2)。
中国CKD患者高钾血症风险分级
中国CKD患者高钾血症风险分级
| 最近一次血钾水平(mmol/L) | CKD患者高钾血症风险预测模型评分 | |||
|---|---|---|---|---|
| ≤3分 | 4~7分 | 8~11分 | ≥12分 | |
| ≤5.0 | 低危 | 中危 | 中危 | 高危 |
| 5.1~5.5 | 中危 | 高危 | 高危 | 极高危 |
| 5.6~5.9 | 高危 | 高危 | 极高危 | 极高危 |
| ≥6.0 | 极高危 | 极高危 | 极高危 | 极高危 |
注:CKD为慢性肾脏病
管理原则:"关口前移"着眼于预防为主;针对不同风险人群,采取针对性的治疗措施(表3)。

CKD高钾血症风险人群的血钾监测与管理
CKD高钾血症风险人群的血钾监测与管理
| 治疗建议 | 低危 | 中危 | 高危 | 极高危 |
|---|---|---|---|---|
| 饮食 | 普食 | 低钾饮食,患者教育 | 低钾饮食,患者教育 | 低钾饮食,患者教育 |
| 监测频率 | 监测血钾和评估风险,每3个月1次 | 监测血钾和评估风险,每个月1次 | 监测血钾和评估风险,每周1次 | 监测血钾和评估风险,每周1次或更多频次 |
| 治疗管理 | •优化RAASi单药治疗以达到最大耐受剂量 | (1)当患者血钾<5.0 mmol/L:•优化RAASi单药治疗以达到最大耐受剂量(2)当患者血钾5.0~5.5 mmol/L:•维持RAASi治疗,推荐长期服用降钾药物(如新型钾离子结合剂环硅酸锆钠散或降钾树脂),或酌情使用排钾利尿剂,但需要严密监测以免低血容量及eGFR下降。在联合用药中,每周复查血钾1次,直至血钾稳定在正常范围,以后可每个月复查血钾1次;停止服用中药煎剂 | (1)当患者血钾<5.0 mmol/L:•优化RAASi单药治疗以达到最大耐受剂量,密切监测血钾(2)当患者血钾5.0~5.5 mmol/L:•维持RAASi治疗,推荐长期服用降钾药物。在联合用药中,每周复查血钾1次,直至血钾稳定在正常范围,以后可每个月复查血钾1次;停止服用中药煎剂(3)当患者血钾>5.5~6.0 mmol/L:•酌情减少或停止RAASi的使用,使用降钾药物将患者血钾控制到5.0 mmol/L以下,启动RAASi治疗。在联合用药中,每周复查血钾1次,直至血钾稳定在正常范围,以后可每个月复查血钾1次 | (1)当患者血钾5.0~5.5 mmol/L:•维持RAASi治疗,推荐长期服用降钾药物。在联合用药中,每周复查血钾1次,直至血钾稳定在正常范围,以后可每个月复查血钾1次;停止服用中药煎剂(2)当患者血钾>5.5~6.0 mmol/L:•酌情减少或停止RAASi的使用,当使用降钾药物将患者血钾控制到5.0 mmol/L以下后,启动RAASi治疗。在联合用药中,每周复查血钾1次,直至血钾稳定在正常范围,以后可每个月复查血钾1次(3)当患者血钾>6.0 mmol/L时:•停止RAASi的使用,使用降钾药物,酌情加用利尿剂、纠酸剂或血液透析治疗;将患者血钾控制到5.0 mmol/L以下后,小剂量启动RAASi治疗。在联合用药中酌情增加RAASi剂量,每周复查血钾1次,直至血钾稳定在正常范围,以后可每个月复查血钾1次 |
注:CKD为慢性肾脏病;RAASi为肾素-血管紧张素-醛固酮系统抑制剂;eGFR为估算肾小球滤过率
管理目标:对于未发生过高钾血症的人群,进行提前评估与管理,预防高钾血症的发生;对已发生过高钾血症的患者,进行持续风险评估,减少复发频率,保持血钾稳定,避免血钾波动。
除此之外,部分治疗药物(如RAASi)亦可增加高钾血症的发生风险,需在保证患者生存获益最大化及降低高钾血症发生风险的前提下,尽可能避免RAASi的停用或减量。
本建议对CKD患者高钾血症风险筛查与评估以及分级管理提出建议,这对高钾血症的早期发现与精准管理,改善患者预后具有重要意义。考虑到社区人群和医院人群在高钾血症的原因与处理上存在不同,后期将对这两类人群进行区分并建立针对性的预测模型,使预测与处理更精准。
所有作者均声明不存在利益冲突