
结直肠锯齿状病变是一组异质性病变,主要包括增生性息肉、广基锯齿状病变、广基锯齿状病变伴异型增生、传统锯齿状腺瘤、锯齿状管状绒毛状腺瘤和无法分类型锯齿状腺瘤6大组织学类型。这些锯齿状病变近年有不同程度的研究新进展,作者通过对这类病变的典型形态学、不同组织学亚型和分子遗传学改变的总结和病例分析,强调这些病变的诊断要点、鉴别诊断及临床病理意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠锯齿状病变是指具有锯齿状结构的共同特征,但具体形态和分子遗传学存在明显异质性的一组病变,在结直肠非浸润性上皮性病变中发生率仅次于普通型腺瘤。“胃肠道腺瘤和良性上皮性息肉的病理诊断共识”(简称“共识”)[1],对这类病变作了概括和阐述,已帮助大家从整体上把握这类疾病。我们希望通过对不同亚型的详细介绍和新进展的总结,进一步提高病理医师对这类病变的认识以及诊断和鉴别诊断的能力。
WHO消化系统肿瘤分类(2019版)将锯齿状病变分为:增生性息肉(hyperplastic polyp,HP)、广基锯齿状病变(sessile serrated lesion,SSL)、广基锯齿状病变伴异型增生(sessile serrated lesion with dysplasia,SSLD)、传统锯齿状腺瘤(traditional serrated adenoma,TSA)和无法分类的锯齿状腺瘤(unclassitied serrated adenoma,SSAU)共5类,其中SSAU包括无法明确是SSLD或TSA的病变,以及锯齿状管状绒毛状腺瘤(sessile tubulovillous adenoma,STVA)[2]。考虑到STVA有独特的形态及分子遗传学改变,故本文将其单独分类,共分为6大类:HP、SSL、SSLD、TSA、STVA和SSAU。
HP在广义的锯齿状病变中约占3/4,多见于直肠和左半结肠。常为多发、<0.5 cm广基、扁平的小息肉,表面光滑,与周围黏膜色泽相同。少见情况下,表现为大体无明显改变,仅镜下发现单个或数个隐窝结构异常的畸形腺窝灶(aberrant crypt foci)。HP镜下特点共识内已描述,主要是隐窝上2/3上皮增生,形成小乳头突入隐窝腔内,使腔面呈锯齿状(图1A)[1]。隐窝整体结构和细胞增殖部位正常,部分HP隐窝基底细胞增生活跃伴神经内分泌细胞增生。少数HP出现内陷性生长,上皮下胶原增厚,间质除了炎性细胞或组织细胞浸润外,偶尔出现纤维母细胞甚至神经束衣细胞的增生。
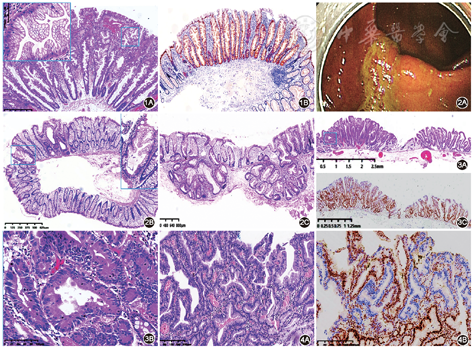

(图1B为青岛大学附属医院病理科王丽丽博士提供)
按细胞组成和分子遗传学改变不同,HP分为2种:(1)微泡型增生性息肉(hyperplastic polyp,microvesicular type,MVHP):最常见,上皮胞质丰富,内含丰富小泡的黏液,杯状细胞减少,细胞形态非常类似胃小凹上皮(图1A)。黏液表型也常为胃肠混合型:MUC2+/MUC5AC+/MUC6部分阳性。其中MUC5AC低甲基化导致其免疫组织化学的异常表达,可能是评价HP恶性变的潜在标志[3]。遗传学上MVHP 70%~80%有BRAF的突变,存在CpG岛甲基化,无KRAS突变[4]。BRAF的突变可经BRAF V600免疫组织化学证实(图1B)。(2)富杯状细胞型增生性息肉(hyperplastic polyp,goblet cell-rich type,GCHP):锯齿状结构不明显,仅限于近表面的腺体,横切面腺体为圆形而非星芒状。主要的诊断依据是这些腺体几乎都由杯状细胞组成,较周围正常的腺体更长、更大,可出现分支或扭曲。黏液表型一般为肠型:MUC2+/MUC5AC-。没有BRAF突变和CpG岛甲基化,KRAS突变率为50%。此外,之前定义的少黏液型增生性息肉(mucin-poor,hyperplastic polyp)现归属为MVHP,黏液减少是因病变受损引起的上皮再生性改变[5]。虽然目前在临床治疗和随访策略上MVHP和GCHP没有明显差异,因此日常工作中并不强求分开诊断,但考虑到两者的形态及分子改变明显不同,形态典型的病例我们建议尽量诊断到位,以便后续追踪随访及研究。
SSL好发于右半结肠,常>0.5 cm。由于内镜下息肉广基无蒂,表面光滑,常覆黏液(图2A),故容易漏诊。SSL组织学诊断要求≥1个隐窝出现特征性的结构改变[2]:(1)整个隐窝呈锯齿状;(2)隐窝沿黏膜肌层水平生长;(3)基底部(隐窝下1/3)扩张、异常成熟;(4)不对称的增殖(上皮增生区不在隐窝基底,图2B、2C)。其中不对称增殖导致的整个隐窝结构改变是和HP主要的不同之处。需要强调的是,在对SSL单个隐窝进行评估时,结构变化应是明显和典型的,且病变无腺体不规则增生、变形和间质纤维化等黏膜脱垂表现。SSL细胞组成类似于MVHP,一般是胞质内微泡状黏液丰富的细胞,可有不等量的杯状细胞,部分可伴较多内分泌细胞增生。SSL部分隐窝也可以内陷性生长(图2C),间质伴炎性细胞浸润或脂肪组织增多,约6%的病例间质出现神经束衣细胞(瘤样)增生,这些间质细胞并没有和上皮一样有BRAF基因的改变[6],因此可能是一种反应性的增生[6]。SSL与HP相比,黏蛋白染色基本相似:MUC2+/MUC5AC+/MUC6部分阳性;不同之处在于隐窝增殖区扩大,Ki-67显示不对称性阳性,隐窝底部不表达区较正常扩大。Annexin A10在SSL中较MVHP更明显的阳性表达[7]。SSL无MLH1蛋白表达缺失,无p53和p16蛋白异常表达,无KRAS突变,但SSL存在CpG岛高甲基化,>90%有BRAF基因突变。
SSLD同样好发于右半结肠,一般病灶较大。组织学上SSLD具明显的异质性,共同及最主要的特征是出现不同于周围SSL的隐窝结构异常,包括出现绒毛状结构,隐窝变长、更拥挤、分支复杂、呈筛状,或与背景SSL相比锯齿增多或减少。根据形态及MLH1蛋白表达不同,又可分为4种亚型[2, 8, 9, 10]。(1)肠型(腺瘤样,adenomatous dysplasia)异型增生:锯齿状结构消失,胞质嗜碱性,核瘦长、深染,排列拥挤假复层,不同程度杯状细胞分化,病变以病灶上半部明显,此型最少见,约占8%。少数学者认为这是普通型腺瘤和SSL的碰撞。绝大多数病例MLH1蛋白表达正常(阳性表达)。(2)锯齿状异型增生(serrated dysplasia):锯齿结构较周围SSL变少,腺体变小、紧密排列。胞质嗜酸,核大复层、卵圆形,核仁明显,核分裂象易见(图3A、3B)。MLH1蛋白表达正常(图3C)。(3)微小偏离型(minimal deviation)异型增生:与周围SSL相比,结构上出现隐窝拥挤、分支复杂等细微变化,锯齿通常减少。细胞往往具有高黏液性,或轻度嗜酸性并伴有胃黏液表型,核位于细胞基底部伴轻度深染,核分裂象不局限于隐窝下部(图4A),此型约占20%。100%的MLH1蛋白表达缺失阴性(图4B)。(4)非特殊型异型增生(dysplasia not otherwise specified):出现无法归类于上述3种的异型,形态上出现易于识别和明显变化的结构外观,包括隐窝变长、拥挤、分支复杂,锯齿形状改变,这些不同于周围SSL的形态;胞质嗜双色或嗜酸性,核深染、极性丧失,核分裂象增多(图5A)。文献报道此亚型最常见(约80%)。80%以上病例MLH1阴性(图5B)。在少数SSLD病例可同时出现上述多种不同形态的异型增生。

因SSLD形态往往比较复杂且不同亚型混杂存在,其异型增生的程度(低级别或高级别)区分比较困难,同时MLH1蛋白表达缺失与异型增生程度无相关性,因此不推荐SSLD异型增生分级[2]。MLH1蛋白阴性是诊断微小偏离型SSLD必需的条件[2, 8],但因形态改变轻微,因此SSL出现细微结构和/或细胞改变时应积极进行MLH1蛋白检测,以免漏诊。但要强调的是,MLH1表达缺失仅局限于一个或数个组织学上并无异常的锯齿状隐窝时,不应被视为SSLD[8]。在微小偏差型SSLD中,MLH1表达缺失涉及多个相邻隐窝的全长,这些隐窝在HE切片上总是有一些与周围SSL不同的形态学改变。75%以上的SSLD表现为高CpG岛甲基化表型(CIMP)和BRAF高突变率[11],约25%的病例涉及的是WNT经典腺瘤癌变途径,表现为错配修复蛋白正常和p53基因突变型,出现p53、p16蛋白强阳性和β-catenin核阳性[12]。SSLD因增殖区更异常,Ki-67染色阳性部位表现为范围更广、更不对称和更接近表面。
较少见,文献报道约占结直肠总息肉的2%,但因晚期的TSA可能与普通型腺瘤相似,而扁平TSA常被报告为SSLD,故发病率可能被低估。
TSA以老年及女性多见,左半结肠为主。一般病灶较大,有蒂绒毛状为典型特征,少数扁平无蒂。组织学特点:(1)肿瘤细胞一致,胞质丰富和明显嗜酸性,核卵圆形或铅笔样,似小肠吸收上皮,一般无核分裂象。(2)细裂隙状锯齿结构。(3)异位隐窝形成,这些隐窝基底部远离黏膜肌层[8]。当病变具备(2)和(3)2个特征时,需要多少符合条件(1)的细胞比例才能诊断TSA,目前没有定论[10],但至少灶性嗜酸胞质的细胞是必需的。TSA周围可出现SSL区域,当病变同时具有两者特征时应该诊断为TSA[8]。
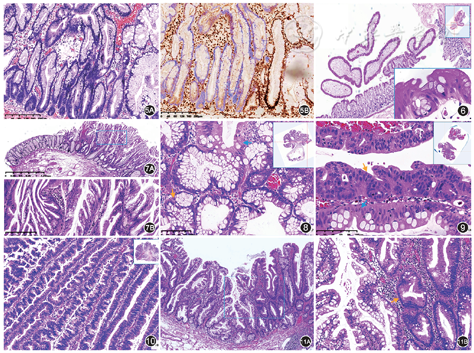
除了经典的形态外,TSA还有3种亚型。(1)丝状TSA(filiform TSA):是一种特殊生长方式的TSA,主要见于直肠。其绒毛的特征是细长,呈丝状,间质水肿,顶端呈鼓槌状[13],组织学特征和典型者相似(图6)。(2)扁平TSA(flat TSA):指病变的高度不超过邻近正常黏膜的2倍,且无明显绒毛状突起者,多见于右半结肠。病变可见典型的嗜酸性细胞和裂隙状锯齿结构,但可能缺乏异位隐窝的形成(图7A、7B),异位隐窝并不是诊断扁平TSA的必要条件[8]。(3)富黏液/杯状细胞型TSA(mucin-rich/goblet cell-rich TSA):指具有典型细锯齿状、至少有局灶异位隐窝,同时杯状细胞>50%的TSA(图8)[14]。
虽然TSA具恶性潜能,但其典型的细胞和普通型腺瘤显著不同,如胞质明显嗜酸性,核卵圆形,染色质细;且核分裂象无或罕见,Ki-67阳性指数低,有学者认为这可能是一种衰老的细胞[15],但更多学者将之称为TSA样或低级别锯齿状异型增生[8],以区别肠型和高级别锯齿状异型增生。当然,部分TSA尤其是较大的TSA往往出现明确的异型增生,而且以高级别锯齿状异型增生常见(图9),有时肠型和锯齿状异型增生可以同时出现在同一病例中。当TSA出现这两种异型增生时,提示病变进入进展期,而且伴高级别锯齿状异型增生者更易发展为浸润性癌[8]。
TSA发展为癌的过程中涉及的基因改变较复杂,有异质性,病变早期即有基因改变[16],但都没有MLH1蛋白的缺失。TSA不同基因的突变率和病灶部位、组织亚型及周围病变有一定的相关性,BRAF突变率20%~40%,主要见于扁平或富黏液型TSA,周围常见MVHP或SSL;KRAS突变率为50%~70%,常见于左半结肠,周围可伴GCHP[8]。另外TSA还伴有APC基因的截短突变,较频繁RNF43的改变和RSPO基因家族的融合,这些都增强了WNT信号以及某种程度的CIMP[17]。
STVA在WHO(2019版)分类中属于SSAU,因该腺瘤有独特的形态及分子遗传学改变,因此在本文中单列。其定义是指腺瘤同时具有以下特征:(1)>25%的绒毛成分;(2)>50%的腺体异位隐窝形成;(3)<10%的具有TSA型细胞学(嗜酸性胞质)和裂隙样锯齿(图10)[18]。
与普通管状绒毛状腺瘤(conventional tubulovillous adenoma,CTVA)相比,STVA更常见于近端,多表现为进展期腺瘤的组织学改变,如体积大、绒毛状结构明显、细胞呈高级别异型增生等,而且当出现高级别异型增生和浸润性癌时腺体常呈锯齿状。分子遗传方面,STVA较CTVA中KRAS突变和CIMP更频繁;与BRAF野生型TSA相比,STVA中CIMP更少,MGMT甲基化频繁,β-catenin核染色更常见。在STVA中也没有发现MLH1蛋白表达缺失,相反地,强核p53蛋白染色在晚期STVA中更为多见。STVA可能是KRAS突变、微卫星稳定结直肠癌的前期病变[18]。
临床工作中,少数有异型增生的锯齿状病变不属于典型的TSA、SSLD和STVA,导致分类困难,可称为SSAU。另外伴小范围嗜酸性细胞的SSL(图11A、11B),有学者认为这些可能是衰老而不是异型细胞[15],也有学者认为是肠上皮化生(enteric metaplasia),甚至认为是伴低级别锯齿状异型增生或伴TSA特征[8],对此意见不一,意义不明,也可暂归类于SSAU。这类SSAU和扁平TSA都以右半结肠常见,呈广基无蒂,异位隐窝不明显,有嗜酸性细胞。两者主要的区别在于嗜酸性细胞在SSAU较局限,在扁平TSA中往往弥漫并累及整个隐窝。这种伴小范围嗜酸性细胞的SSL(SSAU)可能是扁平TSA的早期改变。
不同锯齿状病变和息肉的形态特征、免疫组织化学及分子改变见表1。
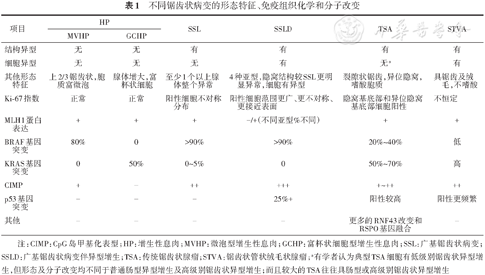
不同锯齿状病变的形态特征、免疫组织化学和分子改变
不同锯齿状病变的形态特征、免疫组织化学和分子改变
| 项目 | HP | SSL | SSLD | TSA | STVA | |
|---|---|---|---|---|---|---|
| MVHP | GCHP | |||||
| 结构异型 | 无 | 无 | 有 | 有 | 有 | 有 |
| 细胞异型 | 无 | 无 | 无 | 有 | 无a | 有 |
| 其他形态 特征 | 上2/3锯齿状,胞质富微泡 | 腺体增大,富杯状细胞 | 至少1个以上腺体整个异常 | 4种亚型,隐窝结构较SSL更明显异常,细胞有异型 | 裂隙状锯齿,异位隐窝,嗜酸胞质 | 具锯齿及绒毛,不嗜酸 |
| Ki-67指数 | 正常 | 正常 | 阳性细胞不对称分布 | 阳性细胞范围更广、更不对称、更接近表面 | 隐窝基底部和异位隐窝基底部细胞阳性 | 不恒定 |
| MLH1蛋白表达 | + | + | + | -/+(不同亚型%不同) | + | + |
| BRAF基因突变 | 80% | 0 | >90% | >90% | 20%~40% | 低 |
| KRAS基因突变 | 0 | 50% | 0~5% | 0 | 50%~70% | 高 |
| CIMP | + | - | ++ | +++ | +~++ | ++ |
| p53基因 突变 | - | - | - | 25%+ | 阳性较高 | 阳性更频繁 |
| 其他 | - | - | - | - | 更多的RNF43改变和RSPO基因融合 | - |
注:CIMP:CpG岛甲基化表型;HP:增生性息肉;MVHP:微泡型增生性息肉;GCHP:富杯状细胞型增生性息肉;SSL:广基锯齿状病变;SSLD:广基锯齿状病变伴异型增生;TSA:传统锯齿状腺瘤;STVA:锯齿状管状绒毛状腺瘤;a有学者认为典型TSA细胞有低级别锯齿状异型增生,但形态及分子改变均不同于普通肠型异型增生及高级别锯齿状异型增生;而且较大的TSA往往具肠型或高级别锯齿状异型增生
HP尤其是近端MVHP可能是SSL的前身,而GCHP和一些MVHP有发生TSA的危险性。但因HP总体发生癌变的几率低,间隔时间长,尤其是较小病灶和/或左半结肠者,因此这些患者仅需常规间隔5~10年肠镜复查。但较大的HP和SSL在形态学上比较难区分,因此有学者认为>10 mm的HP应视为SSL,以便临床采取相对积极的处理和随访策略[4]。SSL和TSA是明确的癌前病变。但SSL进展为癌的过程一般较缓慢,有时可长达十几年[19];而且癌变风险和病变大小有一定的相关性。但一旦SSL伴有异型增生(即SSLD),病变可能很快进入癌变及浸润环节[10],因此当SSL较大或为SSLD时,除了推荐2~6个月内进行原病灶位置的复查外,间隔3年需肠镜随访。
TSA和STVA的随访策略同普通型腺瘤,即和肿瘤大小、异型增生程度和切除情况等相关。伴高级别异型增生的TSA、STVA和SSLD都属于进展期腺瘤,这些患者需要相对短的肠镜随访间期(3年而非常规的5~10年)。
结直肠锯齿状病变和息肉具有一定的形态学和分子学特点,不同学者也给予了不同的名称,虽然我们对此进行了较为详细的介绍,但在日常工作中,非消化亚专业的病理医师对此作出正确的诊断还是有一定的难度。相信通过对这类病变进一步的免疫组织化学和分子研究,提出与生物学行为更有关的简化分类将是未来几年该领域的研究重点。
所有作者均声明不存在利益冲突



























