
探讨卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)并发血栓的高危因素、预防、治疗及预后。
对青岛大学附属医院生殖医学科1例行控制性超促排卵(controlled ovarian hyperstimulation,COH)诱发重度OHSS并发颅内血栓的患者的治疗过程进行分析报道。
患者经颅内取栓、抗凝、合并症处理后顺利康复,再经2次冻融胚胎移植顺利分娩1名健康男婴。
重度OHSS并发血栓形成是COH过程中罕见却极其严重的并发症,甄别OHSS的高危因素、妥当处理合并症、个体化用药预防OHSS发生的最佳方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)并发血栓形成是辅助生殖技术(ART)罕见且极有可能危及生命的严重并发症,相关病例在国内外报道较少。下面就青岛大学附属医院生殖医学科收治的1例重度OHSS并发血栓、治愈后成功分娩的患者进行分析报道,探讨其发病的危险因素及预防和治疗方法,为此类患者的临床诊治提供启示。
患者,女,31岁,体质量指数(BMI)为27.6 kg/m²,因“原发性不孕症、左侧输卵管阻塞、多囊卵巢综合征(PCOS)、Ⅱ型糖尿病、高血压病、乙肝小三阳”于2016年5月20日就诊于青岛大学附属医院生殖医学科拟行体外受精-胚胎移植(IVF-ET)。患者进入周期前饮食控制血糖,间断服用盐酸二甲双胍缓释片(麦特美,青岛黄海制药),空腹血糖(FPG)控制在6~8 mmol/L,空腹胰岛素为28.67 μIU/mL;血压波动在130~150/80~95 mmHg,因无自觉不适且依从性较差,未遵医嘱服用降压药。
2016年8月1日患者行第1周期IVF-ET,采用黄体期短效长方案促排卵,促性腺激素(Gn)用药13 d、Gn总量2925 IU,扳机前一日雌二醇水平>11 010 pmol/L(本院检测值上限),取卵2枚,成胚1枚(6CII),因子宫内膜因素未行新鲜胚胎移植。2016年11月12日行第2周期IVF-ET,周期第2日卵泡刺激素(FSH)为4.87 IU/L,黄体生成素(LH)为6.84 IU/L,雌二醇为194 pmol/L,孕酮为3.21 nmol/L。采用短方案促排卵,皮下注射醋酸曲普瑞林(达必佳,德国辉凌制药)0.05 mg、肌内注射尿促性腺激素(hMG,珠海丽珠制药)150 IU+尿促卵泡素(丽申宝,珠海丽珠制药)150 IU启动。Gn第6日雌二醇水平>11 010 pmol/L,逐渐减少Gn用量。Gn持续使用11 d、Gn使用总量为2550 IU。周期第13日优势卵泡(直径>14 mm)达到扳机标准,B超示双侧卵巢明显增大,直径>14 mm卵泡20枚,稀释后查雌二醇水平为110 117 pmol/L,当晚肌内注射人绒毛膜促性腺激素(hCG,珠海丽珠制药)6000 IU。扳机后36 h行取卵术,获卵16枚,过程顺利。患者于取卵后12 h开始出现恶心、呕吐、腹胀,伴胸闷、憋气,尿量较前减少,体温正常,于取卵后当日晚间急诊就诊,急查白细胞计数(WBC)为21.34×109/L,红细胞比容(Hct)为55.30%,全血C反应蛋白(CRP)为16.59 mg/L,D-二聚体为670.00 μg/L,血钠水平为131.0 mmol/L,随机血糖(Glu)为14.48 mmol/L,妇科B超提示右侧卵巢大小约15.2 cm×12.2 cm×9.2 cm,左侧卵巢约13.8 cm×8.1 cm×6.8 cm,腹、盆腔内探及液性回声,较深处约4.1 cm,考虑重度OHSS。予以补液、抗凝等治疗,症状未见明显缓解。常规IVF授精,共获得4枚有效胚胎(3枚8CII、1枚7CII),冷冻保存。取卵术后第4日,患者突然出现肌力下降并跌倒,左侧肢体活动不灵,伴嗜睡,急症收入院。入院时血压120/91 mmHg,呼吸26次/min,心率120次/min,体温36.8 ℃,查体示瞳孔等大等圆,直径约3 mm,对光反射存在,双眼向右侧凝视,口角右歪,腹膨隆,左侧上下肢肌力为0级,右侧肌力5级,右侧肌张力正常。急查WBC为18.83×109/L,Hb为160 g/L,Hct为46.40%,D-二聚体为4 090.00 μg/L,纤维蛋白原(FIB)为4.86 g/L,CRP为12.42 mg/L,白蛋白为28.50 g/L,总胆固醇(TC)为7.25 mmol/L,甘油三酯(TG)为3.63 mmol/L,行颅脑CT提示矢状窦、直窦、双侧横窦、双侧乙状窦及额部部分静脉走行区密度不均匀增高X线计算机断层摄影(CT)值为70~80 Hu,考虑多发静脉窦和静脉走行区密度增高,血栓可能(图1),行颅脑磁共振静脉血管造影(MRV)提示双侧大脑大静脉-直窦、窦汇、双侧横窦显示不清,上矢状窦及其属支略扩张,考虑静脉血栓形成可能性大(图2)。入院诊断为“肌力下降原因待诊:颅内血栓形成?、OHSS(重度)、Ⅱ型糖尿病、高血压病、高脂血症、低蛋白血症、乙肝小三阳、原发性不孕症、IVF术后(2次)”。入院后立即给予甘露醇(天津百特医疗)降颅压及低分子肝素抗凝治疗,并在局部麻醉下行经股动脉插管全脑动脉造影术+全脑血管造影+静脉窦球囊扩张+溶栓及取栓术。手术顺利。术后造影提示静脉窦较前明显通畅,上矢状窦、横窦及乙状窦均显影,脑血管回流较术前明显改善。术后继续予以补液、抗凝、降颅压、改善脑循环等对症治疗。患者恢复好,复查血WBC、D-二聚体、Hct、雌二醇水平逐渐恢复正常,于2周后顺利出院。出院后继续予以低分子肝素钠注射液(法安明,美国辉瑞药业)5000 IU皮下注射 qd抗凝治疗,定期复查,未见明显异常。
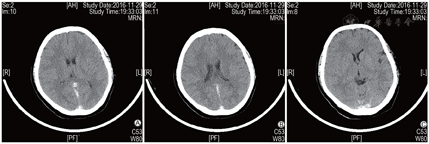

A示矢状窦; B示直窦; C示乙状窦、横窦
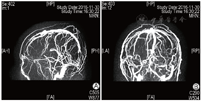

A示矢状位; B示冠状位
2018年6月13日该患者再次就诊于本院生殖医学科,强烈要求行冻融胚胎移植。入院后评估各项指标,经长期口服麦特美和硝苯地平控释片(拜新同,德国拜尔)治疗后,FPG控制在5.5~6.5 mmol/L,血压130~140/80~90 mmHg,余检查未见明显异常。经全院多学科会诊及医院伦理委员会讨论,结合患者强烈生育愿望,决定为患者实施冻融胚胎移植。2018年8月18日行第1次冻融胚胎移植,解冻胚胎2枚(均为8CII),培养24 h后移植(扩张、融合),因早孕胚胎停育于孕6周行人工流产术,患者因经济原因拒绝行胚胎染色体检查。2018年12月22日行第2次冻融胚胎移植,解冻胚胎2枚(8CII、7CII),培养24 h后移植(4CC、扩张)。移植后11 d查hCG 为278.75 IU/L,术后35 d B超提示宫腔早孕,双活胎(双绒双羊)。考虑到患者脑血栓病史,遂行减胎术,减胎过程顺利。孕期定期产检,低分子肝素钠 5000 IU 皮下注射 qd抗凝至剖宫产前24 h,于孕37周5 d足月剖宫产1名健康男婴,体质量2860 g,术后6 h继续予以低分子肝素钠抗凝治疗,术后5 d顺利出院。随访至今,患者产后恢复好,未见明显后遗症,其子未见明显异常。
OHSS是ART过程中常见的医源性并发症,发生率为20%~30%,重度OHSS发生率为1%~3%[1]。OHSS并发血栓作为一种极其严重的并发症发生率仅为0.04%[2],其中动脉血栓发生率占比约19%,通常与OHSS同时发生,且在胚胎移植后2周(平均10 d)内发生;静脉血栓占比约81%,通常出现在胚胎移植后1周至妊娠3个月内,或临床OHSS症状消退后(胚胎移植后平均40~42 d),且多位于除脑部以外的其他部位,以上肢最常见[3, 4]。在一项36例OHSS并发颅内血栓的报道中,有28例(77.8%)发生在动脉,超过一半涉及大脑中动脉和颈内动脉[5]。与OHSS相关的心肌梗塞和心脏血栓形成偶有报道[6]。OHSS并发血栓患者多数预后不佳,常遗留明显神经后遗症,治疗后能成功分娩者罕见报道。
OHSS并发血栓的确切机制尚未明确,探讨其高危因素十分重要。本例患者OHSS发生在取卵后10 d内,属早发型,分析其发病的高危因素可能有以下几个方面。原发因素包括:①患者合并PCOS,控制性超促排卵(COH)过程中卵巢的反应性高,易发OHSS[1]。②患者系Ⅱ型糖尿病、高脂血症,促排卵治疗前期血糖、血脂未经严格控制。FPG和胰岛素水平被认为是发生颅内血栓的独立危险因素[7],血糖浓度升高引起的血管壁玻璃样变性、胰岛素抵抗后产生的血脂代谢异常均使微循环血流速度减慢,血液黏稠度上升。同时胰岛素抵抗可抑制纤溶酶的活性,加剧了血栓的形成[8, 9]。③患者血压高于正常,且未予以常规降压药物控制,脑动脉可能存在诱发血栓的基础因素。继发因素包括:①高雌二醇水平。患者两次COH过程中雌二醇水平均升高迅速,特别是第2次扳机日雌二醇水平高达110 117 pmol/L。过高的雌二醇水平是OHSS发生的基础,一旦注射hCG,血管内皮因子水平迅速升高,使毛细血管渗透性增加,血液中维持渗透压稳定的胶体成分通过毛细血管渗漏至第三间隙,导致血容量减少,血液浓缩,血流减缓,微循环局部灌注不足,血管内皮受损,释放炎症因子和组织凝血因子。凝血时间缩短,凝血和纤融失衡,进而引起血栓[10]。②hCG 6000 IU作为扳机。hCG半衰期长,其生物效能是LH的4倍。hCG能够激活肾素-血管紧张素-醛固酮系统(RAAS),使肾素、血管紧张素及其转化酶的活性增加,导致毛细血管通透性增加,与凝血和抗凝系统的失衡共同导致低血容量和高凝状态[2]。③发育卵泡过多。患者hCG注射日双侧卵巢内直径≥14 mm卵泡20枚,最终获卵16枚。大量卵泡生长通过上述OHSS诱发机制可导致血栓发生[11, 12]。另外,患者取卵术后1 d血CRP明显升高,达16.59 mg/L。CRP作为血栓启动剂,在OHSS患者出现血管受损、血液渗透性增加后,可启动血栓的形成[13],并通过增强凝血酶活性引起凝血过快,从而加快血栓形成的速度[14]。此外,低BMI、过敏体质(自身免疫性疾病)、甲状腺功能低下、易栓症等也可引起OHSS并发血栓,但尚存争议[3,15]。
由于OHSS的医源性和自限性特点,对于存在OHSS高危因素的患者,预防优先于治疗。该患者的诊疗过程有几点启示:①ART前期应充分重视患者血栓易发基础因素,积极治疗原有疾病,使机体达到理想状态。该患者患有糖尿病、高脂血症、高血压等基础血管损伤性疾病,如在COH前得到足够的治疗,可能会减少血栓发生的危险因素。②采用个体化COH方案,降低重度OHSS的发生率。该患者合并PCOS,存在OHSS的高危因素,起始Gn剂量应适当减少。选择拮抗剂方案,可以使重度OHSS的发生率可降低约50%,克罗米芬或来曲唑微刺激方案可显著降低OHSS的发生率,高孕激素状态下促排卵方案也被认为有效[16, 17]。③根据雌二醇水平和发育卵泡数目适时调整Gn剂量。④选择合适的扳机药物和剂量。有研究认为hCG 3300 IU作为扳机即可有效促使卵母细胞成熟[18],拮抗剂方案和微刺激方案利用促性腺激素释放激素激动剂(GnRH-a)代替hCG扳机,可以直接降低卵巢中血管上皮生长因子(VEGF)的表达,降低血管通透性,显著降低早发型OHSS风险[19]。⑤其他方法如卵泡穿刺术、不成熟的卵母细胞体外培养(IVM)、应用白蛋白、羟乙基淀粉、阿司匹林、二甲双胍及多巴胺等都有助于降低OHSS的发生,可在以后的工作中尝试使用[15,20, 21]。⑥对于重度OHSS的患者,首要的治疗措施是充分纠正低血容量状态,改善微循环灌注,预防血栓形成。对于已发生血栓的患者,紧急及时的对症治疗非常重要,包括抗凝、抗血小板聚集和其他支持性治疗。介入治疗包括血管内局部溶栓和取栓术[5]。⑦患者第1次冻融胚胎移植2枚优质胚胎,孕6周胚胎停育,患者放弃胚胎染色体检查。考虑到既往血栓病史,不排除该患者具有易栓症的倾向。此类患者血栓类型常表现为静脉血栓,妊娠期凝血因子的改变导致血液黏稠度增加、血液处于高凝状态,使胎盘出现浅着床、血管内形成微血栓等现象,使胎盘灌注量大大降低,减少胚胎血液供应量,进而影响胚胎发育[22]。此类患者应做全套的易栓症检查,明确诊断,及时治疗,以期改善妊娠结局,防止血栓发生。⑧低分子肝素能够降低妊娠血栓发生风险。本例患者既往有脑血栓病史,且患有糖尿病、高血压等基础病,一直采用低分子肝素预防血栓至剖宫产前1 d,取得不错效果。又因患者不宜多胎妊娠,故行双胎减胎术。低分子肝素不能穿过胎盘,必要时可在整个妊娠期应用[15]。
总之,OHSS并发血栓是一种极其凶险的医源性疾病,可危及患者生命,也给临床工作者带来严重的困扰。识别OHSS并发血栓的危险因素、治疗基础病变,做好血栓预防非常必要。选择适当的促排卵方案和合理的Gn用量以及扳机种类和剂量,有助于减少重度OHSS的发生,降低血栓风险。一旦血栓发生,及时诊断,多学科联合治疗,对于挽救患者生命健康和预后十分关键。
所有作者均声明不存在利益冲突



























