
分析老年发病类风湿关节炎(EORA)与青壮年发病类风湿关节炎(YORA)在临床表现、实验室检查以及治疗方面的差别。
收集2013年1月至2018年12月于北京大学第三医院风湿免疫科住院的类风湿关节炎(RA)患者的临床资料、实验室检查及治疗情况,分析EORA组与YORA组临床特点的差异,以更好地指导EORA患者的临床诊治。正态分布定量资料组间比较采用t检验。
共纳入481例RA患者,其中EORA组137例(28.5%),YORA组344例(71.5%)。患者年龄19~87(59±14)岁,男123例(25.6%),女358例(74.4%)。EORA组男性占比更高(36.5%比21.2%,χ2=12.012,P<0.01),病程更短(Z=-7.985,P<0.01)。EORA组28个关节疾病活动度评分(DAS28)更高(5.6±1.3比5.2±1.6,t=2.549,P<0.05),合并胸腔积液者及合并间质性肺疾病(ILD)者更多(χ2=7.550、7.797,均P<0.05)。EORA组合并静脉血栓、高血压、糖尿病、脑血管病、冠心病(CHD)、外周动脉粥样硬化、白内障的比率均高于YORA组(均P<0.05)。EORA组红细胞沉降率(ESR)、D-Dimer亦水平更高(均P<0.05)。EORA组应用糖皮质激素比率更高,应用甲氨蝶呤以及肿瘤坏死因子(TNF)-α抑制剂的比率均更低(χ2=5.271、8.407、9.356,均P<0.05)。
EORA组与YORA组相比,男性占比更高,病情活动度更高,更易合并胸腔积液、ILD、静脉血栓、高血压病、糖尿病、脑血管病、CHD、外周动脉粥样硬化及白内障。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2000年,我国65岁及以上人口比例达到7.0%,老年型年龄结构初步形成,开始步入老龄化社会。2018年,我国65岁及以上人口比例达到11.9%,人口老龄化程度持续加深[1]。类风湿关节炎(rheumatoid arthritis,RA)根据起病年龄分为老年发病,即≥60岁发病的RA(EORA)和青壮年发病的RA(YORA)。EORA与YORA在流行病学特点、临床表现及治疗方面有诸多不同。EORA的患病率约为2%,占到全部RA的10%~33%,男女比例为1∶(1.5~2.0),而YORA的男女比例为1∶(4.0~4.5)[2]。国内关于EORA临床特点的研究少见。本研究拟探讨大样本资料中EORA与YORA相比在人口学资料、临床特点以及实验室检查方面的异同,以更好地指导EORA的诊治。
选取自2013年1月至2018年12月于北京大学第三医院风湿免疫科病房住院的RA患者,入选标准:(1)发病年龄>16岁;(2)符合1987年美国风湿病学会(ACR)[3]或2010年ACR/欧洲抗风湿病联盟(EULAR)RA分类标准[4]。(3)临床资料完整。排除标准:临床资料不完整者。本研究为回顾性队列研究,已经过北京大学第三医院伦理委员会审批(M2019196),知情同意豁免。
收集患者发病年龄,发病年龄≥60岁为EORA组,16岁<发病年龄<60岁为YORA组。收集患者一般情况,包括年龄、性别、病程等。收集患者关节病变情况,包括关节肿胀压痛情况(各个关节肿胀压痛比率、关节压痛数及肿胀数),28个关节疾病活动度评分(DAS28),疼痛视觉模拟评分(VAS)。收集患者关节外表现以及合并症情况,包括胸腔积液、间质性肺疾病(ILD)、类风湿血管炎、类风湿结节、周围神经病、心包炎、贫血、静脉血栓、继发性干燥综合征(sSS)、高血压、糖尿病、高脂血症、脑血管病、冠心病(CHD)、外周动脉粥样硬化、骨量减少/骨质疏松、白内障、恶性肿瘤史、消化性溃疡史。全部患者收集血常规,凝血指标[包括凝血酶原时间(PT)、部分活化凝血活酶时间(APTT)、纤维蛋白原(Fib)、D-二聚体及纤维蛋白降解产物(FDP)],类风湿因子(RF),抗环瓜氨酸多肽(CCP)抗体,抗核抗体(ANA),抗角蛋白抗体(AKA),红细胞沉降率(ESR),C反应蛋白(CRP)。收集患者入院前3个月维持治疗慢作用抗风湿药(DMARDs)方案以及入院后治疗方案。比较2组间上述指标的差异,分析两组间临床特点、实验室检查以及治疗方面的差别,以指导临床诊疗。
应用SPSS 22.0软件进行统计分析。符合正态分布的定量资料以 ±s表示,2组间均数的比较采用t检验。非正态分布的定量资料使用M(Q1,Q3)描述,组间比较采用Wilcoxon秩和检验。2组间率的比较采用χ2检验。检验水准值取双侧α=0.05。
±s表示,2组间均数的比较采用t检验。非正态分布的定量资料使用M(Q1,Q3)描述,组间比较采用Wilcoxon秩和检验。2组间率的比较采用χ2检验。检验水准值取双侧α=0.05。
本研究共纳入病例481例,年龄19~87(59±14)岁,其中男123例(25.6%),年龄20~86(62±15)岁,女358例(74.4%),年龄19~87(58±13)岁。EORA组137例(28.5%),YORA组344例(71.5%)。EORA组男性50例(36.5%),YORA组男性73例(21.2%),两组差异有统计学意义(χ2=12.012,P<0.01)。EORA组病程明显短于YORA组,差异有统计学意义(Z=-7.985,P<0.01)(表1)。
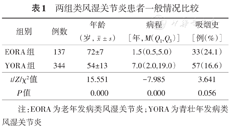
两组类风湿关节炎患者一般情况比较
两组类风湿关节炎患者一般情况比较
| 组别 | 例数 | 年龄(岁, ± s) ± s) | 病程[年,M(Q1,Q3)] | 吸烟史[例(%)] |
|---|---|---|---|---|
| EORA组 | 137 | 72±7 | 1.5(0.5,5.0) | 33(24.1) |
| YORA组 | 344 | 54±13 | 7.0(2.0,19.0) | 57(16.6) |
| t/Z/χ2值 | 15.551 | -7.985 | 3.641 | |
| P值 | 0.000 | 0.000 | 0.056 |
注:EORA为老年发病类风湿关节炎;YORA为青壮年发病类风湿关节炎
EORA组DAS28评分为(5.6±1.3)分,YORA组为(5.2±1.6)分,差异有统计学意义(t=2.549,P<0.05)。关节畸形、关节受累对称性、关节受累数、VAS、全身各个关节的受累情况两组差异均无统计学意义(均P>0.05,表2)。
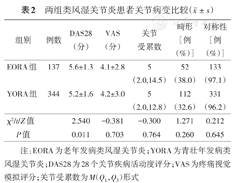
两组类风湿关节炎患者关节病变比较( ±s)
±s)
两组类风湿关节炎患者关节病变比较( ±s)
±s)
| 组别 | 例数 | DAS28(分) | VAS(分) | 关节受累数 | 畸形[例(%)] | 对称性[例(%)] |
|---|---|---|---|---|---|---|
| EORA组 | 137 | 5.6±1.3 | 4.1±2.8 | 5(2.0,14.5) | 52(38.0) | 133(97.1) |
| YORA组 | 344 | 5.2±1.6 | 4.2±3.0 | 5(2.0,12.8) | 112(32.6) | 331(96.2) |
| χ2/t/Z值 | 2.540 | -0.381 | -0.300 | 1.271 | 0.212 | |
| P值 | 0.011 | 0.703 | 0.764 | 0.260 | 0.645 |
注:EORA为老年发病类风湿关节炎;YORA为青壮年发病类风湿关节炎;DAS28为28个关节疾病活动度评分;VAS为疼痛视觉模拟评分;关节受累数为M(Q1,Q3)形式
EORA组合并胸腔积液者9例(6.6%),YORA组6例(1.7%),差异有统计学意义(χ2=7.550,P<0.01)。EORA组合并ILD者41例(29.9%),显著高于YORA组的18.3%(63例),差异有统计学意义(χ2=7.797,P<0.01)。两组间合并心包炎、类风湿结节、类风湿血管炎、周围神经病、贫血的比率差异均无统计学意义(均P>0.05,表3)。
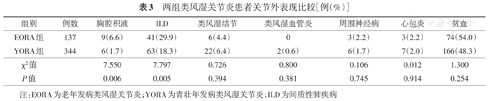
两组类风湿关节炎患者关节外表现比较[例(%)]
两组类风湿关节炎患者关节外表现比较[例(%)]
| 组别 | 例数 | 胸腔积液 | ILD | 类风湿结节 | 类风湿血管炎 | 周围神经病 | 心包炎 | 贫血 |
|---|---|---|---|---|---|---|---|---|
| EORA组 | 137 | 9(6.6) | 41(29.9) | 6(4.4) | 0 | 3(2.2) | 3(2.2) | 74(54.0) |
| YORA组 | 344 | 6(1.7) | 63(18.3) | 22(6.4) | 2(0.6) | 6(1.7) | 7(2.0) | 166(48.3) |
| χ2值 | 7.550 | 7.797 | 0.726 | 0.800 | 0.106 | 0.012 | 1.300 | |
| P值 | 0.006 | 0.005 | 0.394 | 0.381 | 0.745 | 0.914 | 0.254 |
注:EORA为老年发病类风湿关节炎;YORA为青壮年发病类风湿关节炎;ILD为间质性肺疾病
EORA组合并静脉血栓者11例(8.0%),YORA组8例(2.3%),差异有统计学意义(χ2=8.401,P<0.01)。合并高血压病、糖尿病者EORA组分别为64例(46.7%)、36例(26.3%),YORA组分别为105例(30.5%)、52例(15.1%),差异均有统计学意义(χ2=11.272、8.165,均P<0.01)。合并脑血管病、CHD、外周动脉粥样硬化者EORA组分别为18例(13.1%)、23例(16.8%)、18例(13.1%),YORA组则分别为20例(5.8%)、13例(3.8%)、22例(6.4%),差异均具有统计学意义(χ2=7.225、23.948、5.844,均P<0.05)。合并白内障者EORA组14例(10.2%),YORA组10例(2.9%),两组差异有统计学意义(χ2=11.050,P<0.01)。合并恶性肿瘤史者EORA组8例(5.8%),YORA组6例(1.7%),两组差异有统计学意义(χ2=4.456,P<0.05)。两组合并sSS、高脂血症、骨量减少/骨质疏松、消化性溃疡史的比率差异均无统计学意义(均P>0.05)。
EORA组白细胞计数为(7.4±2.7)×109/L,高于YORA组的(6.7±2.6)×109/L(t=2.373,P<0.05)。EORA组ESR为(54±32)mm/h,YORA组为(46±30)mm/h,差异有统计学意义(t=2.749,P<0.05)。两组间CRP、ANA、RF、抗CCP抗体,AKA阳性率差异均无统计学意义(均P>0.05)。EORA组APTT为(31±6)s,YORA组为(32±4)s,两组差异有统计学意义(t=-2.532,P<0.05)。EORA组D-Dimer显著高于YORA组(Z=-2.691,P<0.01)。两组间PT、Fib、FDP差异均无统计学意义(均P>0.05,表4)。
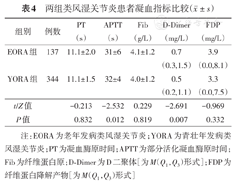
两组类风湿关节炎患者凝血指标比较( ±s)
±s)
两组类风湿关节炎患者凝血指标比较( ±s)
±s)
| 组别 | 例数 | PT(s) | APTT(s) | Fib(g/L) | D-Dimer(mg/L) | FDP(mg/L) |
|---|---|---|---|---|---|---|
| EORA组 | 137 | 11.1±2.0 | 31±6 | 4.1±1.2 | 0.7(0.3,1.5) | 3.9(0.0,8.1) |
| YORA组 | 344 | 11.1±1.5 | 32±4 | 4.0±1.2 | 0.5(0.2,1.1) | 3.3(0.0,7.5) |
| t/Z值 | -0.213 | -2.532 | 0.229 | -2.691 | -0.969 | |
| P值 | 0.832 | 0.012 | 0.819 | 0.007 | 0.332 |
注:EORA为老年发病类风湿关节炎;YORA为青壮年发病类风湿关节炎;PT为凝血酶原时间;APTT为部分活化凝血酶原时间;Fib为纤维蛋白原;D-Dimer为D二聚体[为M(Q1,Q3)形式];FDP为纤维蛋白降解产物[为M(Q1,Q3)形式]
EORA组住院期间应用糖皮质激素者76例(55.5%),YORA组151例(43.9%),差异有统计学意义(χ2=5.271,P<0.05)。两组间应用非甾体抗炎药(NSAIDs)的比例相当。EORA组入院前应用甲氨蝶呤维持治疗者10例(7.3%),显著低于YORA组的16.0%(55例)(χ2=6.329,P<0.05)。EORA组入院后应用甲氨蝶呤者39例(28.5%),仍显著低于YORA组的42.7%(147例)(χ2=8.407,P<0.01)。两组入院前应用肿瘤坏死因子α(TNF-α)抑制剂维持治疗的比例差异无统计学意义(P>0.05),入院后应用TNF-α抑制剂者EORA组4例(2.9%),显著低于YORA组的11.9%(41例)(χ2=9.356,P<0.01)。其余传统DMARDs药物包括来氟米特、艾拉莫德、雷公藤、柳氮磺吡啶、羟氯喹在入院前维持治疗以及入院后用药方案中两组间差异均无统计学意义(表5)。
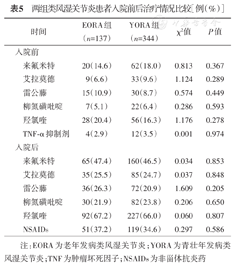
两组类风湿关节炎患者入院前后治疗情况比较[例(%)]
两组类风湿关节炎患者入院前后治疗情况比较[例(%)]
| 时间 | EORA组(n=137) | YORA组(n=344) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 入院前 | |||||
| 来氟米特 | 20(14.6) | 62(18.0) | 0.813 | 0.367 | |
| 艾拉莫德 | 9(6.6) | 33(9.6) | 1.124 | 0.289 | |
| 雷公藤 | 15(10.9) | 30(8.7) | 0.574 | 0.449 | |
| 柳氮磺吡啶 | 7(5.1) | 22(6.4) | 0.286 | 0.593 | |
| 羟氯喹 | 28(20.4) | 56(16.3) | 1.176 | 0.278 | |
| TNF-α抑制剂 | 4(2.9) | 12(3.5) | 0.001 | 0.974 | |
| 入院后 | |||||
| 来氟米特 | 65(47.4) | 160(46.5) | 0.034 | 0.853 | |
| 艾拉莫德 | 35(25.5) | 85(24.7) | 0.037 | 0.848 | |
| 雷公藤 | 36(26.3) | 72(20.9) | 1.609 | 0.205 | |
| 柳氮磺吡啶 | 30(21.9) | 82(23.8) | 0.206 | 0.650 | |
| 羟氯喹 | 92(67.2) | 227(66.0) | 0.060 | 0.807 | |
| NSAIDs | 51(37.2) | 119(34.6) | 0.297 | 0.586 | |
注:EORA为老年发病类风湿关节炎;YORA为青壮年发病类风湿关节炎;TNF为肿瘤坏死因子;NSAIDs为非甾体抗炎药
一项纳入1 206例RA患者的研究显示,EORA占14.8%,发病年龄为(66.7±5.6)岁,男性占23%,吸烟者占20.8%,与YORA组差异均有统计学意义[5]。本研究中EORA病例占到全部RA的28.5%,男女比例为1∶1.7,YORA组男女比例为1∶3.7,与既往研究结果基本一致。EORA与YORA患者的遗传背景有所不同,研究显示EORA与HLA-DRB1*01有关,而YORA与HLA-DRB1*04有关[6]。在上述大规模研究中,EORA组病程更短[5]。本研究中EORA组病程显著短于YORA组。YORA起病年龄在16~60岁,长病程的患者比例更高,故其平均病程长于EORA组。
Shiozawa等[7]的研究发现,与YORA组相比,EORA组总体关节受累率、大关节受累率及关节侵蚀比率无差别,但小关节及膝关节受累率更低。一项纳入2 182例患者的研究发现,EORA组S-DAI、C-DAI、DAS28-ESR、HAQ、关节肿胀数、关节压痛数、骨侵蚀均明显升高[8]。而Spinel-Bejarano等[9]则发现EORA组关节肿胀数及压痛数均少于YORA组。本研究中EORA组DSA28高于YORA组,但关节受累数目、关节受累的对称性、关节畸形率无差别。提示EORA组病情活动度更高,但并未发现某个特定关节的受累率有差别。既往研究结果的不一致性可能与纳入患者的标准不同、样本量不同、样本的背景资料不同均有关系。
Spinel-Bejarano等[9]研究认为EORA组与YORA组相比关节外表现的总体发生率无差别。Tan等[5]发现EORA组合并高血压病、糖尿病、缺血性心脏病、消化性溃疡、骨质疏松、骨折、白内障的比率显著升高。有研究发现EORA患者的疲劳程度较高,以躯体疲劳为主,同时存在失眠、抑郁、焦虑等脑力疲劳因素[10]。本研究提示EORA患者出现合并症的比率显著升高,尤其是心脑血管疾病及其危险因素。同时发现EORA者合并恶性肿瘤史的比率亦升高。本研究中两组间合并骨量减少/骨质疏松的比率未见差异,可能与纳入患者均为住院患者,YORA患者多数病程较长,更易合并骨质疏松有关。本研究提示EORA的患者需注意筛查有无合并胸腔积液及ILD,另外需特别警惕合并静脉血栓、心脑血管疾病的风险。本研究还对两组间凝血指标的差异进行了评估,发现EORA组D-Dimer水平更高,而APTT则更低,提示EORA组存在高凝状态风险。本课题组前期的研究提示RA患者血D-Dimer水平较其他风湿病患者明显升高,且与RA病情活动度具有明显正相关关系[11]。EORA组患者具有更高的病情活动度,其血D-Dimer水平更高考虑与此因素有关。凝血指标的上述异常也提示静脉血栓的风险,因此对于EORA患者关注是否存在静脉血栓至关重要。多项研究显示EORA组ESR明显快于YORA组[5,7,8],但也有研究发现两组ESR无差别[11]。本研究中EORA组ESR明显快于YORA组,与多数研究结果一致。
EORA的治疗目标与YORA一致,均强调达标治疗。但是目前针对RA的药物临床试验中大部分未纳入65岁以上的老年人,因此在临床实践中经验性治疗更为常见。一项Meta分析指出小剂量糖皮质激素对于减少压痛关节数优于NSAIDs[12]。糖皮质激素持续应用6个月以上糖尿病风险增加2~3倍[13]。泼尼松剂量>7.5 mg/d会增加心肌梗死及心力衰竭的风险[14]。同时泼尼松增加老年人精神异常、青光眼、白内障的风险[2]。有研究显示老年RA患者应用甲氨蝶呤联合依那西普有明显获益[15,16]。有研究显示,与YORA相比,EORA对TNF-α抑制剂的应答率类似或轻微低[17],而托珠单抗治疗EORA患者与YORA组无差别[18]。有研究提示托法替布治疗EORA与YORA的ACR应答率相当[19]。本研究中EORA组应用糖皮质激素的比例更高,应用甲氨蝶呤的比率更低,入院后EORA组启用TNF-α抑制剂的比率更低。考虑上述用药差别可能与EORA患者平均年龄大、合并症多、对DMARDs药物耐受性欠佳有一定关系。TNF-α抑制剂的应用差别可能同时与药物经济负担较重有一定关系。对于EORA者,激素应用的副作用仍需高度警惕,而生物制剂总体的有效率与YORA组接近或略低,不良反应大致相当,对于传统DMARDs充分治疗不能达到病情缓解或低疾病活动度的EORA患者,可酌情考虑生物DMARDs的应用。
综上所述,EORA与YORA相比,男性比例更高,平均病程更短,病情活动度更高,更容易合并胸腔积液、ILD、静脉血栓、高血压、糖尿病、脑血管病、CHD、外周动脉粥样硬化、白内障。EORA组中使用糖皮质激素的比例更高,而使用甲氨蝶呤以及TNF-α抑制剂的比例则较低。提示在EORA的诊治过程中,需特别注意患者的关节外表现以及合并症,并且需仔细评估患者的治疗方案选择,警惕激素的副作用。
所有作者均声明不存在利益冲突



























