
探讨体外受精-胚胎移植(IVF-ET)后剖宫产瘢痕妊娠(CSP)的发病率、临床特点、诊疗策略及再妊娠结局。
回顾性分析北京大学第三医院妇产科生殖医学中心2010年4月1日至2020年3月31日实施IVF-ET后发生CSP患者的临床资料。
继发不孕合并瘢痕子宫(子宫下段剖宫产术史)、经IVF-ET助孕后获得临床妊娠的患者共1 441例,其中CSP患者占比1.94%(28/1 441)。CSP患者年龄(34±3)岁,有人工流产史患者占50.0%(14/28)。卵裂胚移植、囊胚移植后CSP发病率分别为1.74%、2.20%,差异无统计学意义(χ2=0.408,P=0.523)。新鲜周期移植、解冻周期移植后CSP发病率分别为1.77%、2.23%,差异亦无统计学意义(χ2=0.372,P=0.542)。CSP诊断时平均孕龄为(47±6)d。根据早孕期影像学检查分型,1例CSP-Ⅰ型患者采取期待治疗,妊娠至晚孕期活产;2例宫内妊娠合并CSP患者采取经阴道选择性减胎术,宫内妊娠至晚孕期活产;1例CSP-Ⅲ型患者行腹腔镜妊娠组织清除+子宫修补术,24例CSP-Ⅰ型或Ⅱ型患者行宫腔镜妊娠组织清除术±子宫动脉栓塞术;5例患者在CSP治疗后经再次胚胎移植助孕并获临床妊娠,均为正常宫内妊娠并足月活产。
剖宫产术后再妊娠经IVF-ET助孕者,早孕期应行彩色超声检查明确有无CSP发生。CSP治疗应个体化实施,严格选择的CSP-Ⅰ型患者有期待治疗机会。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自2016年我国实施"全面二孩"政策后,大量已生育女性选择备孕二胎,这其中不乏前次妊娠经剖宫产术助娩的瘢痕子宫患者。这部分人群夫妻双方年龄相对偏大,生育力减退,部分患者因继发不孕,需辅助生育技术助孕,如体外受精-胚胎移植(IVF-ET)等。剖宫产瘢痕妊娠(CSP)是剖宫产术后再妊娠时的严重并发症之一[1]。既往由于IVF-ET后CSP的发病例数较少,相关研究多为个案报道,缺乏疾病发病率、临床特点、早期诊断、个体化诊治及再妊娠结局的病例系列总结。本研究对IVF-ET治疗后发生CSP患者的病例资料进行回顾性分析,以期为临床管理提供有益借鉴。
回顾性分析北京大学第三医院妇产科生殖医学中心2010年4月1日至2020年3月31日继发不孕合并瘢痕子宫(子宫下段剖宫产术史)、通过IVF-ET助孕后再妊娠人群队列中发生CSP的患者。控制性超促排卵(COH)方案、体外受精方式及胚胎的培养、移植、冻融等临床与实验室策略遵循本中心诊疗常规[2]。患者通常于胚胎移植后12~16 d及20~22 d两次采集静脉血行β-人绒毛膜促性腺激素(hCG)定量检测。对于确认生化妊娠的患者,通常于胚胎移植后28~30 d行彩色多普勒经阴道超声(TVUS)检查以确认妊娠部位,但若患者出现阴道出血、腹痛或血β-hCG值提示异位妊娠可能,则在必要时安排TVUS检查。本研究为回顾性病例分析,在实施过程中严格遵守《赫尔辛基宣言》,通过北京大学第三医院生殖医学伦理委员会审批(2019SZ-069),并豁免知情同意。
CSP的超声诊断标准[3]:(1)孕12周以内;(2)宫颈管空虚;(3)妊娠囊附着部位于子宫前壁峡部(相当于前次妊娠子宫下段剖宫产切口部位),彩色多普勒血流显像(CDFI)见妊娠囊附着部位血流丰富;(4)妊娠囊与膀胱间子宫肌层连续性受损。参照2016年中国《剖宫产术后子宫瘢痕妊娠诊治专家共识》提出的分型标准[4],将CSP分为Ⅰ、Ⅱ、Ⅲ型。若在符合剖宫产瘢痕妊娠诊断标准同时,另见正常宫腔内妊娠囊(于非剖宫产瘢痕处附着),则诊断为宫内妊娠合并剖宫产瘢痕妊娠(HCSP)。
查阅病历系统及辅助生殖数据库,检索以下资料:(1)患者一般临床资料:年龄、孕产次、剖宫产信息、人工流产次数、再妊娠胚胎着床距末次剖宫产时间间隔、CSP诊断时孕龄等。孕龄定义为诊断时距离患者胚胎移植日天数+移植胚胎体外培养天数+14。(2)IVF-ET助孕资料:移植周期(新鲜/解冻)、移植胚胎数、胚胎类型(第3日卵裂胚或第5/6日囊胚)、移植后第1次(移植后D1天)及第2次(移植后D2天)血β-hCG定量检测等信息;计算hCG的48 h增长度。(3)CSP治疗方式:期待治疗、保守治疗、手术治疗(术式、手术时长、出血量、术后随访资料);(4)HCSP宫内妊娠结局及CSP再妊娠结局。
采用SPSS 22.0软件对数据进行统计学分析,符合正态分布的计量资料采用 ±s表示,非正态分布的计量资料采用M(Q1,Q3)表示;分类资料采用频数及率进行描述,组间比较根据样本量及最小理论频数,选择皮尔逊χ2检验、连续校正χ2检验或Fisher精确检验。双侧检验,检验水准α=0.05。
±s表示,非正态分布的计量资料采用M(Q1,Q3)表示;分类资料采用频数及率进行描述,组间比较根据样本量及最小理论频数,选择皮尔逊χ2检验、连续校正χ2检验或Fisher精确检验。双侧检验,检验水准α=0.05。
共有CSP患者28例,其中HCSP患者2例。同时期本中心IVF-ET后临床妊娠周期中,合并瘢痕子宫患者共1 441例。继发不孕合并瘢痕子宫、通过IVF-ET助孕并获临床妊娠的人群中,CSP累计发病率为1.94%(28/1 441),HCSP累计发病率为0.14%(2/1 441)。
CSP患者平均年龄为(34±3)岁,中位妊娠次数为3(2,8)次,中位分娩次数为1(0,1)次,14例(50.0%)患者既往有宫腔手术史(人工流产术或稽留流产清宫术)。所有患者既往剖宫产次均为1次,剖宫产指征分别为:孕妇要求10例(35.7%),初产臀位4例(14.3%),产程停滞2例(7.1%),引产失败2例(7.1%),前置胎盘2例(7.1%),胎儿窘迫2例(7.1%),巨大儿1例(3.6%),其他产科指征5例(17.9%)。CSP诊断时距离既往剖宫产术的中位时间为7(2,17)年,CSP诊断时平均胚胎移植后时间为(29±6)d,平均孕龄为(47±6)d。无症状患者占10.7%(3/28),阴道出血患者占89.3%(25/28),腹痛患者占14.3%(4/28),阴道出血同时伴腹痛患者占14.3%(4/28)。Ⅰ型、Ⅱ型、Ⅲ型CSP分别为16例(57.1%)、11例(39.3%)、1例(3.6%)。
CSP患者平均移植胚胎数为(1.4±0.6)枚。其中,卵裂胚移植14例,占瘢痕子宫患者卵裂胚移植后临床妊娠周期1.74%(14/806);囊胚移植14例,占瘢痕子宫患者囊胚移植后临床妊娠周期2.20%(14/635),以上两组CSP发病率差异无统计学意义(χ2=0.408,P=0.523)。新鲜周期移植16例,占瘢痕子宫患者新鲜周期移植后临床妊娠周期1.77%(16/903);解冻周期移植12例,占瘢痕子宫患者解冻周期移植后临床妊娠周期2.23%(12/538),以上两组CSP发病率差异无统计学意义(χ2=0.372,P=0.542)。患者移植后血hCG的48 h平均增长度为2.1±0.4,其中17例(60.7%)患者48 h增长度>2.0。
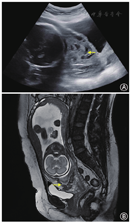
(1)1例CSP-Ⅰ型患者,既往有反复着床失败病史,卵巢功能减退,超声评估子宫下段剖宫产切口部位残余肌层厚度5 mm,患者及家属有强烈继续妊娠意愿,经全科病例讨论及充分医患沟通,采取期待治疗。产检筛查超声反复提示凶险性前置胎盘伴胎盘植入,孕31+周因羊水过少行剖宫产+手取胎盘+子宫下段宫颈提拉式缝合+双侧子宫动脉下行支结扎+子宫B-lynch缝合术,术中出血2 100 ml,新生儿出生体重1 430 g,1分钟Apgar评分9分,5分钟Apgar评分10分,经新生儿重症监护室(NICU)治疗后出院,现体健。(2)2例HCSP患者均为CSP-Ⅱ型,接受经阴道剖宫产瘢痕部位妊娠囊穿刺抽吸减胎术,术中于妊娠囊局部注射高渗葡萄糖溶液进一步减灭妊娠组织。其中1例患者孕中晚期产科超声及磁共振成像(MRI)反复提示妊娠组织完全性前置伴植入(图1),于孕29+周因产前出血行剖宫产+手取妊娠组织+子宫下段间断8字缝合+双侧子宫动脉下行支结扎+子宫B-lynch缝合术,术中出血3 200 ml,术后病理示前置伴植入的妊娠组织为梗死退变的胎盘组织。新生儿出生体重1 450 g,1分钟Apgar评分7分,5分钟Apgar评分9分,经NICU治疗后出院,现体健。另1例患者未于本院建档产检,经随访获知患者于孕35+周因"前置胎盘伴产前出血"行剖宫产术,新生儿出生体重3 000 g,现体健。(3)1例CSP-Ⅲ型患者行腹腔镜盆腹腔粘连松解+子宫瘢痕妊娠组织清除+子宫修补术,术后15个月时第1次胚胎移植(解冻周期单囊胚移植),早孕期超声提示正常宫内妊娠,孕期平顺,孕37+周经剖宫产术分娩,新生儿出生体重3 450 g,现体健。(4)24例CSP-Ⅰ型或Ⅱ型患者行宫腔镜子宫瘢痕妊娠组织清除术±子宫动脉栓塞术。其中22例(91.7%)患者首次宫腔镜手术治疗成功,术后1~2个月血β-hCG降至<5 mU/ml;其余2例(8.3%)患者因持续性CSP再次行宫腔镜子宫瘢痕妊娠组织清除术。4例患者术后10~18个月历经1~2次移植周期获得临床妊娠,均妊娠至足月经剖宫产术分娩,无再发性CSP(RCSP)、胎盘植入、子宫破裂、产后出血、新生儿窒息等严重并发症。6例患者术后10~48个月历经1~3次移植周期未获临床妊娠,无再妊娠意愿。其余14例患者目前仍处于辅助生殖助孕治疗周期中。

随着我国剖宫产率持续居高不下,剖宫产术对于术后再次妊娠的广泛影响越来越得到临床医师的重点关注[5,6]。CSP作为剖宫产术的远期并发症之一,由于发病率相对较低、患者随访难度大,既往未有研究报道CSP发病率[7]。基于辅助生殖技术治疗的患者具备良好的随访条件,本研究结果显示,在继发不孕合并瘢痕子宫(子宫下段剖宫产术史)、经IVF-ET助孕后获得临床妊娠的人群中,CSP的累计发病率为1.94%(28/1 441),提示在当前临床工作中对于剖宫产术后经IVF-ET助孕再妊娠者,早孕期应高度警惕CSP的发生。尚不明确IVF-ET助孕是否增加CSP发生风险。
既往病例对照研究报道CSP的发病危险因素包括年龄>35岁、剖宫产术后再妊娠间隔<2年、多次剖宫产、多次宫腔手术史(如人工流产)等[8,9]。本研究由于观察人群的特殊性,所有患者既往剖宫产次均为1次,妊娠间隔均为2年以上,但高龄妊娠患者占53.6%,有宫腔手术史患者占50.0%,既往剖宫产指征占比最高者为社会因素(35.7%),即孕妇要求的剖宫产,提示应加大生育健康指导宣传力度,倡导适龄妊娠、减少计划外妊娠、避免非产科指征的剖宫产术,可能有助于减少CSP的发生。
对于辅助生殖技术治疗的患者,通过临床表现及早期生化指标预测患者妊娠结局,有助于减轻患者心理负担,并合理安排医疗资源[10],但异位妊娠常见的腹痛、阴道出血等临床表现对于CSP缺乏特异性[8]。血hCG 48 h是否"翻倍"增长是临床用于判断是否为正常宫内妊娠的常用指标之一[11],但本研究中60.7%的CSP患者血hCG 48 h增长度>2.0,表明该指标对于CSP的诊断特异性较差,并进一步提示早孕期影像学检查对于CSP诊断具有不可或缺的意义。
既往认为CSP治疗的主要目的是早诊断、早终止、早清除[4]。但对于接受IVF-ET治疗的不孕症患者,由于当前助孕成功率受限,每获妊娠都比较珍贵,若不加选择实施终止妊娠,难免受到医学伦理的质疑。随着医疗水平的不断提高,近年来多项研究对CSP的期待治疗进行了有益的尝试与总结[7,12,13,14,15],结合本研究中期待治疗病例的自然病程与妊娠结局,共同表明对于严格选择的病例,在充分权衡生育意愿与妊娠期严重并发症风险后,有在严密随访下进行期待治疗的机会。对于要求终止妊娠的患者,宫腔镜妊娠组织清除术±子宫动脉栓塞术是CSP-Ⅰ型或Ⅱ型患者治疗的可行选择[16],而腹腔镜妊娠组织清除+子宫修补术则适用于CSP-Ⅲ型患者[17]。研究报道CSP治疗后患者再次妊娠发生RCSP风险约为4.7%~40.0%[18],本研究仅5例患者在CSP治疗后经再次胚胎移植助孕并获临床妊娠,均为正常宫内妊娠,但尚不足以评估经IVF-ET助孕的RCSP发生风险。
HCSP则是CSP中更为少见的类型之一,本研究中HCSP累计发病率为0.14%(2/1 441),在CSP中占7.1%(2/28),低于Ouyang等[19]报道的50%(6/12),考虑与本中心平均移植胚胎数较低有关(1.43枚比2.08枚)。HCSP的治疗以减灭CSP并保留宫内妊娠为主要目的。由于甲胺蝶呤(MTX)对宫内妊娠有潜在致畸作用,减胎局部用药以氯化钾或高渗葡萄糖更为常用[20]。然而,尽管妊娠已被终止,但瘢痕部位的妊娠滋养组织难以实现完全减灭,如本研究中病例所示,残留妊娠组织继续侵袭并发植入,最终导致早产及产后出血。因此,HCSP经阴道选择性减胎术后仍需严密随访、准确评估、充分准备。本研究局限性在于样本量较小,今后需开展更大样本量的队列研究及随机对照研究,对相关发现做进一步验证。
所有作者均声明不存在利益冲突



























