
耐药性是癌症治疗中的主要挑战,已成为恶性肿瘤临床治疗的难点。YAP/TAZ作为Hippo信号通路下游效应因子,参与多种抗肿瘤治疗的耐药模式,可通过激活生长因子信号、抑制凋亡、调节DNA损伤反应,促进细胞周期、诱导干细胞样特性、诱导间充质转化,引起抗肿瘤治疗过程中的耐药作用。YAP信号的失控可能是对肿瘤细胞各种靶向、化学疗法及放疗产生内在和获得性耐药的主要机制。此外,YAP还可通过Hippo经典通路外的非转录激活作用与多种蛋白相互作用,诱导肿瘤耐药的发生。YAP蛋白表达状态可作为一项预测肿瘤放化疗敏感性、判断肿瘤预后的指标,其抑制剂与放化疗联合应用,是潜在的肿瘤耐药的治疗靶点。旨在简要概述导致治疗耐药的YAP依赖性机制,为解决肿瘤治疗耐药的潜在策略提供观点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
靶向和免疫疗法显著提高了晚期或转移性癌症患者的生存率。然而,原发性和获得性耐药限制了大多数抗癌治疗的效果。在上述耐药过程中,常伴随有基因表达谱的改变,在这种情况下,表征分子生物标志物可为耐药的早期识别提供有用的工具。研究结果表明,Yes相关蛋白(Yes-associated protein,YAP)在人体多种肿瘤中异常表达且与肿瘤的发生、发展、治疗和预后相关,YAP表达的失调是机体对肿瘤治疗产生抗性的重要机制。因此,深入了解YAP驱动癌症转化、转移和治疗抗性的机制可提供新的治疗靶点。(图1)
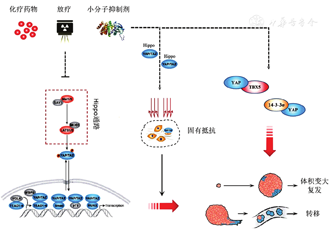

1988年,Moye-Rowley等克隆了酵母的AP-1基因(yAP1),后来证实,此基因与哺乳动物的YAP基因同源[1]。人YAP基因位于染色体11q22.1区,DNA全长127 896 bp,具有11个转录本,编码约504个氨基酸残基的蛋白[2,3]。YAP蛋白最初被鉴定为与Yes原癌基因产物的SH3结构域结合的蛋白质,其属于Src蛋白酪氨酸激酶家族。YAP蛋白的相对分子质量为65 ku,具有两种亚型(YAP1、YAP2),由TID结构域(转录激活因子结合结构域)、WW结构域(Tryptophan-Tryptophan结构域)、TAD结构域(转录激活结构域)构成,部分异构体含有SH3-BM(SH3结合结构域)和亮氨酸锌指结构。YAP1含有1个WW结构域,YAP2含有2个WW结构域,可与连续富含脯氨酸的基序(PPXY)相互作用,介导蛋白质复合物的形成。TID结构域主要用于募集转录激活因子,TAD结构域类似于单纯疱疹病毒I型激活域的病毒粒子蛋白16(VP16),是一种表征良好的转录共激活因子,可与各种转录因子相互作用并调节其转录活性。
YAP是Hippo信号通路中的关键下游调控靶标,既可充当转录共激活因子,也可充当共抑制因子,通过调控细胞增殖和凋亡,在器官大小控制和肿瘤进展中起关键作用。Hippo信号通路的名称来源于果蝇中发现的一组基因,在人类基因中,Hippo途径的核心激酶反应链主要包括激酶MST1/2、LATS1/2及接头蛋白SAV和MOB,调控转录共激活因子YAP和Tafazzin蛋白(TAZ)的磷酸化水平及核质定位。Hippo信号转导通路控制动物器官发育、生长和再生,其失调经常参与肿瘤发生[4,5,6]。当Hippo途径开启时,YAP和TAZ被LATS1/2磷酸化,促进其细胞质隔离和蛋白酶体介导的降解。当Hippo途径关闭时,YAP和TAZ被去磷酸化并转移到细胞核,从而能激活不同转录因子相关的靶基因,最终调节细胞生长、代谢、增殖、迁移、侵袭或死亡[7,8]。除经典Hippo通路外,YAP还受机械应力、氧化应激压力、蛋白间相互作用等调控[9]。
YAP/TAZ作为Hippo途径的效应分子,常常被当作一种蛋白质,参与多种抗肿瘤治疗的耐药模式[10,11,12,13,14],包括细胞毒性化疗药物治疗、分子靶向治疗、放疗及肿瘤细胞固有耐药等方面。
细胞毒性化疗药物通过干扰必要的细胞过程,如有丝分裂纺锤体的形成、DNA复制和DNA完整性,干扰细胞分裂和生存。YAP/TAZ的上调可抵抗多种细胞毒性药物,如抗小管蛋白、抗代谢物和DNA损伤药物。在乳腺癌细胞中,TAZ的过表达已被证明可诱导对紫杉醇和阿霉素的耐药性,YAP/TAZ靶基因CYR61和CTGF的上调似乎有助于耐药性的形成[15,16]。此外,在对5-氟尿嘧啶(5-FU)耐药的癌细胞系中,YAP的表达和活性增加,且YAP在耐药结肠癌和食道癌中的表达也上调[17,18]。Li等[19]的研究结果表明,YAP诱导性高表达与紫杉醇化学抗性的三阴性乳腺癌(triple-negative breast cancer,TNBC)患者的早期复发密切相关,YAP的敲低或与抑制剂Verteporfin的联合使用减少了紫杉醇抗性MDA-MB-231细胞系的迁移并增强了其凋亡和自噬;因此提出Verteporfin可作为以紫杉醇为基础治疗药物的TNBC患者的化学增敏剂。另外,在人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性的乳腺癌患者中,YAP/TAZ高表达与HER2单克隆抗体、曲妥珠单抗以及化疗联合治疗反应不良有关[20,21,22]。
放射治疗是癌症治疗的另一个重要轴心。电离辐射致癌细胞DNA双链断裂,诱导细胞周期退出和凋亡。研究结果表明,在多种癌症中,YAP除了介导化疗耐药性外,还介导放疗耐药性,激活YAP/TAZ可使癌细胞克服DNA损伤因子和放疗诱导的DNA损伤反应[10,23]。髓母细胞瘤中的YAP活化,可诱导对辐射的抵抗,而激活YAP的髓母细胞瘤细胞可绕过DNA损伤诱导的G1/S和G2/M细胞周期检查点,导致DNA持续断裂和基因组不稳定[24];而尿路上皮细胞癌中,YAP的下调可增强γ照射以及其他DNA损伤药物的损伤反应和细胞凋亡[24]。上述这种检查点旁路,被认为是由于YAP介导的IGF2-AKT通路的激活,该通路可失活DNA损伤反应转导子共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)和细胞周期检测点激酶2(checkpoint kinase 2,CHK2)。相反,YAP的抑制会导致顺铂治疗时DNA损伤反应增加,ATM活化增加,通过DNA损伤的积累导致尿路上皮癌细胞凋亡[25]。
激活YAP和TAZ可上调生长因子信号转导元件的编码基因,增强分子靶向药物抗肿瘤治疗的耐药。由YAP/TAZ驱动的耐药性可能涉及表皮生长因子受体(epidermal growth factor receptor,EGFR)信号转导的增强,以及下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和PI3K/AKT信号通路的激活,而EGFR和胰岛素样生长因子(insulin like growth factor,IGF)信号被证明可增强YAP/TAZ活性[26,27,28]。因此,YAP/TAZ和EGFR/IGF通路之间的正反馈回路可能进一步强化耐药性过程。YAP/TAZ活性可能通过上调抗凋亡基因的表达,来降低细胞对抗癌药物的敏感性。YAP可结合抗凋亡基因B细胞淋巴瘤2样1基因(B-cell lymphoma 2-like1,BCL2L1)和含杆状病毒IAP重复5(baculoviral IAP repeat-containing 5,BIRC5)的启动子,上调其表达水平。在B-RAF原癌基因丝氨酸/苏氨酸蛋白激酶(B-Raf proto oncogene serine/threonine protein kinase BRAF)和大鼠肉瘤(rat sarcoma, RAS)基因突变的癌细胞系中,BCL2L1的抗凋亡亚型BCL-XL的表达依赖于YAP的活性,BCL-XL是YAP的下游效应物,在对RAF/MEK(Mekinist)抑制剂产生耐药性的过程中发挥作用[29]。因此,YAP/TAZ活性可能通过上调抗凋亡基因的表达来降低细胞对抗癌药物的凋亡敏感性。在分子靶向治疗中,YAP活化可拯救KRAS依赖性结肠癌细胞免受shRNA介导、KRAS抑制诱导的活力丧失[29],提示YAP/TAZ激活可能诱导RAS信号通路特异性靶向抗癌药物的耐药性。Lin等[30]发现YAP可介导对RAF和MEK抑制剂治疗的耐药性,对YAP的抑制可显著提高RAF或MEK抑制剂的敏感性。
YAP/TAZ的生物学效应主要来源于其在调控细胞增殖、存活和干细胞的基因转录激活中的作用。然而,哺乳动物细胞中的YAP和TAZ除了与基因启动子相互作用外,还与许多转录增强相关结构域(transcriptional enhanced associate domain,TEAD)结合增强子和超增强子相互作用,从而导致一组决定细胞状态的基因具有高水平的转录活性[31]。因此,YAP和TAZ可能通过调控一个复杂的增强子和启动子序列来协调耐药基因的转录。YAP也被证明与致癌的p53突变体合作,可诱导细胞周期蛋白和周期蛋白依赖性激酶1(cyclin-dependent kinases 1,CDK1)的转录激活,促进细胞周期进展[32]。因此,YAP的激活可能通过干扰肿瘤抑制因子野生型p53或增强p53突变体的致癌活性而干扰抗癌治疗。
YAP/TAZ的激活也会诱导癌细胞的干细胞样特性。而肿瘤干细胞的干性与抗癌治疗的耐药性相关,如药物转运体表达的上调、DNA修复能力的提高以及更高的抗凋亡潜能[13,33]。分化差的乳腺癌呈现出较高水平的YAP/TAZ靶基因表达,乳腺癌中的TAZ活性通过提高干细胞标志物和肿瘤起始潜能,诱导对紫杉醇和多柔比星的抗性[34]。此外,有研究结果表明,蛋白酶激活的受体1(recombinant protease activated receptor 1,PAR1)信号通路通过Rho GTPase激活诱导YAP去磷酸化和核转位,从而促进干细胞样胃癌细胞的多药耐药[35]。这些结果支持了YAP/TAZ可能通过诱导癌细胞中的干细胞样特性而促进抗癌治疗耐药性的观点。
肿瘤细胞的上皮细胞间充质转变(epithelial to mesenchymal transition,EMT)过程不仅是肿瘤转移增加的基础,而且与肿瘤细胞的EMT对抗癌治疗的耐药性过程密切相关[36,37]。在乳腺上皮细胞中,YAP/TAZ激活诱导EMT表型,如细胞失去接触,纺锤形形态出现,间充质标志物(如纤维连接蛋白、波形蛋白和N-cadherin)上调[15,38]。在KRAS依赖性结肠癌细胞系和小鼠肺癌模型中,YAP通过其对EMT诱导的影响,挽救了KRAS抑制后肿瘤细胞活力的降低[29]。
YAP作为转录共激活因子,除与TAZ的协同促转录作用促进肿瘤耐药外,同时存在其他途径的调控及被调控机制参与治疗抵抗。Koinis等[39]的研究结果表明,引起前列腺癌MET抑制Cabozantinib抵抗的分子基础为成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)及FGF的过表达。FGFR1及FGF依赖于YAP/TBX5复合物的驱动,而该过程中YAP的活性调控及核质定位独立于Hippo通路之外[39]。在胰腺癌中,14-3-3σ过表达可促进YAP表达,磷酸化的YAP通过与14-3-3蛋白质结合形成磷酸肽复合物而被隔离在细胞质中,此处YAP不再具有促进靶基因表达的转录激活作用,二者相互结合、相互依赖,通过增强核糖核苷酸还原酶M1(ribonucleotide reductase M1, RRM1)和RRM2的表达,减弱吉西他滨诱导的Caspase-8激活和凋亡来增强获得性吉西他滨的耐药性[40]。
YAP/TAZ作为Hippo信号通路的下游效应因子,可通过激活生长因子信号、抑制凋亡、调节DNA损伤反应、促进细胞周期、诱导干细胞样特性、诱导间充质转化,引起抗肿瘤治疗过程中的耐药作用。此外,YAP还可通过Hippo经典通路外的非转录激活作用与多种蛋白相互作用,诱导肿瘤耐药的发生,如图1所示。YAP的表达状态可作为一项预测肿瘤放化疗敏感性、判断肿瘤预后的指标,是潜在的药物靶点。利用该靶点,并与放化疗及小分子抑制剂联合应用,有望成为解决肿瘤耐药的新途径。
所有作者均声明不存在利益冲突



























