
探讨脑电功率谱密度(power spectral density,PSD)及功能连接分析对不同程度新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)早期大脑皮层功能的评估作用。
选择2016年1月至2019年3月南通大学附属常州儿童医院新生儿科收治的轻、中度HIE患儿进行前瞻性研究,选择同期收治的无脑损伤足月儿为对照组。3组患儿生后72~96 h采集脑电图(electroencephalogram,EEG),分析4个频段(delta、theta、alpha、beta)各通道平均PSD谱密度及全脑PSD,于8个频段(delta、theta、alpha1、alpha2、beta1、beta2、beta3、beta4)使用孤立有效相关(the imaginary part of coherency,ICOH)进行功能连接分析,将PSD和ICOH值在3组间进行比较。
共纳入轻度HIE组20例、中度HIE组15例及对照组30例。PSD分析显示,中度HIE组theta、alpha、beta频段在FP1、FP2、C3、C4、Fz、Cz、Pz、F3、P4通道较轻度组和对照组显著降低(P<0.05),而delta频段在以上各通道未见类似改变(P>0.05);轻度HIE组仅在P4通道theta频段、Cz通道alpha频段低于对照组(P<0.05);中度HIE组全脑平均PSD在各频段均较对照组显著降低(P<0.05);轻度HIE组全脑平均PSD与对照组比较差异无统计学意义(P>0.05)。ICOH分析显示,中度HIE组脑功能连接低于对照组,主要集中在delta频段;与轻度HIE组比较,中度HIE组功能连接在delta、theta、alpha1及alpha2频段明显减低;而轻度HIE组与对照组比较,仅在delta、alpha1频段有较少的ICOH差异。
新生儿delta、theta、alpha频段PSD及ICOH可以定量分析HIE患儿脑功能状态,中度HIE患儿早期出现明显的皮层功能落后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是由于围产期窒息导致的脑损伤疾病,严重窒息缺氧导致弥漫性皮质坏死或者分水岭损伤,可出现脑性瘫痪、认知障碍和癫痫等远期不良预后[1, 2, 3, 4, 5]。尽管多种综合治疗包括亚低温治疗[6]已应用于HIE,但对患儿不良神经发育预后的改善仍不明显,需要寻找适用于危重患儿床旁操作、早期评估脑皮层功能的神经生物学标志物,以便实施个性化治疗策略及预后评价。
脑电图(electroencephalogram,EEG)可瞬时记录大脑皮层电生理变化,在临床得到广泛应用。EEG定量分析可量化皮质节律改变,挖掘脑区间的复杂相互作用,反映大脑成熟过程或脑损伤、功能障碍特征[7]。功率谱密度(power spectral density,PSD)是脑电信号定量分析的常用指标,可量化信号中能量或功率的频率分布。脑电连通性是反映不同大脑区域之间的功能连接状况的另一定量分析指标。Nolte在2004年提出的孤立有效相关(the imaginary part of coherency,ICOH)[8]消除了瞬时活动产生的所有不相干共源信号干扰,精确评估了大脑功能连接性。然而PSD及ICOH分析技术在新生儿中很少使用。本研究联合应用PSD及ICOH分析不同程度HIE患儿早期大脑皮层功能,寻求早期判断脑功能的神经生物学指标,以有效监测和评价治疗效果。
选择2016年1月至2019年3月南通大学附属常州儿童医院新生儿科收治的HIE患儿,HIE诊断参照中华医学会新生儿学组2005年制定的新生儿缺氧缺血性脑病诊断标准建议,并按照严重程度分为轻度HIE组和中度HIE组(重度HIE组由于样本量过少,未纳入本研究)。入组标准均经新生儿科专科医师诊断。排除中枢神经系统感染、颅脑先天畸形、遗传代谢性疾病、染色体异常等。选择同期入住的上呼吸道感染、腹泻、咽下综合征等无脑损伤患儿为对照组。
本研究为前瞻性研究,通过南通大学附属常州儿童医院伦理委员会审批(2015-007),已在中国临床试验中心进行注册(ChiCTRl900022084),所有患儿监护人均签署知情同意书。
1.数据采集:研究对象均在生后72~96 h使用NicoletOne脑电图机(Natus Nicolet)采集脑电。应用国际10-20电极标志系统定位的新生儿21导脑电图帽,保持电极阻抗低于10 KΩ,采样频率1 000 Hz。脑电采集时长1~2.5 h,采集脑电全程录像。
2.脑电数据处理:由专人负责数据处理,其对所有研究对象信息及分组情况不知情。脑电数据离线分析采用MATLAB R2013b数据处理分析软件及其脑电分析子软件EEGLAB工具包。(1)脑电PSD:对预处理后的脑电数据采用MATLAB R2013b的Pwelch函数计算频谱,窗函数设置为4 s,不重叠, NFFT=2 000,提取各通道功率谱,结果采用10*log10转换。分析的频率范围为0~30 Hz: delta (0~4 Hz),theta (4~8 Hz),alpha (8~12 Hz),beta (12~30 Hz),计算每个通道的PSD,取全脑平均PSD。(2)ICOH:使用hermes软件通过welch法计算交叉频谱,根据交叉频谱计算ICOH。分析8个频段:delta(0~4 Hz),theta(4~8 Hz),alpha1(8~10 Hz),alpha2(10~12 Hz),beta1(12~15 Hz),beta2(15~18 Hz),beta3(18~25 Hz)和beta4(25~30 Hz)。
应用SPSS 22.0统计软件进行数据分析。符合正态分布的计量资料以表示,采用单因素ANOVA检验对3组间PSD进行比较,并采用Bonferroni法校正多重比较,进行ICOH两两比较时先进行fisher-Z变换,将数据转为正态分布,采用t检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
研究期间共收治HIE患儿51例,符合入选标准42例,排除中枢神经系统感染1例、遗传代谢性疾病3例、染色体疾病1例、脑电数据质量不合格2例,共纳入轻度HIE组20例,中度HIE组15例。共纳入同期无脑损伤足月儿30例为对照组。3组性别、胎龄、出生体重、头围、身长等差异均无统计学意义(P>0.05)。见表1。
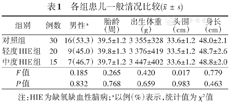
各组患儿一般情况比较()
各组患儿一般情况比较()
| 组别 | 例数 | 男性a | 胎龄 (周) | 出生体重 (g) | 头围 (cm) | 身长 (cm) |
|---|---|---|---|---|---|---|
| 对照组 | 30 | 16(53.3) | 39.5±1.2 | 3 355±328 | 33.6±1.2 | 48.0±2.1 |
| 轻度HIE组 | 20 | 9(45.0) | 39.8±1.3 | 3 376±419 | 33.5±1.2 | 48.7±2.6 |
| 中度HIE组 | 15 | 7(46.7) | 39.7±1.2 | 3 447±402 | 33.6±1.2 | 48.8±2.0 |
| F值 | 0.185 | 0.265 | 0.420 | 0.017 | 0.779 | |
| P值 | 0.832 | 0.768 | 0.659 | 0.983 | 0.463 |
注:HIE为缺氧缺血性脑病;a以例(%)表示,统计值为χ2值
3组患儿19个通道脑电PSD频谱图见图1。中度HIE组theta、alpha、beta频段在FP1、FP2、C3、C4、Fz、Cz、Pz、F3、P4通道较轻度组和对照组显著降低,差异有统计学意义(P<0.05),而delta频段在以上各通道未见类似改变(P>0.05);轻度HIE组PSD仅在P4通道theta频段、Cz通道alpha频段低于对照组,差异有统计学意义(P<0.05)。
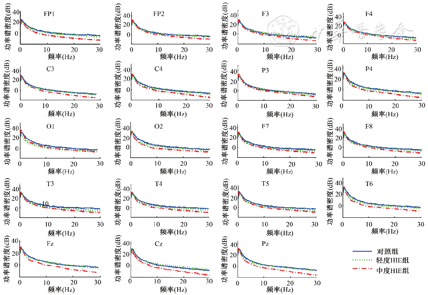

注:HIE为缺氧缺血性脑病
全脑平均PSD见图2。中度HIE组在delta、theta、alpha、beta各频段均较对照组显著降低,差异有统计学意义(P<0.05),轻度HIE组与对照组比较差异无统计学意义(P>0.05)。
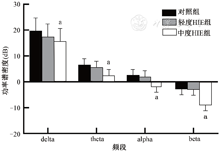

注:a与对照组比较,P<0.05
中度HIE组脑功能连接显著少于对照组,主要集中在delta频段,多为脑中央区与顶枕区间的连接(图3A);并且中度HIE组功能连接在delta、theta、alpha1及alpha2频段明显少于轻度HIE组(图3B);而轻度HIE组与对照组比较,仅在delta、alpha1频段有较少的ICOH差异(图3C)。
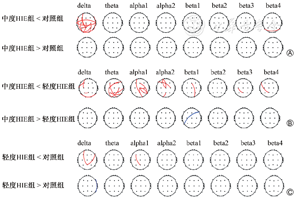

注:HIE为缺氧缺血性脑病,ICOH为孤立有效相关
HIE是足月新生儿死亡或神经发育障碍的主要原因之一。不同程度HIE预后不同,重度HIE病死率高,存活患儿可能有不同程度的神经发育异常;轻度HIE预后较好,几乎所有患儿运动结局良好[9];而中度HIE约三分之一在所有发育里程碑阶段均有延迟[10],但也有较多预后良好者,该人群预后较轻度及重度HIE难以预测,可靠的早期神经功能评估指标对于父母和医生做出合理的决策至关重要。
HIE病理改变大致有缺氧缺血性病变、脑水肿、脑梗死、脑细胞坏死等,其中以缺氧缺血性病变为主,主要累及大脑皮层神经元,EEG可以敏感捕捉HIE患儿脑部皮质功能改变,这是EEG可应用于HIE疾病研究的病理基础[11]。
脑电功率可对皮层脑电节律进行测量。生命早期,脑电节律随着快速发展的大脑活动而改变[12, 13, 14]。出生时的脑电功率与15个月时的语言和记忆相关[15]。功能连接可测量不同电极位置之间脑电图的相关性,描述不同脑区功能性连接的程度。越来越多证据表明,大脑疾病与大脑区域之间功能连接的改变有关,疾病时正常的脑网络组织和功能受到破坏[16, 17]。联合功率谱及功能连接研究意义更大。Sunwoo等[18]研究发现,快速眼动睡眠期行为障碍患者功率谱明显下降,功能连接显著增强,首次揭示患者运动皮层显著激活的电生理证据。本研究将PSD和功能连接分析结合起来,可使整个证据链更为完善,从而为HIE患儿脑功能状态研究提供全新视角。
本研究结果显示,中度HIE组在delta、theta、alpha频段功率及功能连接均有不同程度的损伤。研究表明delta能量在新生儿大脑皮层活动中占主导地位[19],因此可用该频段表征HIE患儿脑电活动。与对照组比较,中度HIE患儿全脑平均PSD在delta频段显著降低,脑功能连接ICOH集中在delta频段显著下降,可能为急性窒息缺氧累及大脑皮层所致,delta功率及连通性可能是HIE患儿大脑皮层功能或脑发育状态的生物标志物,与Kota等[20]研究结果一致。
婴儿期theta节律是主动学习记忆的指标[21]。研究表明,大脑皮层记录的theta功率与新信息编码之间的联系由皮层-海马反馈回路诱导皮层theta活性所致[22, 23],同时theta节律尚可能诱导突触可塑性[21]。足月HIE患儿大脑皮层和海马神经元最易受损,theta频段皮层与海马的交流受阻将影响婴儿记忆学习等认知功能[23]。故研究HIE患儿theta节律对了解神经发育状态具有很好的参考价值。
Anderson和Perone等[13]发现,婴儿期alpha主要皮质节律在6~9 Hz范围内,被称为婴儿alpha,分布于本研究的theta及alpha1节律中,中度HIE患儿alpha节律及连通性受损。急性窒息通常使丘脑最先受累,特别是丘脑腹外侧核,而丘脑皮质系统参与alpha节律的产生[24, 25],丘脑皮质系统受损导致alpha频率降低[26],脑区间的连通也受影响。同时,alpha节律源于胎儿期,出生后随脑发育继续完善,由于宫内窘迫、出生时窒息缺氧,alpha网络发育可能会受到不同程度破坏[27]。早期alpha被认为与婴儿认知功能相关[28, 29],且能预测儿童早期认知发展[13]。Kraybill等[30]发现,10月龄婴儿前额叶区alpha节律是4岁时和幼儿园后执行能力的一个独立预测因子。故中度HIE患儿由于alpha节律损伤可能出现认知损伤等表现,并可能遗留神经发育异常,alpha节律可作为HIE早期脑功能状态的生物标志物。
本研究提示新生儿delta、theta、alpha PSD及功能连接分析可以对HIE大脑皮层功能进行早期评估,相对于对照组及轻度HIE组,中度HIE组出现明显的皮层功能落后,可进一步研究以上脑电定量分析指标是否能作为新生儿HIE脑功能状态的神经生物标志物。本研究未纳入重度HIE患儿,且未分析后期追踪结果,今后将继续对这两个方向进行研究。同时,头皮水平脑电的大脑功能连接计算无法精确模拟解剖结构的脑区连接,而大脑源(源空间)层次的功能连接很好地解决了这个问题,实现了高时间分辨率及高空间分辨率的结合。近年来EEG源连通性的研究逐渐增多,我们将在下一步尝试应用于新生儿期患儿,使无创精确的早期脑功能评估为患儿的早期干预和改善预后提供科学依据。
所有作者均声明不存在利益冲突



























