
分析腓骨肌萎缩症(CMT)常用量表的相关性,探讨四种常见CMT基因亚型(CMT1A、CMT1X、CMT2A和MPZ相关CMT)在首诊横断面的神经功能障碍特点。
纳入2009—2019年期间就诊于中南大学湘雅三医院神经内科、已明确基因诊断且首诊年龄≥10岁的CMT患者共117例,其中CMT1A型45例、CMT1X型41例、CMT2A型19例、髓鞘蛋白零(MPZ)相关CMT 12例。系统收集所有患者首诊时的临床资料并进行腓骨肌萎缩症神经病变评分(CMTNS)、腓骨肌萎缩症检查评分(CMTES)、总体神经功能限制评分(ONLS)和功能残疾评分(FDS),采用Spearman检验分析CMTES、ONLS、FDS与CMTNS的相关性;分析四组基因亚型患者组间及组内性别、发病年龄、病程、量表评分等临床特点。
117例CMT首诊患者的男女比例为1.79∶1,发病年龄为(19±13)岁,病程为10(3,15)年,首诊时CMTNS为(11.4±6.2)分,CMTES为(8.8±5.7)分,ONLS为(2.7±1.4)分,FDS为(2.6±1.3)分。CMTES、ONLS、FDS评分与CMTNS评分在117例CMT患者及其四个基因型亚组中均呈正相关(均r≥0.40,P<0.05);CMTNS、CMTES、ONLS评分均显示与各基因亚型病程呈正相关(均P<0.05);FDS评分与CMT1A、CMT1X、MPZ相关CMT亚型的病程无相关性(均P>0.05)。CMT2A患者发病年龄早于CMT1A、CMT1X及MPZ相关的CMT(P<0.05),且早发型CMT2A患者的各量表评分高于成年型CMT2A患者:CMTNS、CMTES、ONLS、FDS(均P<0.05);CMT1X男性患者的各量表评分均高于女性CMT1X患者:CMTNS、CMTES、ONLS、FDS(均P<0.05)。
CMTNS、CMTES与ONLS评分可用于CMT各基因亚型的自然病史和临床试验等研究。CMT2A患者发病年龄较早,早发型CMT2A患者较成年型的功能障碍严重。CMT1X男性患者的神经功能障碍较女性患者重。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
腓骨肌萎缩症,又称为夏科-马里-图斯病(Charcot-Marie-Tooth disease,CMT),是一组最常见的具有高度临床和遗传异质性的周围神经单基因遗传病,以儿童、青少年时期起病,慢性进行性四肢远端肌无力及肌萎缩、末梢型感觉障碍、腱反射减退或消失和高弓足等骨骼畸形为主要临床特征,患病率约为 40/100 000[1, 2]。至今已有超过100个CMT致病基因被克隆(http://neuromuscular.wustl.edu/),其中以周围神经髓鞘蛋白基因(PMP22)大片段重复突变导致的 CMT1A型、缝隙连接蛋白基因(GJB1)点突变导致的 CMT1X型、线粒体融合蛋白基因(MFN2)点突变导致的CMT2A型和髓鞘蛋白零基因(MPZ)点突变导致的相关CMT最常见,约占基因型确诊病例的90% 以上[3]。随着分子生物学的进展,CMT基因亚型的自然病史研究和靶向治疗试验将在临床逐步开展。根据不同临床情况正确选择功能评分量表将为上述研究提供合理的临床测量工具。本研究为首诊横断面研究,我们对4个常见CMT基因亚型的首诊患者进行腓骨肌萎缩症神经病变评分(CMTNS)和腓骨肌萎缩症检查评分(CMTES)、总体神经功能限制评分(ONLS)、功能残疾评分(FDS)测评,分析各评分量表在评估CMT病情严重程度的相关性,并探讨各基因亚型患者在首诊横断面的神经功能障碍特点。
收集2009-2019年期间就诊于中南大学湘雅三医院及湘雅医院神经内科,已明确基因诊断且首诊时年龄≥10岁的CMT患者117例,其中CMT1A型45例、CMT1X型41例、CMT2A型19例及MPZ相关CMT 12例。所有患者临床诊断符合Bird[4]在GeneReviews发表的CMT诊断标准。本研究经中南大学湘雅三医院伦理委员会批准(批号:2020-S036),所有患者均签署知情同意书。
采用首诊横断面调查方法,由2名神经内科专科医师对117例CMT患者进行详细的病史询问、体格检查,其中71例患者进行神经电生理检测。选取左侧正中神经的复合肌肉动作电位(CMAP)、感觉神经动作电位(SNAP)波幅参数指标用于CMTNS评分。使用CMTNS、CMTES、ONLS和FDS评分评估神经功能障碍严重程度。各量表评定由受过系统培训的2名神经内科专科医生同时进行。在117例患者以及四组基因亚型进行CMTES、ONLS、FDS与CMTNS评分的相关性分析;比较4组基因亚型患者在性别、发病年龄、病程和各量表评分的组间和组内差异(发病年龄≤18岁为早发组,>18岁为成年发病组;病程≤10年为短病程组,>10年为长病程组)。
采用统计分析软件SPSS 23.0进行统计分析。正态分布的计量资料以表示,非正态分布的计量资料以[M(Q1,Q3)]表示,当同一组同一指标数据有偏态分布时,采用非正态分布数据的检验方法。相关性分析采用 Spearman检验,r≥0.40和双侧P<0.05表示有明显的相关性。正态分布计量资料两组间比较采用独立样本t检验,多组间比较采用方差分析,非正态分布的计量资料两组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis H检验,进一步两两比较采用Nemenyi检验,检验水准α=0.05,双侧P<0.05为差异有统计学意义。
纳入本研究的CMT首诊患者共117例,其中男75例,女42例,男女比例为1.79/1;发病年龄(19±13)(0~49)岁;病程10(3, 15)(0~41)年。CMTNS评分为(11.4±6.2)分;CMTES评分为(8.8±5.7)分;ONLS评分为(2.7±1.4)分;FDS评分为(2.6±1.3)分(表1)。
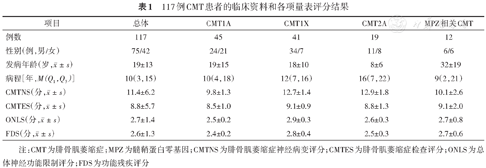
117例CMT患者的临床资料和各项量表评分结果
117例CMT患者的临床资料和各项量表评分结果
| 项目 | 总体 | CMT1A | CMT1X | CMT2A | MPZ相关CMT |
|---|---|---|---|---|---|
| 例数 | 117 | 45 | 41 | 19 | 12 |
| 性别(例,男/女) | 75/42 | 24/21 | 34/7 | 11/8 | 6/6 |
| 发病年龄(岁,) | 19±13 | 19±15 | 18±10 | 8±6 | 32±19 |
| 病程[年,M(Q1,Q3)] | 10(3,15) | 10(4,18) | 12(7,16) | 16(7,22) | 9(2,21) |
| CMTNS(分,) | 11.4±6.2 | 9.8±1.3 | 12.7±1.4 | 12.9±1.8 | 10.1±2.6 |
| CMTES(分,) | 8.8±5.7 | 8.5±1.0 | 9.1±0.9 | 8.8±1.3 | 9.1±2.0 |
| ONLS(分,) | 2.7±1.4 | 2.5±0.2 | 2.9±0.3 | 2.6±0.3 | 2.7±0.8 |
| FDS(分,) | 2.6±1.3 | 2.4±0.2 | 2.8±0.4 | 2.5±0.3 | 2.7±0.6 |
注:CMT为腓骨肌萎缩症;MPZ为髓鞘蛋白零基因;CMTNS为腓骨肌萎缩症神经病变评分;CMTES为腓骨肌萎缩症检查评分;ONLS为总体神经功能限制评分;FDS为功能残疾评分
在总体及四组基因亚型的CMT患者中,运用Spearman检验CMTES、ONLS、FDS与CMTNS的相关性分析,结果显示:117例CMT首诊患者CMTES(r=0.925,P<0.001)、ONLS(r=0.619,P<0.001)、FDS(r=0.540,P<0.001)与CMTNS评分有相关性(图1)。CMT1A首诊患者CMTES(r=0.926,P<0.001)、ONLS(r=0.589,P=0.002)、FDS(r=0.419,P=0.037)与CMTNS评分有相关性;CMT1X首诊患者CMTES(r=0.887,P<0.001)、ONLS(r=0.449,P=0.004)、FDS(r=0.406,P=0.006)与CMTNS评分有相关性;CMT2A首诊患者CMTES(r=0.975,P<0.001)、ONLS(r=0.868,P<0.001)、FDS(r=0.707,P=0.010)与CMTNS评分有相关性;MPZ相关CMT首诊患者CMTES(r=0.959,P<0.001)、ONLS(r=0.801,P=0.006)、FDS(r=0.675,P=0.030)与CMTNS评分有相关性(图2)。117例CMT总体及四组基因亚型患者FDS与CMTNS的相关性系数r均小于CMTES和ONLS,进一步在四组常见亚型的CMTES、ONLS、FDS与CMTNS相关性分析中,CMTNS、CMTES、ONLS均显示与病程呈正相关(P<0.05),但CMT1A、CMT1X、MPZ相关CMT长病程组与短病程组患者的FDS评分差异无统计学意义(P>0.05),FDS与患者的病程未显示出相关性(表2)。
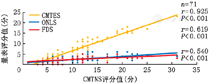

注:CMT为腓骨肌萎缩症;MPZ为髓鞘蛋白零基因;CMTNS为腓骨肌萎缩症神经病变评分;CMTES为腓骨肌萎缩症检查评分;ONLS为总体神经功能限制评分;FDS为功能残疾评分。相关性研究使用Spearman相关分析,r≥0.40和P<0.05时表示有显著的相关性
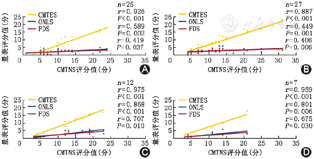

注:CMT为腓骨肌萎缩症;MPZ为髓鞘蛋白零基因;CMTNS为腓骨肌萎缩症神经病变评分;CMTES为腓骨肌萎缩症检查评分;ONLS为总体神经功能限制评分;FDS为功能残疾评分。图A、B、C、D分别为:CMT1A、CMT1X、CMT2A及MPZ相关CMT患者的CMTES、ONLS、FDS与CMTNS相关性分析散点图;相关性研究使用Spearman相关分析,r≥0.40和P<0.05时表示有显著的相关性
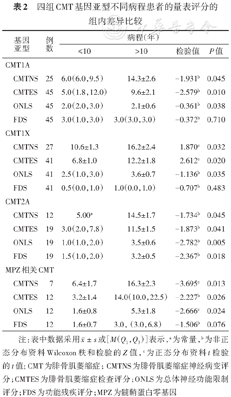
四组CMT基因亚型不同病程患者的量表评分的组内差异比较
四组CMT基因亚型不同病程患者的量表评分的组内差异比较
| 基因 亚型 | 例数 | 病程(年) | |||
|---|---|---|---|---|---|
| ≤10 | >10 | 检验值 | P值 | ||
| CMT1A | |||||
CMTNS | 25 | 6.0(6.0,9.5) | 14.3±2.6 | -1.931b | 0.045 |
CMTES | 45 | 5.0(1.8,12.0) | 9.6±2.1 | -2.579b | 0.010 |
ONLS | 45 | 2.0(2.0,3.0) | 2.1±0.6 | -0.361b | 0.038 |
FDS | 45 | 3.0(1.0,3.0) | 3.0(3.0,3.0) | -0.372b | 0.710 |
| CMT1X | |||||
CMTNS | 27 | 10.6±1.3 | 16.2±2.4 | 1.870c | 0.032 |
CMTES | 41 | 6.8±1.0 | 12.2±1.8 | 2.612c | 0.020 |
ONLS | 41 | 2.5(1.0,3.0) | 3.6±0.7 | -1.136b | 0.035 |
FDS | 41 | 0.5(0.0,1.0) | 1.0(0.0,1.0) | -0.707b | 0.483 |
| CMT2A | |||||
CMTNS | 12 | 5.00a | 14.5±1.7 | -1.734b | 0.045 |
CMTES | 19 | 3.0(2.0,7.8) | 11.5±1.5 | -1.873b | 0.041 |
ONLS | 19 | 1.0(1.0,2.0) | 3.5±0.6 | -2.782b | 0.005 |
FDS | 19 | 1.5(1.0,2.0) | 3.2±0.5 | -2.367b | 0.018 |
| MPZ相关CMT | |||||
CMTNS | 7 | 6.4±1.7 | 16.3±2.3 | -3.695c | 0.013 |
CMTES | 12 | 3.2±1.4 | 14.0(10.0,22.5) | -2.227b | 0.026 |
ONLS | 12 | 1.6±0.8 | 5.3±1.8 | -2.666c | 0.024 |
FDS | 12 | 1.6±0.7 | 3.0, (3.0,6.8) | -1.506b | 0.076 |
注:表中数据采用或[M(Q1,Q3)]表示,a为常量,b为非正态分布资料Wilcoxon秩和检验的Z值,c为正态分布资料t检验的t值; CMT为腓骨肌萎缩症; CMTNS为腓骨肌萎缩症神经病变评分;CMTES为腓骨肌萎缩症检查评分;ONLS为总体神经功能限制评分;FDS为功能残疾评分;MPZ为髓鞘蛋白零基因
在病程、性别、发病年龄方面,四组亚型患者量表评分的组内差异比较表明:4个亚型长病程组与短病程组患者的CMTNS、CMTES、ONLS评分差异有统计学意义(P<0.05),患者病程越长,神经功能障碍越严重(表2);CMT1X男性与女性患者的CMTNS(P=0.028)、CMTES(P=0.014)、ONLS(P=0.023)、FDS(P=0.002)评分差异有统计学意义,男性患者神经功能障碍较女性严重,其余3型的差异无统计学意义(表3);早发与成年发病CMT2A患者的CMTNS(P=0.031)、CMTES(P=0.048)、ONLS(P=0.042)、FDS(P=0.047)评分差异有统计学意义,早发CMT2A较成年发病CMT2A神经功能障碍严重(表3)。四组CMT基因亚型患者在发病年龄(P<0.001)的组间差异有统计学意义,采用Nemenyi检验两两比较后发现:CMT2A患者发病年龄早于其他3个亚型(P<0.050);四组亚型患者病程的组间差异无统计学意义(表4)。
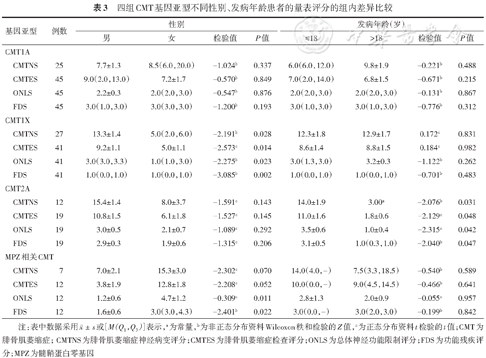
四组CMT基因亚型不同性别、发病年龄患者的量表评分的组内差异比较
四组CMT基因亚型不同性别、发病年龄患者的量表评分的组内差异比较
| 基因亚型 | 例数 | 性别 | 发病年龄(岁) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 检验值 | P值 | ≤18 | >18 | 检验值 | P值 | ||
| CMT1A | |||||||||
CMTNS | 25 | 7.7±1.3 | 8.5(6.0,20.0) | -1.024b | 0.337 | 6.0(6.0,12.0) | 9.8±1.9 | -0.221b | 0.488 |
CMTES | 45 | 9.0(2.0,13.0) | 7.2±1.7 | -0.570b | 0.849 | 7.0(2.0,14.0) | 6.8±1.5 | -0.671b | 0.215 |
ONLS | 45 | 2.2±0.3 | 2.0(2.0,3.0) | -0.547b | 0.876 | 2.0(2.0,3.0) | 2.0(2.0,3.0) | -0.131b | 0.867 |
FDS | 45 | 3.0(1.0,3.0) | 3.0(3.0,3.0) | -1.200b | 0.193 | 3.0(1.0,3.0) | 3.0(1.0,3.0) | -0.776b | 0.312 |
| CMT1X | |||||||||
CMTNS | 27 | 13.3±1.4 | 5.0(2.0,6.0) | -2.191b | 0.028 | 12.3±1.8 | 12.9±1.7 | 0.172c | 0.831 |
CMTES | 41 | 9.2±1.1 | 5.0±1.1 | -2.573c | 0.014 | 8.6±1.4 | 8.8±1.5 | 0.184c | 0.982 |
ONLS | 41 | 3.0(3.0,3.3) | 1.0(1.0,3.0) | -2.275b | 0.023 | 3.0(1.3,3.0) | 3.2±0.3 | -1.122b | 0.262 |
FDS | 41 | 1.0(0.0,1.0) | 1.0(0.0,1.0) | -3.085b | 0.002 | 1.0(0.0,1.0) | 1.0(0.0,1.0) | -0.701b | 0.483 |
| CMT2A | |||||||||
CMTNS | 12 | 15.4±1.4 | 8.0±3.7 | -1.591c | 0.143 | 14.0±1.9 | 3.00a | -2.076b | 0.031 |
CMTES | 19 | 10.8±1.5 | 6.1±1.8 | -1.527c | 0.145 | 11.0±1.6 | 1.8±0.6 | -2.129c | 0.048 |
ONLS | 19 | 3.0±0.5 | 2.1±0.7 | -1.089c | 0.292 | 3.5±0.6 | 1.0±0.4 | -2.315c | 0.042 |
FDS | 19 | 2.9±0.3 | 1.9±0.6 | -1.315c | 0.206 | 3.1±0.5 | 1.0(0.3,1.0) | -2.040b | 0.047 |
| MPZ相关CMT | |||||||||
CMTNS | 7 | 7.0±2.1 | 15.3±3.0 | -2.302c | 0.070 | 14.0(4.0,-) | 7.5(3.3,18.5) | -0.540b | 0.589 |
CMTES | 12 | 3.8±1.9 | 12.8±1.8 | -2.208c | 0.052 | 10.0(0.0,-) | 9.0(4.5,14.5) | -0.466b | 0.641 |
ONLS | 12 | 1.2±0.6 | 4.7±1.2 | -0.309c | 0.011 | 2.8±1.3 | 2.0±0.9 | -0.055c | 0.957 |
FDS | 12 | 1.6±0.6 | 3.0(3.0,4.3) | -2.401b | 0.022 | 3.0(0.0,-) | 3.0(2.0,3.0) | -0.199b | 0.842 |
注:表中数据采用或[M(Q1,Q3)]表示,a为常量,b为非正态分布资料Wilcoxon秩和检验的Z值,c为正态分布资料t检验的t值;CMT为腓骨肌萎缩症; CMTNS为腓骨肌萎缩症神经病变评分;CMTES为腓骨肌萎缩症检查评分;ONLS为总体神经功能限制评分;FDS为功能残疾评分;MPZ为髓鞘蛋白零基因
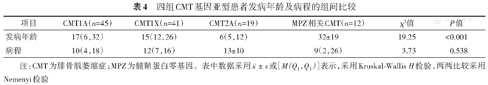
四组CMT基因亚型患者发病年龄及病程的组间比较
四组CMT基因亚型患者发病年龄及病程的组间比较
| 项目 | CMT1A(n=45) | CMT1X(n=41) | CMT2A(n=19) | MPZ相关CMT(n=12) | χ²值 | P值 |
|---|---|---|---|---|---|---|
| 发病年龄 | 17(6,32) | 15(12,26) | 6(5,12) | 32±19 | 19.25 | <0.001 |
| 病程 | 10(4,18) | 12(7,16) | 13±10 | 9(2,26) | 3.73 | 0.538 |
注:CMT为腓骨肌萎缩症;MPZ为髓鞘蛋白零基因。表中数据采用或[M(Q1,Q3)]表示,采用Kruskal-Wallis H检验,两两比较采用Nemenyi检验
CMT作为一组最常见的遗传性周围神经病,具有高度临床和遗传异质性。随着分子遗传学的进展,目前已有100多个CMT基因相继被克隆,不同CMT基因亚型患者在神经功能障碍严重程度、病情进展速度、伴随症状等自然病程方面也存在差异和各自的特点[1, 5]。基于CMT特定致病基因相应发病机制的靶向治疗快速发展,如何合理选择评分量表对患者的功能障碍进行动态测量,将是不同CMT基因亚型自然病史和临床药物试验有效开展的重要前提[6, 7, 8, 9, 10]。
CMTNS是目前常规用于临床评估CMT功能障碍的量表,由Shy等[11]在2005年从总体神经病评分(TNS)修订而来。CMTNS包括上、下肢运动和感觉症状,上、下肢肌力和痛觉、震动觉体查,上肢运动、SNAP波幅9项指标,以提供量化CMT残疾的测量工具。CMTES量表则是CMTNS除神经电生理之外的7项指标,用于未接受神经电生理检测的CMT患者的功能缺损评估,或定期复诊CMT患者的临床评估[12]。ONLS量表由Graham和Hughes[13]于2006年从用于评估免疫介导周围神经病患者的运动功能的总体残疾评分(ODSS)修订而来,评估上下肢在日常活动中的受限程度。该量表通过问诊或要求患者执行指令完成评估,适用于CMT长程病情观察和临床试验。FDS量表由Birouk等[14]于1997年用于评估周围神经病患者下肢运动功能而提出的评估量表,未涵盖上肢功能障碍的评估内容。本研究结果显示,虽然在首诊CMT患者评估中CMTES、ONLS、FDS与CMTNS均具有相关性,但FDS与CMTNS的相关系数较CMTES、ONLS与CMTNS的相关系数小;在四组常见亚型的CMTES、ONLS、FDS与CMTNS相关性分析中,CMTNS、CMTES、ONLS均显示与病程呈正相关,但FDS与患者的病程未显示出相关性,表明FDS对CMT功能障碍及其进展评估的敏感度欠佳,不适用于CMT病程的功能障碍动态评估。FDS敏感度差异可能与FDS评估项目中未涵盖上肢功能障碍有关。基于以上,建议对首诊CMT患者常规开展CMTNS和ONLS综合功能障碍评估;在复诊和未接受神经电生理检查的门诊CMT患者运用CMTES和ONLS进行功能障碍评估;在定期随访电话咨询时采用ONLS来评估患者的病程进展[15]。
由于CMT具有高度的遗传异质性,对不同基因亚型的CMT开展详尽的基因型-表型相关性分析和自然病程研究有助于诠释各亚型的内在发病机制、探寻分子靶点和评估临床治疗效果。本研究对四组CMT基因亚型患者功能障碍的横断面研究显示,早发CMT2A患者通常周围神经损伤的功能障碍更加严重,提示相应的MFN2基因特点位点的突变可能导致更显著线粒体结构和功能损伤,从而出现相应的生命早期周围神经轴索变性和早发严重的临床表型;本研究发现CMT1X男性患者的神经功能障碍程度通常较女性CMT1X患者更严重,与既往CMT1X临床表型研究结果一致,其内在机制可能在于CMT1X的致病突变基因间隙连接蛋白β1(GJB1)基因位于Xq13.1,女性CMT1X患者的两条X染色体之一出现随机失活的莱昂化(Lyonization),成为具有野生和突变GJB1基因两种细胞的嵌合体[16, 17, 18]。
综上,CMT患者的CMTES、ONLS与CMTNS评分有显著相关性,可根据不同的临床情况用于CMT的临床试验和自然病史等研究;CMT具有高度遗传异质性,基于基因亚型的临床表型分析有助于阐述内在分子机制和评估临床治疗效果。
所有作者均声明不存在利益冲突



























