
探究SQSTM1在甲状腺乳头状癌中的表达及其对甲状腺乳头状癌细胞TPC-1侵袭和迁移能力的影响。
采集2019年4至6月郑州大学第一附属医院收治的21例甲状腺乳头状癌患者切除手术的癌组织和癌旁组织,通过逆转录-聚合酶链反应(RT-qPCR)方法检测组织中SQSTM1的表达情况;通过慢病毒转染在TPC-1细胞中构建SQSTM1缺失细胞系SQSTM1-KD-TPC-1, RT-qPCR从基因水平检测SQSTM1在TPC-1 和SQSTM1-KD-TPC-1细胞中的表达;transwell法检测SQSTM1敲低前后TPC-1侵袭和迁移的变化情况;MTT和平板克隆形成实验检测SQSTM1敲低后TPC-1细胞增殖能力的变化;通过RT-qPCR检测增殖相关蛋白的表达情况,从基因水平进一步验证肿瘤细胞对增殖能力的影响。
甲状腺乳头状癌组织中SQSTM1的表达明显高于正常癌旁组织,有76.2%(16/21)的患者mRNA呈现高表达;敲低SQSTM1明显抑制肿瘤增殖、侵袭和迁移的能力,且增殖相关蛋白表达明显减小(P均<0.01),表明SQSTM1参与增殖相关通路机制的调控。
SQSTM1在甲状腺乳头状癌细胞株TPC-1中明显促进细胞侵袭、迁移和增殖,可能是潜在的基因治疗靶点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺乳头状癌是最高发的头颈部肿瘤之一,是甲状腺肿瘤最常见的病理类型,占其80%~90%[1, 2, 3]。近年来有研究表明,甲状腺癌的发病年龄呈现年轻化趋势,且多为甲状腺乳头状癌[4]。甲状腺肿瘤具有发病率高、易转移、易复发的特点,如何控制患者的复发转移是临床工作中的一项重要内容[5]。其中自噬和泛素化在肿瘤细胞中扮演了重要角色[6]。本研究检测了SQSTM1在甲状腺乳头状癌组织和癌旁组织中的表达情况, 利用慢病毒转染在甲状腺乳头状癌细胞(TPC-1)中构建SQSTM1敲低细胞系SQSTMI-KD-TPC-1,研究SQSTM1对肿瘤细胞侵袭、迁移、增殖能力的影响,并通过逆转录聚合酶链反应(RT-qPCR)从mRNA层面进一步验证侵袭迁移相关蛋白的表达情况,从多个层面探讨SQSTM1对甲状腺乳头状癌的调控机制,为探究甲状腺乳头状癌新的治疗靶点提供研究基础。
1.临床资料:收集郑州大学第一附属医院2019年4至10月首次行甲状腺乳头状癌切除术的组织标本21例,经病理医师诊断后放入液氮保存。本研究得到患者的知情同意。
2.细胞培养:人甲状腺乳头状癌肿瘤细胞株TPC-1来自上海瑞金医院赠送,RPMI-1640培养基购自北京索莱宝科技有限公司;SQSTM1慢病毒购自上海吉凯基因化学技术有限公司;胰蛋白酶购自北京雷根生物技术有限公司;胎牛血清购自美国Gemini公司。细胞在RPMI-1640培养液和10%胎牛血清配成的完全培养基中培养,培养条件为37 ℃、5%CO2恒温培养箱,1.25 g/L胰蛋白酶消化传代,放入液氮罐长期保存。
3.慢病毒转染:取对数生长期细胞TPC-1接种于24孔板中,根据感染复数(MOI)=20及病毒滴度,加入相应病毒,37 ℃培养8~12 h,更换为完全培养基继续培养,约72 h后观察荧光转染效率,细胞形态发生明显变化,选择合适时间进行后续实验。
4. transwell侵袭迁移实验:侵袭实验:取对数生长期的细胞用无血清培养液制成密度为2×105个/ml的单细胞悬液,将transwell小室置于24孔板中。取Matrigel胶与无血清RPMI-1640培养基以1∶8比例稀释,包被于transwell小室底部膜的上室面,置于37 ℃培养箱30 min使其凝固,水化后加入制备好的无血清细胞悬液200 μl,下室加入10%胎牛血清培养基600 μl,置入37 ℃、5%CO2培养箱中孵育,0、12、 24、 36、48 h取出固定染色,倒置显微镜观察穿过transwell小室底部膜的下室面细胞,随机选取5个低倍视野并计数。迁移实验:取对数生长期的细胞用无血清培养液制成密度为2×105个/ml的单细胞悬液,将transwell小室置于24孔板中。于transwell小室上室加入制备好的细胞悬液200 μl,下室加入带血清培养基600 μl,置入37 ℃、5%CO2培养箱中孵育,0、12、 24、 36、48 h取出固定染色,倒置显微镜观察穿过transwell小室底部膜的下室面细胞,随机选取5个低倍视野并计数。
5.MTT细胞增殖实验:取对数生长期的细胞制成单细胞悬液,调整浓度为5×104个/ml,96孔板每孔加入100 μl,设4个复孔,5%CO2、37 ℃孵育,以12、24、36、48 h时间点分别加入0.5% MTT 20 μl,继续培养4 h后,加入二甲基亚砜150 μl,摇床上低速震荡10 min后,在酶联免疫检测仪OD490 nm处测各孔的吸光度(A)值,绘制细胞增殖曲线。
6.平板集落形成实验:取对数生长期细胞于6 cm培养皿(200个/皿)中培养2周,每组重复3次。37 ℃、5%CO2培养箱中孵育,根据细胞生长情况更换新鲜培养基。4%多聚甲醛固定30 min,结晶紫染色30 min,小心冲洗晾干后计数统计。
7.RT-qPCR:取对数生长期的细胞,TRIzol法提取总RNA,检测RNA浓度、纯度和完整性合格后,使用购自日本TaKaRa公司的Prime Script RT reagent Kit和荧光定量试剂盒按说明书操作,去除基因组gDNA,反转录成cDNA,通过聚合酶链式反应扩增特定DNA片段,测得CT值,计算2-ΔΔCT并绘制柱状图。使用的引物序列如表1。

目的基因及引物序列
目的基因及引物序列
| 目的 基因 | 引物序列 |
|---|---|
| CCND | 上游: 5′--3′ TTCCTGTCCTACTACCGCCTCA |
| 下游: 5′--3′ TCCACCTCCTCCTCCTCCTCTT | |
| Ki67 | 上游: 5′--3′ AAGGACTGGAAATAGCAGAGG |
| 下游: 5′--3′ GGATGTGATGGCTGATGAA | |
| PCNA | 上游: 5′--3′ CTTCCCGCCGTCCTGTAGC |
| 下游: 5′--3′ GCCGGCGCATTTTAGTATTTTG | |
| CHERK1 | 上游: 5′--3′ TCCCCCGGGACCGGGCTGAAGTAAAGCAT |
| 下游: 5′--3′ CCCAAGCTTCTCCCAAGCACACCGAAGGT | |
| CHERK2 | 上游: 5′--3′ CCAGCACGATGCCAAACTCCA |
| 下游: 5′--3′ CGTGATACTATACAACAAAGGGTC |
8.统计学处理:应用SPSS 22.0 统计分析软件对数据进行统计学处理,每组实验重复3次,服从正态分布的计量资料以表示,组间比较采用独立样本t检验,双侧检验,检验水准α=0.05。
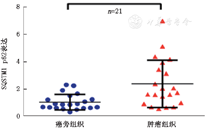
1. SQSTM1在甲状腺乳头状癌中的表达:结果显示SQSTM1 mRNA在甲状腺乳头状癌组织中的表达明显高于癌旁组织,有76.2%(16/21)的患者mRNA呈现高表达,差异有统计学意义(P<0.01,图1),提示SQSTM1的异常上调可能在甲状腺乳头状癌的发生发展过程中发挥重要作用。

2. SQSTM1慢病毒转染:细胞荧光及RT-qPCR检测SQSTM1的mRNA表达水平检测转染效果,结果显示在MOI值20的情况下,慢病毒敲低SQSTM1的效果最显著(图2),表明SQSTM1-KO-TPC-1细胞系构建成功。
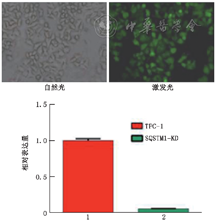

注:1为甲状腺乳头状癌细胞TPC‑1;2为SQSTM1慢病毒
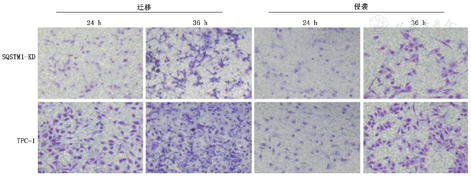
3. SQSTM1抑制甲状腺乳头状癌细胞TPC-1的侵袭和迁移能力:通过transwell侵袭迁移实验可见,敲低SQSTM1后,穿过transwell小室下层膜的细胞数明显减少,细胞侵袭和迁移能力明显降低,说明SQSTM1能促进甲状腺乳头状癌细胞的侵袭和迁移(图3)。

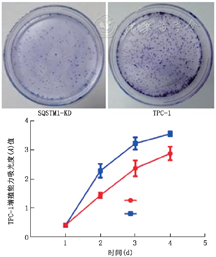
4.SQSTM1抑制甲状腺乳头状癌TPC-1的增殖能力:通过MTT法和集落形成实验检测细胞生长情况,可见SQSTM1敲低后,集落形成的能力减弱,细胞生长速度明显变缓(图4,P<0.05)。

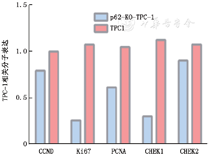
5. SQSTM1影响侵袭迁移相关分子的表达:为探究SQSTM1 影响甲状腺乳头状癌TPC-1细胞增殖的可能机制,检测SQSTM1基因沉默前后,TPC-1细胞中增殖相关分子CCND、Ki67、PCNA、CHEK1和CHEK2的表达。结果显示,与对照组相比,转染SQSTM1 shRNA 后,p62-KO-TPC-1中CCND、Ki67、PCNA、CHEK1和CHEK2的mRNA表达水平均下降(P<0.05),尤以Ki67、CHEK1最为明显(P<0.01,图5)。

SQSTM1是自噬-泛素蛋白酶体降解途径的重要调控分子,通过与小泛素分子结合,将底物蛋白运送至自噬溶酶体完成底物蛋白降解,可以调控多种细胞生命活动相关的分子通路。细胞的蛋白降解系统有助于大分子蛋白在胞内消化再分布,维持代谢平衡,对细胞调节自身能量状态以适应外界环境,维持细胞生存发挥重要作用。在本研究中,通过临床检验、体外实验和相关分子机制的探索,探讨SQSTM1沉默后对TPC-1生物学行为的影响。
有研究发现,在食管癌中SQSTM1高表达影响着肿瘤的发生发展过程,在乳腺癌中SQSTM1的高表达促进乳腺癌细胞的侵袭和迁移能力[7, 8]。本研究也有类似结果。
SQSTM1是泛素和自噬相关的货车蛋白,在调节细胞内蛋白降解中发挥重要作用[9]。有报道指出,SQSTM1参与细胞周期、细胞代谢、硒对过氧自由基的清除作用等多种细胞生物学活动[10]。SQSTM1基因突变与骨Paget病、髓系白血病、神经退行性疾病、肥胖、血管衰老、衰老病理和癌症密切相关[11, 12, 13, 14, 15]。
本研究表明,SQSTM1在甲状腺乳头状癌组织中的表达高于癌旁组织,在甲状腺乳头状癌细胞TPC-1中敲低SQSTM1后细胞增殖能力减弱,侵袭迁移能力受到抑制,增殖相关分子出现差异表达,差异具有统计学意义(P<0.05),提示SQSTM1高表达可促进甲状腺乳头状癌的生长和转移。但影响肿瘤细胞生物学行为的因素有很多,SQSTM1发挥功能所涉及的具体信号通路有待进一步研究探讨。
总之,本研究发现甲状腺乳头状癌中存在SQSTM1 的异常高表达,影响甲状腺乳头状癌细胞的增殖、侵袭和迁移,发挥促肿瘤作用。
所有作者均声明不存在利益冲突



























