
探讨儿童先天性肺囊性腺瘤样畸形(congenital cystic adenomatoid malformation of lung,CCAM)的临床、影像及组织病理特点,提高临床对该病的认识。
收集新乡医学院第一附属医院经病理证实为CCAM的4例患儿病例资料,对其临床表现、影像学及病理特点、治疗方法进行分析。
3例患儿有反复呼吸道感染,1例自发性气胸;2例胸部X线见到囊性改变,2例胸部CT提示存在CCAM,1例提示肺脓肿,1例提示不除外肺隔离症;4例均手术切除病变肺叶,术后病理证实为CCAM,均预后良好。
反复呼吸道感染者需注意该病可能,需结合临床表现、CT检查、病理结果共同诊断CCAM,手术切除是有效治疗手段。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
先天性肺囊性腺瘤样畸形(congenital cystic adenomatoid malformation of lung,CCAM)在儿科临床中少见,是先天性肺囊性疾病的一种类型,起源与支气管源性囊肿、肺泡源性囊肿、肺隔离症、先天性大叶性肺气肿不同,影像学及组织病理特点均有相似性,需综合多方面证据进行明确诊断[1]。本文回顾我院4例CCAM病例特点,结合文献分析,以加强对该病的认识。
收集新乡医学院第一附属医院诊断为CCAM的4例患儿病例资料。结合症状、体征、肺部CT以及术后病理检查4例病例均符合《实用小儿呼吸病学》[2]CCAM诊断标准,其中年龄最大者9岁,最小者10个月;病史5 d~8个月,3例存在反复呼吸道感染,1例为首次发病,4例均行手术治疗后病理证实。
通过电子病历系统查询近年来我院诊断为CCAM的病例,从中筛选出14岁以下的儿童病例,进行临床资料回顾分析。4例患儿均在我院行64排胸部CT扫描(东芝Aquilion 64CT),患儿3、4加做增强CT;所有CT报告均由1名主治医师和1名副主任医师共同阅片分析。术后对切除肺叶标本经中性缓冲甲醛液固定,常规取材,石蜡包埋,行HE染色,在光镜下进行观察;病理报告由1名主治医师和1名高级职称的病理医师进行审核。
病例1,女,9岁,因"发热、咳嗽3 d"为主诉入院;病例2,女,5岁,因"发热、咳嗽2周"为主诉入院;病例3,女,8岁,因"间断咳嗽、发热、胸痛5 d"为主诉入院;病例4,男,10个月,因"间断发热10 d、咳嗽伴呼吸费力5 d"为主诉入院。患儿主要临床症状及肺部体征见表1、表2。

4例患儿主要临床症状
4例患儿主要临床症状
| 病例 | 发热热峰≥39 ℃ | 咳嗽 | 咳痰 | 喘息 | 呼吸费力 | 胸痛 | >2次下呼吸道感染 |
|---|---|---|---|---|---|---|---|
| 1 | √ | √ | √ | √ | |||
| 2 | √ | √ | √ | √ | |||
| 3 | √ | √ | √ | √ | |||
| 4 | √ | √ | √ | √ | √ | √ |

4例患儿主要肺部体征
4例患儿主要肺部体征
| 病例 | 三凹征阳性 | 病变侧叩诊音异常 | 湿啰音 | 哮鸣音 | 呼吸音不对称 |
|---|---|---|---|---|---|
| 1 | √ | √ | √ | ||
| 2 | √ | √ | √ | ||
| 3 | √ | √ | √ | ||
| 4 | √ | √ | √ | √ | √ |
4例患儿均行胸部X线及肺部CT扫描(表3,图1),4例X线胸片提示存在感染性病变,2例X线发现囊样改变。4例CT均发现多个囊性病变,3例测量最大囊直径均>20 mm,最大者直径约40 mm;1例最大囊直径<20 mm,病变均局限于单一肺叶;其中1例患儿初次报告提示存在左侧肺脓肿,抗感染治疗后复查CT发现囊性病变。1例CT平扫发现感染性病变伴多发囊腔,建议CT增强除外肺隔离症。2例患儿进行CT增强扫描未见明显异常强化灶,显示病变组织为肺动脉供血。
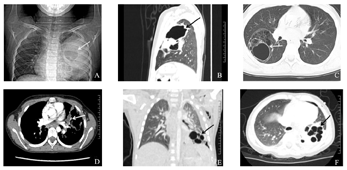

A:胸部X线提示左肺上野可见一类圆形囊性透亮影;B:CT矢状位示左上肺多发囊性透亮区,可见液气平面;C:CT水平位示右下肺多房囊实性肿物;D:CT增强扫描可见囊性部位为肺动脉供血,箭头所指为肺动脉;E:CT冠状位示左肺下叶大片实变,内见多发小囊状透亮影;F:CT水平位示左肺下叶多发薄壁小囊状透亮影。

4例患儿肺部CT所见囊性病变情况
4例患儿肺部CT所见囊性病变情况
| 病例 | 单个或多个囊 | 至少1个囊直径>20 mm | 囊直径2~20 mm | 囊直径<2 mm | 局限于单一肺叶 |
|---|---|---|---|---|---|
| 1 | √ | √ | √(右肺下叶) | ||
| 2 | √ | √ | √(右肺下叶) | ||
| 3 | √ | √ | √(左肺上叶) | ||
| 4 | √ | √ | √(左肺下叶) |


A :肺12 cm×8 cm×5 cm,多切面切开,局部可见囊腔直径约4 cm,周围肺组织呈小囊蜂窝状改变。B:一叶肺组织,大小约12.5 cm×7.5 cm×3 cm,大部被膜表面光滑,局部被膜发白,沿支气管打开肺,紧邻支气管断端、切面可见多个囊腔、直径2~4 cm,内含黄色胶冻样液体,紧邻胸膜,余切面灰红质软。
大体观察颜色灰黄色或暗紫色、被膜表面光滑;4例均见多个囊腔,3例囊腔直径大于20 mm,最大40 mm,1例直径13 mm;3例囊腔内可见灰白色或灰黄色胶冻样物。
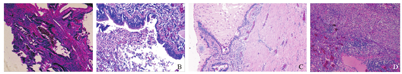

A:Stocker Ⅰ型囊壁内面衬以纤毛柱状上皮,间质纤维组织增生;B:Stocker Ⅱ型囊腔被附纤毛柱状上皮细胞,腔内充满红染无结构物及炎症细胞;C:大量炎症细胞及组织细胞浸润,肺泡结构消失伴脓腔形成,局灶细支气管化生;D:局灶肺泡腔内纤维组织增生,大量组织细胞及淋巴细胞浸润。
3例大体及镜下分型为Ⅰ型,表现为单个大囊腔伴周围小囊腔,囊壁被覆假复层纤毛柱状上皮,间质纤维组织增生,周围肺泡可见炎性细胞浸润;1例最大囊直径为13 mm,考虑为Ⅱ型,镜下表现为:囊壁被覆柱状上皮,肺泡腔内纤维组织增生,局灶细支气管化生。
CCAM发病率约为1/35 000~1/10 000,占先天性肺部畸形25%左右,无性别、种族、遗传、肺叶差异;目前Stocker根据病变组织学改变及不同时期气管支气管树相似性将CCAM分为5型,0、Ⅲ型少见,胎儿期或生后很快死亡;Ⅰ型最常见,预后好;Ⅱ型预后取决于合并畸形的多少;Ⅳ型临床中少见[3,4]。
胎儿期可发病,多见于2岁以内,本组发病年龄中位数为5岁7个月,可能与就诊时医疗条件有一定关系,与初次肺部CT检查时间有关。大多认为CCAM是一种局限性肺发育异常的病变,病因及发病机制尚未完全明确。部分认为最早发生在胚胎发育第5~10周,由于某种因素影响导致肺芽分支过程中局限缺损或停止,正常肺泡发育出现缺陷,出现远端终末细支气管过度增生、肺黏液腺过度增殖、已发育的肺组织过度增生,根据支气管芽隔断的数目不同可呈现单一囊肿或多房性蜂窝状囊肿,类似于错构瘤样表现[5,6,7];病变部位大多由肺循环供血、过度增生的终末支气管可与正常肺组织交通[8]。也有生长因子学说和遗传因素学说认为与CCAM的发病机制有关[9,10,11]。
CCAM的临床特征大致分为三种情况:(1)胎儿期死亡;(2)新生儿期进行性呼吸窘迫导致的死亡;(3)少数病例在儿童期才出现症状,一部分甚至到成年时才被发现。儿童期出现的临床表现主要为反复出现的肺部感染[12],多有发热、咳嗽、胸痛、呼吸费力等症状,少数可出现自发气胸。部分病例可合并其他器官发育畸形,特别需注意心脏、消化道和泌尿系统畸形[13,14,15]。本研究中4例患儿均在儿童期发病,3例存在2次以上的肺部感染,1例住院期间出现自发气胸,与该病儿童期发病临床表现较为一致。
影像学特征:绝大多数CCAM可在产前应用胎儿超声和MRI做出诊断,发现胎儿肺内囊性或实性病变伴有羊水增多、胎儿水肿时应高度警惕CCAM。超声多在孕17周后检出率高,检查具有无创、简单、可重复性,是产前诊断首选方式[14,16]。生后X线片检查虽有一定的参考价值,X线胸片同一部位反复肺部感染应提高警惕[17],但CCAM的主要影像学检查手段还是胸部CT,CT对先天性肺囊性疾病的不同类型进行鉴别是一种重要的方式,但最终确诊及分型仍依赖病理检查结果[18,19]。肺部CT主要表现为多发薄壁含气的囊状结构,囊通常大小不等,部分可见气液平面,病灶多累及一叶或两叶,可能造成纵隔向对侧移位,肺动脉供血。依据Stocker组织分型,结合CT检查仅能对Ⅰ、Ⅱ、Ⅲ型显示出差异,Ⅰ型:大囊型,至少1个囊腔直径>2 cm,囊壁厚薄不均,内可见不规则分隔;Ⅱ型:由多个直径约1~2 cm的薄壁小囊腔构成,呈蜂窝状改变;Ⅲ型为相对致密的实性肿块,其内见不规则囊状透亮区。部分病例合并感染时CT不能显示出囊性病变,需治疗后复查CT。本研究中4例患儿全部行CT检查,3例CT表现为CCAM Ⅰ型,可见病变局限于单一肺叶,病变部为可见多发大小不等囊状透亮影,囊壁厚薄较均匀;1例表现为病变部位多发囊实性肿物,内见液气平,增强扫描囊壁强化、囊液未见强化,后病理证实为CCAM Ⅱ型;其中2例行CT增强扫描可见到病变组织由肺动脉供血。
病理组织学按Stocker标准分型,将CCAM分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ型,具体如下[20,21,22,23]:0型:病变邻近中心,为致死性近端气管、支气管畸形,囊径直径约1~2 mm,内衬假复层纤毛柱状上皮,囊壁内含平滑肌、腺体和软骨成分;Ⅰ型:类似支气管和细支气管结构,是最常见的亚型;由多个直径>20 mm的厚壁囊腔组成,囊腔内衬假复层纤毛柱状上皮,囊壁周围有平滑肌及弹力组织;Ⅱ型:类似终末细支气管结构,由多个直径5~20 mm的小囊组成,内覆纤毛柱状上皮或立方上皮,囊壁含薄层平滑肌和少量弹性纤维;Ⅲ型:类似细支气管肺泡导管结构,直径一般不超过2 mm,其内为毛细支气管样小囊和不规则的细支气管样结构,类似管状期原始肺实质;Ⅳ型:为外围性囊肿,囊径薄,直径可达100 mm,内衬Ⅰ型和Ⅱ型肺泡上皮。本研究中4例病例通过巨检初步分为3例Ⅰ型、1例Ⅱ型,镜下结果证实符合CCAM。CCAM的诊断需要综合临床表现、影像学检查、病理结果综合判断;儿童期诊断应注意以下特点:(1)反复发作的呼吸道感染或肺炎;(2)完善胸部CT检查提示符合先天性囊腺瘤样畸形,必要时CT增强检查能提供较多鉴别信息;(3)术后病理检查可进一步分型确诊。需要与支气管源性囊肿、肺泡源性囊肿、肺隔离症、先天性大叶性肺气肿、先天性淋巴管扩张、膈疝、肺脓肿等相鉴别[24]。
治疗方面,产前治疗:母体应用激素减轻胎儿水肿、分流穿刺术针对大囊腔和胸腔积液、胎儿外科手术等治疗方式,需要高超的医疗技术和更多数据支持[12]。出生后手术切除仍是CCAM的首选治疗方式;手术时机可在确诊后尽快进行手术治疗,无症状者可在2~6月龄进行手术,综合考虑并发症及手术安全性问题。手术方式可选择传统开胸手术或胸腔镜手术,胸腔镜下肺叶切除已非常成熟,是目前推荐的手术方式,对术者胸腔镜技术要求很高,同时一些粘连严重的病变仍推荐开胸手术。肺叶切除是首选的切除范围,尤其对于新生儿;对于病变小、累及多个肺叶者,可选择肺段切除,尽可能保留正常肺组织[25,26]。
本研究4例患儿均行开胸手术,3例患儿病变肺叶切除,1例患儿保留了左肺下叶上段,在开胸手术中对病变部位及正常肺组织的对比观察更为清晰,可能更利于判断正常肺组织。4例患儿术后均恢复良好,肺功能基本正常。
CCAM病因及发病机制尚不能完全明确,反复发作的呼吸道感染应注意警惕该病,CT检查为主要的检查及鉴别手段,手术是首选的治疗方式,术后病理能进一步明确诊断及分型。产前诊断及微创外科技术不断发展,提高了CCAM检出率及患儿生存率。
所有作者均声明不存在利益冲突



























