
甲状腺激素抵抗综合征(syndrome of resistance to thyroid hormone, RTH)是一种罕见的遗传性甲状腺疾病。RTH临床表现及实验室检查异质性大,易被误诊甚至误治。本文通过对本院1例反复诊治长达6年的垂体型RTH患者相关临床资料进行回顾并汇总该病最新进展,以提高临床医生对RTH的认识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺激素抵抗综合征(syndrome of resistance to thyroid hormone, RTH)又称甲状腺激素不敏感综合征(thyroid hormone insensitivity syndrome, THIS),是由于患者甲状腺激素受体基因突变导致其结构及功能异常,致使甲状腺激素(thyroid hormone, TH)作用障碍,组织器官对TH敏感性降低,而产生以血清游离T3(FT3)和(或)游离T4(FT4)升高、促甲状腺激素(thyroid stimulating hormone,TSH)水平正常或升高为特征的一种临床综合征[1]。本病是罕见的常染色体显性或隐形遗传疾病,以家族性发病多见,但也有个别为散发病例。其发病过程涉及甲状腺激素的作用、转运以及代谢缺陷等多个方面[2]。因此,RTH临床表现异质性大,常被误诊为常见的甲状腺疾病而给予不恰当治疗。近期本科收治1例RTH患者,从起病到确诊历时6年余,反复尝试多种治疗方法,过程波折,现分析如下。
患者女性,23岁,因"反复多食、易饥、易怒伴颈前肿大6年余"于2019年3月入院。
患者6年前(2012年11月)无明显诱因下出现多食、易饥、易怒,起病时伴心悸、手抖及颈部肿大。至当地医院查甲状腺Ⅱ度肿大,心率100次/min,体重42 kg,甲状腺功能检测结果显示FT3 11.8 pmol/L(正常参考值3.5~6.5 pmol/L,下同),FT4 51.07 pmol/L(11.5~22.7),TSH在正常范围(未见化验单);遂诊断为"Graves病",并予丙基硫氧嘧啶(PTU)100 mg tid、普萘洛尔10 mg tid治疗后,患者症状可稍缓解。半个月后患者症状再次加重,先后2次查甲状腺功能:FT3 10.35 pmol/L、FT4 30.66 pmol/L、TSH 4.075 mIU/L(0.550~4.780);FT3 10.50 pmol/L、FT4 29.57 pmol/L、TSH 5.816 mIU/L,甲状腺过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TGAb)、促甲状腺素受体抗体(TRAb)未见异常。甲状腺彩超:甲状腺增大,其内回声及血流改变,考虑甲状腺功能亢进;甲状腺左侧叶10 mm×7 mm低回声团块,右侧叶10 mm×6 mm混合性声块,性质待定,考虑结节性甲状腺肿可能性大。垂体MR平扫+增强未见明显异常。后行甲状腺穿刺,结果提示"毒性甲状腺肿"。予以甲疏咪唑(赛治)15~30 mg qd口服,经治疗后患者症状无缓解。
2013年起患者自觉颈部较前明显肿大,伴易饥、多食、心悸、多汗。后因症状无法缓解,2013至2014年反复多次就诊于不同医院。期间查甲状腺功能波动于:FT3 9~11 pmol/L,FT4 25~35 pmol/L,TSH 4~47 mIU/L,先后被诊断为"甲状腺毒症、甲状腺功能亢进症(甲亢)、选择性垂体甲状腺激素不敏感综合征,结节性甲状腺肿"。曾反复多次予以比索洛尔(1.25~5 mg qd,18个月)、泼尼松(5 mg qd,2周)、地塞米松(0.75 mg qd,1个月)、左甲状腺素(优甲乐50 μg qd,4个月)、甲状腺素片(40 mg qd,1个月)及溴隐亭(2.5 mg qd,2个月)等多种药物治疗,自诉心悸可缓解,但仍反复出现多食、易饥,且颈前肿物无明显缩小。经治疗后甲状腺功能波动于:FT3 9.54~17.05 pmol/L、FT4 34.99~45.75 pmol/L,TSH 1.634~7.308 mIU/L。
因症状反复,2015年至甲状腺外科就诊,诊断为"甲状腺功能亢进、甲状腺结节",遂行"甲状腺次全切除术",术后病理提示"弥漫性毒性甲状腺肿"(图1)。经手术治疗后患者多食、易饥、易怒症状较前明显缓解,但出现乏力,无畏寒、纳差、少汗,多次复查甲状腺功能,FT3波动于4.07~7.12 pmol/L、FT4波动于12.35~17.41 pmol/L, TSH>150 mIU/L,考虑患者"原发性甲状腺功能减退",服用优甲乐50 μg qd后,自觉乏力较前减轻。


注:A和B:左侧甲状腺组织2块,8 cm×4 cm×3 cm,切面灰红色,实性,质软,润泽;C:右侧甲状腺组织1块,7 cm×5 cm×4 cm,切面淡红色,实性,质软,润泽;病理诊断:标本符合弥漫性毒性甲状腺肿
2016年4月患者再次出现心悸、手抖、多汗伴月经紊乱。在当地医院查甲状腺功能:FT3 7.12 pmol/L,FT4 32.04 pmol/L,TSH>150 mIU/L;垂体MR平扫+增强提示"垂体左侧微腺瘤可能(4 mm×3 mm)",诊断为"中枢性甲亢、TSH微腺瘤待排"。当地考虑患者症状较轻,未行垂体手术治疗,予停用优甲乐,并改服溴隐亭2.5 mg qd,此后月经规律,但心悸等症状无明显改变。后每年复查垂体MR平扫+增强无变化。2018年4月起自觉颈前肿大,伴心悸、易怒。查甲状腺功能:FT3 6.76 pmol/L,FT4 21.38 pmol/L,TSH>150 mIU/L;甲状腺彩超:残余甲状腺两侧叶弥漫性病变(甲状腺左侧叶多发囊性结节,最大17.5 mm×9.8 mm,内见胶质,未见钙化),后自行停用溴隐亭。
2019年2月复查甲状腺功能:FT3 6.78 pmol/L,FT4 22.59 pmol/L,TSH>150 mIU/L;甲状腺彩超:残余甲状腺左侧叶混合回声结节54 mm×33 mm×21 mm,考虑结节性甲状腺肿(ACR-TIRADs 2类)。故就诊于本院,门诊拟"促甲状腺激素不恰当分泌综合征"收住入院。既往史无特殊,儿童期食欲正常,无喂养困难或暴食,生长、智力发育与同龄儿童相同,学习成绩中等。未婚,自然流产1次。否认头颈部放射线接触史。父母体健,无甲状腺疾病病史。否认家族中有类似疾病病史。入院体格检查:脉搏69次/min,血压107/69 mmHg(1 mmHg=0.133 kPa),体重38 kg,身高151 cm,BMI 16.7 kg/m2;体形消瘦,眼征阴性;颈部可见手术瘢痕,甲状腺左侧叶Ⅱ度肿大,质韧,无压痛,甲状腺右侧叶未触及,未闻及血管杂音,颈部淋巴结未触及肿大;心率69次/min,律齐,无杂音;肺部、腹部查体无特殊;无胫前黏液性水肿。
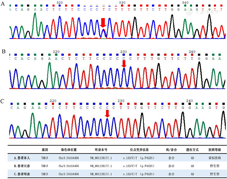
入院后予完善相关检查。血常规、尿常规、粪常规、生化、血脂未见明显异常。甲状腺功能:FT3 5.21 pmol/L,FT4 18.26 pmol/L,TSH>150.000 mU/L。TRAb 0.30 U/L(0.00~1.75),降钙素<2.00 pg/mL(0.0~11.5)。皮质醇节律、生长激素、胰岛素样生长因子Ⅰ、胰岛素样生长因子结合蛋白3、性激素、催乳素等均正常范围。甲状腺彩超:甲状腺术后,残余甲状腺两侧叶弥漫性病变、多发混合性及囊性结节(ACR-TIRADs 1~2类)。垂体MR平扫+动态增强考虑未除外微腺瘤可能,建议结合临皮下注射,q8h共3次,于0、2、4、6、8、24 h分别抽血查甲状腺功能)结果提示,该患者2~24 h的TSH抑制率为52.0%~66.9%(按TSH 150 mIU/L计算,表1)。综合分析患者病史及检查,考虑患者垂体型甲状腺激素抵抗综合征与垂体TSH瘤相鉴别。后送外周血行甲状腺激素受体(THR)β(1-10号外显子)基因检测,结果呈阳性,考虑受检者携带致病的THRβ基因变异位点,明确其RTH诊断;再次完善其父母甲状腺功能及THRβ基因检测,结果显示患者父母甲状腺功能处于正常范围,基因检测结果未见异常(图3)。


患者生长抑素试验结果
患者生长抑素试验结果
| 时间 | FT3(pmol/L) | FT4(pmol/L) | TSH(mIU/L) | TSH抑制率(%) |
|---|---|---|---|---|
| 0 h | 5.81 | 25.07 | >150.000 | 0 |
| 2 h | 6.14 | 21.52 | 65.363 | 56.4 |
| 4 h | 5.75 | 20.74 | 49.552 | 66.9 |
| 6 h | 6.18 | 20.64 | 57.063 | 61.9 |
| 8 h | 6.75 | 22.78 | 71.972 | 52.0 |
| 24 h | 7.49 | 24.12 | 68.489 | 54.3 |
注:甲状腺功能正常参考值:FT3 3.5~6.5 pmol/L,FT4 11.5~22.7 pmol/L,TSH 0.550~4.780 mIU/L;TSH基础值按150 mIU/L计算


注:A和B:腺垂体形态较饱满,向上膨隆(上下径约7.8 mm);垂体后叶T1WI高信号存在;C和D:动态增强扫描垂体强化稍欠均匀,垂体下份稍偏左侧见一可疑低强化结节(直径约2.0 mm);垂体柄下段稍向左侧偏斜
RTH为罕见的遗传性疾病,大约每40 000~50 000名新生儿中有1例RTH患者,但其确切发病率尚不清楚[3,4]。该病约80%为家族性发病,但仍有近20%呈散发性病例[5]。RTH首先由Refetoff等[6]于1967年报道,但直至1988年Usala等[7]才首次证实RTH与THRβ突变相关。迄今为止,已经报道了176种可能的THRβ基因突变[8]。THRβ基因的杂合致病突变是RTH最常见的病因,在超过80% RTH患者中可以检测到有意义的THRβ基因突变[9]。
TH可作用于全身多个器官,但不同靶器官对TH的依赖及敏感性不同。THR是人体TH的主要受体,可分为THRα和THRβ两种亚型。最新的分类标准依据突变受体亚型的不同将该综合征命名为THRβ基因突变致RTH(RTHβ)和THRα基因突变致RTH(RTHα)[8]。由于基因突变的多样性以及靶器官THR对TH抵抗严重程度的不同,RTH患者间的临床表现异质性极大,可由无任何症状直至呈现典型甲亢或甲状腺功能减退(甲减)表现。此外,在具有相同变异的同家族不同成员间,甚至同一例患者的不同病程中均可能出现截然不同的临床表现。据统计,RTH患者的临床表现主要为:甲状腺肿(66%~95%),心动过速(33%~75%),情感障碍(60%),注意力不集中/过度兴奋(40%~60%),低体重(33%)和骨龄延迟(29%~47%)[10]。
根据临床表现和实验室检查评估不同组织对甲状腺激素的抵抗程度,临床更倾向于将RTH分为3种类型[11]:全身抵抗型(generalized resistance to thyroid hormone, GRTH)、选择性垂体抵抗型(pituitary resistance to thyroid hormone, PRTH)、选择性外周抵抗型(peripheral resistance to thyroid hormone, PerRTH)。各型特点见表2。

RTH 3种类型的鉴别要点
RTH 3种类型的鉴别要点
| 分型 | GRTH | PRTH | PerRTH |
|---|---|---|---|
| 发病率 | 最常见 | 不常见 | 极罕见 |
| 特点 | 垂体和外周组织均对TH不敏感,TH代偿性增高 | 仅垂体对TH不敏感,TSH过度分泌,TH合成增加;而外周组织对TH反应正常 | 仅表现外周组织对TH不敏感,垂体TSH细胞对TH的反应正常 |
| 临床表现 | 大多数无临床表现,少部分表现为甲减 | 轻度或中度甲亢,但无突眼、胫前黏液性水肿 | 多表现为甲减 |
| 甲状腺功能 | 血TH升高、TSH正常或升高 | 血TH升高、TSH正常或升高 | 血TH升高、TSH正常或升高 |
| 治疗方法 | 通常不需要治疗,出现甲减表现可予补充甲状腺激素 | 对症治疗为主,三碘甲腺乙酸(THRIAC)可能有效,不推荐使用抗甲状腺药物 | 补充甲状腺激素 |
注:GRTH:全身甲状腺激素抵抗型;PRTH:选择性垂体甲状腺激素抵抗型;PerRTH:选择性外周甲状腺激素抵抗型;TH:甲状腺激素
RTH患者临床表现复杂,加之非专科医生对该病认识不足,在诊治过程中极易出现误诊和漏诊。对于儿童及青少年患者如不能正确诊断,可能会造成不可逆的严重后果。临床对于下列患者应考虑必要时完善THRβ基因检查,排除有无RTH。(1)甲状腺肿大,无甲状腺功能异常表现,血TH多次明显升高者;(2)甲状腺肿大,临床表现为甲减但血TH升高者;(3)甲状腺肿大,临床表现为甲亢,血TH与TSH水平同时升高且排除垂体占位者;(4)甲减患者即使使用较大剂量甲状腺素但临床疗效不明显者;(5)甲亢患者采用多种治疗方法但仍症状反复者;(6)一级亲属中罹患RTH者[12]。
垂体TSH瘤患者与RTH患者有类似的临床及生化表现,在临床工作中尤其需要对二者进行鉴别诊断。基因诊断是目前确诊RTH最直接的方法,但依据目前检测技术,仍可能有部分RTH患者无法明确具体基因突变位点。该类RTH患者与垂体影像学阴性的TSH瘤患者在鉴别诊断中存在较大难度,临床需要结合其他功能试验,如促甲状腺激素释放激素(thyrotropin-releasing hormone,TRH)刺激试验、L-T3抑制试验、生长抑素试验等综合判断。但TRH和L-T3在国内不易获得,因此限制了TRH刺激试验和L-T3抑制试验在临床上的应用。生长抑素试验是国内常用的用于鉴别RTH与垂体TSH瘤的功能试验。目前,生长抑素试验多用生长抑素类似物奥曲肽来完成。一般认为,TSH瘤患者血清TSH能相对较好地被生长抑素抑制,RTH患者则对生长抑素反应低下。然而,在临床实际应用中,生长激素抑制试验的判定切点尚未统一,不同医院的抑制率报道存在大范围的重叠。上海瑞金医院报道,其TSH抑制率在RTH和TSH瘤患者分别为52.33%和77.02%[13]。中国人民解放军总医院、上海华山医院报告TSH瘤的TSH抑制率分别波动于37.4%~91.8%及46.5%~94.1%[14]。Teramoto等[15]研究发现,在14例垂体TSH瘤患者中,10例患者的TSH抑制率>50%,但仍有4例患者TSH分泌未受明显抑制。在临床上还应注意,RTH可同时合并垂体TSH瘤,TSH瘤的发生可能与垂体组织THRβ体细胞突变有关[16,17]。
目前对RTH的治疗尚无根治性方法,治疗主要目的在于改善患者症状而不是恢复正常TH水平。事实上,大多数RTH患者并无临床表现,其血清TH和TSH的升高可能是机体维持正常代谢的主动调节过程。在高水平TH的代偿作用下,患者可以正常生长发育,临床仅表现为轻度的甲状腺肿大,故对该类患者可予密切观察,暂不采取具体治疗措施。有文献报道,RTH患者应用抗甲状腺药物后,在TH水平下降的同时,部分患者出现明显甲状腺功能减退表现,对于儿童RTH患者,甚至导致生长发育迟缓[18]。因此,在临床工作中,应注意避免采用单纯以降低血清TH水平为目的的治疗措施。对于临床表现为甲状腺功能减退的RTH患者,目前主张可予以甲状腺激素治疗,使机体尽可能达到正常的代谢状态。对于明显心悸、多汗等甲亢表现的患者,β受体阻滞剂对症治疗有助于RTH患者症状缓解。三碘甲腺乙酸(THRIAC)是T4的代谢产物,与THRβ的亲和力高于T3,且降解快,可降低TSH及TH水平,减轻甲状腺肿大,在临床应用中有一定疗效。其他药物如糖皮质激素、多巴胺激动剂等的疗效有待观察。随着诊疗技术的发展,基因治疗可能是RTH较有前景的治疗方法之一。
回顾文中RTH病例,该患者为青年女性,青少年期反复出现甲状腺毒症症状,生化结果提示FT3、FT4升高且TSH不被抑制,垂体MRI检查未发现明确占位性病变,故临床考虑诊断为RTH(垂体型),最终通过基因检测确诊。然而,患者父母基因检测未见相关突变位点,考虑该患者为散发病例。在确定患者为其父母生育后,其发病有以下2种可能:(1)生殖细胞嵌合体:父母双方其中一方生殖细胞中部分细胞发生突变,携带该变异位点的细胞占据部分比例,并经减数分裂及受精后遗传给子代;(2)新发变异:父母双方其中一方生殖细胞中,偶发单个生殖细胞在减数分裂过程中发生变异,并经过受精后遗传给子代。综合分析该患者近6年的诊治过程,可发现其曾被诊断为各种常见甲状腺疾病,并接受过除131I外几乎所有甲状腺疾病的治疗方法。例如被诊断为Graves病并接受抗甲状腺药物治疗,也曾被拟诊为RTH并间断应用优甲乐、甲状腺素片、地塞米松片、溴隐亭治疗;治疗期间,患者症状反复,甲状腺功能始终未恢复正常。后患者行甲状腺双侧叶次全切除,尽管术后甲状腺毒症症状短时间内有缓解,但TSH水平进行性升高,TH分泌代偿性增加,甲状腺再次肿大并出现甲状腺功能亢进相关症状。本次住院期间,结合患者病程,首先完善基因检测以明确RTH诊断。结合其临床表现,考虑患者甲状腺毒症不明显,暂未给予相关药物缓解症状并建议其随访观察。出院3个月后,患者因颈部肿物影响美观至外科就诊,术前甲状腺功能示FT3 7.5 pmol/L,FT4 26.04 pmol/L,TSH 132.90 mU/L;行甲状腺肿物细针穿刺活检术提示良性结节(图4),后局麻下行甲状腺左侧叶肿物微波消融术。术后无明显不适,目前仍持续门诊随访。
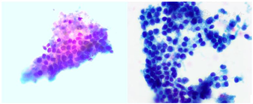

注:涂片见大量滤泡上皮细胞,符合良性结节
RTH属于内分泌罕见病,表现复杂多样,临床发现FT3、FT4升高而TSH不被抑制时应考虑本病的可能。诊断主要是排除检验误差、详细询问家族史、完善RTH相关基因检查鉴别垂体TSH瘤。仔细分析患者临床症状与实验室检查的关系可避免RTH的漏诊、误诊。RTH目前尚无特效的治疗方法,多以对症治疗为主,抗甲状腺药物、131I、手术等通常不作为首选治疗手段。
所有作者均声明不存在利益冲突



























