
观察并分析脱氧胆酸在诱导小鼠肠炎过程中对肠道菌群及胆汁酸代谢的影响。
将20只C57BL/6J小鼠随机均分为脱氧胆酸组和对照组,脱氧胆酸组小鼠给予含0.2%脱氧胆酸饲料,对照组给予常规饲料,连续喂养24周。采用HE染色观察肠道组织炎症程度并作评分,采用焦磷酸测序法分析肠道菌群变化,超高效液相色谱-串联质谱联用技术(HPLC-MS)定量分析小鼠粪便中各级胆汁酸的含量,实时荧光定量PCR检测胆汁酸相关基因的转录情况。
脱氧胆酸组回肠末端和结肠病理组织学炎症评分显著高于对照组(均P<0.05)。与对照组相比,脱氧胆酸组粪便菌群多样性明显降低,厚壁菌门比例下降,梭菌属ⅩⅠⅤa比例显著下降(均P<0.05)。脱氧胆酸组小鼠粪便中总胆汁酸、次级胆汁酸、非结合胆汁酸、牛磺-α-鼠胆酸浓度显著高于对照组(均P<0.05)。与对照组相比,脱氧胆酸组胆汁酸转运基因有机溶质转运蛋白β(Ost-β)、胆汁酸信号分子法尼醇受体(FXR)、成纤维细胞生长因子15(FGF15)表达均明显减少(均P<0.05),而肝脏胆汁酸合成限速酶基因Cyp7a1、Cyp7b1和Cyp27a1表达明显增加(均P<0.05)。
脱氧胆酸能诱导小鼠肠炎发生发展,可能与其破坏肠道菌群平衡以及通过FXR-FGF15信号通路促进肝脏胆汁酸合成有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)发病率逐年上升,与我国饮食西方化密切相关[1],病因不明。肠道菌群被认为是机体的特殊功能"器官",易受饮食等环境影响。越来越多的证据表明肠道菌群失衡可促进IBD发生发展,但机制尚不明确[2]。研究显示,高脂饮食可引起机体肠道次级胆汁酸高水平聚集,其中包括脱氧胆酸(deoxycholic acid,DCA),而脱氧胆酸具有细胞毒性,可促进炎性相关肠癌发生[3]。Bernstein等[4]曾将脱氧胆酸作用于小鼠,发现脱氧胆酸可致肠炎发生,是一种理想的模拟人类IBD疾病发生的动物模型。本研究观察分析脱氧胆酸在诱导小鼠肠炎过程中对肠道菌群及胆汁酸代谢的影响。
4周龄SPF级C57BL/6J雄性小鼠20只,体质量为16 ~ 18 g,购于中国科学院上海实验动物中心,动物使用许可证号:SYXK(浙)2017-0006,在25℃恒温、恒湿、12 h光照与12 h黑暗交替的环境下饲养,可自由饮水和进食。实验前在同一环境中至少饲养7 d。将小鼠随机分为对照组和脱氧胆酸组,每组10只。
苏木精、伊红染色液(上海碧云天生物技术有限公司),Ultrapure RNA Kit试剂、EasyQuick RT MasterMix(北京康为世纪生物科技有限公司),实时荧光定量聚合酶链反应(qRT-PCR)引物设计(杭州擎科生物技术有限公司),脱氧胆酸试剂(无锡帆泊生物技术有限公司)。YS-100光学显微镜、显微镜及显像照相系统(日本Nikon公司),低温离心机(美国Thermo Electron公司),液相质谱联用仪(型号:ACQUITYUPLC-XevoTQ-S,美国Waters公司),428Mill-Q超纯水系统(美国Millipore公司),焦磷酸测序特异性引物设计、高通量焦磷酸测序平台(上海锐翌生物医药科技有限公司),AxyPrep DNA凝胶回收试剂盒(美国AXYGEN公司),Illumina Miseq PE250测序仪(美国Illumina公司),ACQUITY UPLC色谱柱(技术类型:BEH,键合相类型:C18,色谱柱内径2.1 mm、长度100 mm,适用粒径1.6 μm,美国Waters公司)。
脱氧胆酸组喂养饲料中含0.2%脱氧胆酸(常规饲料中按质量分数0.2%的比例添加脱氧胆酸,由无锡帆泊生物技术有限公司制作)。对照组小鼠喂养常规饲料。
喂养24周时,收集小鼠粪便,储存在-20℃的异丙醇中,以备检测。在24周后颈椎脱臼处死小鼠,取出肝脏以及回盲部以上约10 cm肠管作为回肠末端和整段结直肠,冲洗干净。部分肠组织沿肠道横轴卷起,用针固定置于10%中性甲醛溶液中,其余组织于-80℃保存。
每天观察小鼠血便情况,每周称体质量1次。
将小鼠回肠末端和结肠组织放置于4%甲醛中固定,24 h后经脱水、石蜡包埋制成组织石蜡切片后进行HE染色,在光学显微镜下观察肠道炎症情况并进行评分。参考文献[5],病理组织学炎症程度评分包括炎症细胞浸润(0 ~ 3分)和组织损伤(0 ~ 3分)两部分。对于炎症细胞浸润,固有层中炎症细胞数量增加为1分,炎症细胞扩展到黏膜下层为2分,炎症细胞通过黏膜层为3分;对于组织损伤,淋巴上皮病变为1分,局部黏膜浸润为2分,广泛的黏膜损伤或肠壁较深的结构受损则为3分;组织学评分总分最高为6分。
利用Thermo NanoDrop 2000紫外微量分光光度计和1%琼脂糖凝胶电泳对小鼠粪便样本中总DNA进行质检。使用通用引物341F(5’-CCTACGGGRSGCA GCAG-3’)和806R(5’-GGACTACVVGGGTATCTAA TC-3’)扩增细菌16S rDNA基因的V3-V4区。在通用引物的5’端加上合适的index序列和接头序列。以稀释后的基因组DNA为模板进行PCR,反应体系:2×Mix 15 μl,2种通用引物(10 μmol)各为1 μl,模板DNA为50 ng,加双蒸水至30 μl。反应条件是95℃预变性3 min,98℃变性20 s,58℃退火15 s,72℃延伸20 s,执行30个循环,最后72℃维持5 min。采用2%琼脂糖凝胶电泳检测PCR产物,并切胶回收。文库质检合格后,使用Qubit 2.0荧光计行文库定量,并根据每个样品的数据量要求,进行相应比例的混合。使用Illumina Miseq PE250测序仪进行双末端测序,通过重叠关系进行拼接,获得高变区的长reads,即测序平台产生的序列。将序列完全一样的reads根据其丰度大小进行排序。使用UPARSE软件(http://drive5.com/uparse/),根据97%相似度进行操作分类单元(operational taxonomic units,OTU)聚类,并使用Userach(版本7.0)鉴定和移除嵌合体序列。每个OTU都有一个代表性的序列,使用RDP数据库,置信度阈值设置为0.8,利用RDP Classifer(http://rdp.cme.msu.edu/)将每个代表性序列进行物种注释。不同样本对应的reads数量差距较大,为避免因样品数据不同而造成分析时的偏差,在样品达到足够测序深度的情况下,对每个样品进行随机抽平处理。测序深度用Alpha多样性指数来衡量。Alpha多样性反映的是单个样品内部的物种多样性,包括Chao值、Simpson值和Shannon值。样本提取、建库、测序、分析服务由上海锐翌生物科技有限公司完成。
比较喂养24周时对照组和脱氧胆酸组小鼠粪便的细菌丰度指数Chao值与多样性指数Simpson值和Shannon值。Chao值越大,菌群丰度越高;Simpson值和Shannon值越大,菌群多样性越高。根据2组小鼠肠道菌群群落结构组成,参考文献[6],利用群落热点图颜色梯度的变化对2组小鼠重要菌属的比例变化进行分析比较。
采用超高效液相色谱-串联质谱联用技术(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS)定量分析小鼠粪便中各种胆汁酸的含量[7]。本组检测指标包括总胆汁酸、初级胆汁酸、次级胆汁酸、非结合胆汁酸、胆酸、石胆酸、熊去氧胆酸、鹅去氧胆酸、牛磺-α-鼠胆酸(tauro-α-muricholic acid,T-α-MCA)、牛磺-β-鼠胆酸(tauro-β-muricholic acid,T-β-MCA)、牛磺-ω-鼠胆酸(tauro-ω-muricholic acid,T-ω-MCA)。
采用胆汁酸标准品,采用10个具有代表性的同位素胆汁酸作为内标校正。准确称取标准品和同位素标记物的质量,用甲醇制备成5.0 mmol/L浓度。在无胆汁酸的血清基质中混合标准品并设置1、2.5、10、50、250、500、2500 nmol/L等浓度。称取10 mg粪便样品于离心管中,加入大约25 mg珠子和20 μl超纯水,使用均质器混匀。将样品与包含内标的200 μl乙腈/甲醇(8∶2)溶剂进行均质混合,之后以离心半径8.2 cm、13 500 r/min、4℃离心20 min去除蛋白质。离心后,将上清液转移到96孔板上,使用冻干机进行冻干。分别将冻干后样品和标准品与BAPUltra试剂、乙腈/甲醇(8∶2)、超纯水重新混合,然后在离心机中13 500 r/min、4℃离心20 min(离心半径8.2 cm)。将上清转移到96孔板上进行HPLC-MS定量分析。色谱条件:ACQUITY UPLC色谱柱,进样量5 μl,柱温30 ℃,流动相A为甲酸(pH=3.25),流动相B为乙腈/甲醇(8∶2),流速0.4 ml/min。梯度洗脱程序如下:0 ~ 1 min,5%B;1 ~ 3 min,5% ~ 30%B;3 ~ 15 min,30% ~ 100%B;15 ~ 16 min,100% ~ 5%B;16 ~ 17 min,5%B。MS条件:电喷雾电离源,负离子电离模式;源温度150℃,脱溶剂温度550℃,脱溶剂气流速1000 L/h。
PCR 10 μl反应体系(Taq-mix 5 μl,上下引物各0.2 μl,模板DNA 0.6 μl,双蒸水4 μl),采用qPCR检测肝脏中小异二聚体伴侣受体(small heterodimer partner,Shp)基因和胆汁酸合成相关限速酶基因如胆固醇羟化酶亚型Cyp7a1、Cyp7b1、Cyp8b1、Cyp27a1以及回肠上有机溶质转运蛋白α(organic solute transporter α,Ost-α)、有机溶质转运蛋白β(organic solute transporter β,Ost-β)、顶端钠依赖胆汁酸转运蛋白(apical sodium-dependent bile acid transporter,Asbt)、法尼醇受体(farnesoid X receptor,FXR)、成纤维细胞生长因子15(fibroblast growth factor 15,FGF15)基因的转录情况。使用Ultrapure RNA Kit试剂提取组织总RNA,检测RNA浓度。使用EasyQuick RT MasterMix,采用两步法反转录生成cDNA。PCR反应条件为95℃预变性2 min,95℃变性15 s,59.2 ~ 60.8℃退火30 s,72℃延伸20 s,循环45次。内参基因选用β-actin,采用2-ΔΔCt法计算该基因的相对表达水平。各引物序列见表1。

引物序列
引物序列
| 基因 | 引物序列 | 产物长度(bp) |
|---|---|---|
| Shp | 上游5’-AGATCCTGCTAGAGGAAGCCA-3’,下游5’-CCTGGCACATCTGGGTTGAA-3’ | 184 |
| Cyp7a1 | 上游5’-GCAAAACCTCCAATCTGTCATG-3’,下游5’-TCAAACATCACTCGGTAGCAG-3’ | 105 |
| Cyp7b1 | 上游5’-GGACTCGGAACAAGCAAATG-3’,下游5’-CCGACTGTGATTTAGCCCTATAG-3’ | 132 |
| Cyp8b1 | 上游5’-TCCTCAGGGTGGTACAGGAG-3’,下游5’-CGGGTTGAGGAACCGATCAT-3’ | 167 |
| Cyp27a1 | 上游5’-GTGGACAACCTCCTTTGGGA-3’,下游5’-TTGCTCTCCTTGTGCGATGAA-3’ | 175 |
| Ost-α | 上游5’-AGGCAGGACTCATATCAAACTTG-3’,下游5’-TGAGGGCTATGTCCACTGGG-3’ | 152 |
| Ost-β | 上游5’-AGATGCGGCTCCTTGGAATTA-3’,下游5’-TGGCTGCTTCTTTCGATTTCTG-3’ | 115 |
| Asbt | 上游5’-GTCTGTCCCCCAAATGCAACT-3’,下游5'-CACCCCATAGAAAACATCACCA-3’ | 137 |
| FXR | 上游5’-GCTTGATGTGCTACAAAAGCTG-3’,下游5’-CGTGGTGATGGTTGAATGTCC-3’ | 110 |
| FGF15 | 上游5’-TGTACTCCGCTGGTCCCTAT-3’,下游5’-AGCCCGTATATCTTGCCGTC-3’ | 193 |
| β-actin | 上游5’-GTGACGTTGACATCCGTAAAGA-3’,下游5’-GCCGGACTCATCGTACTCC-3’ | 245 |
注:Shp为小异二聚体伴侣受体;Cyp7a1、Cyp7b1、Cyp8b1、Cyp27a1均为胆固醇羟化酶亚型;Ost-α为有机溶质转运蛋白α;Ost-β为有机溶质转运蛋白β;Asbt为顶端钠依赖胆汁酸转运蛋白;FXR为法尼醇受体;FGF15为成纤维细胞生长因子15;β-actin为内参
采用SPSS 24.0统计软件以及Graphpad Prism 8作图软件进行统计学分析。定量资料若正态分布,以(Mean ±SD)表示,采用独立样本t检验对组间差异进行分析;若偏态分布,以[M(P25,P75)]表示,组间差异比较采用Mann-Whitney检验。以P<0.05为差异具有统计学意义。
对照组和脱氧胆酸组小鼠均没有出现血便。脱氧胆酸组和对照组小鼠在喂养2周的平均体质量差异无统计学意义[(18.2 ± 1.5) g比(17.9 ± 1.2) g,P = 0.76],在喂养24周的平均体质量差异也无统计学意义[(22.7 ± 2.5) g比(23.1 ± 3.8) g,P = 0.83]。
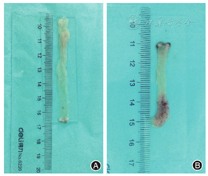
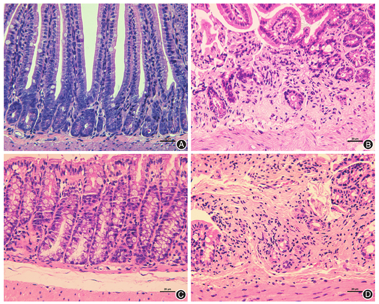
喂养24周时,脱氧胆酸组小鼠结肠长度较对照组小鼠明显缩短[(4.31 ± 0.23)cm比(7.32 ± 0.20) cm,P<0.01],见图1。HE染色显示脱氧胆酸组小鼠回肠末端及结肠黏膜炎症细胞显著增多(图2),且肠道病理组织学炎症评分较对照组明显升高(回肠:3.4 ± 0.8比0.3 ± 0.1,P<0.05;结肠:3.4 ± 1.1比0.4 ± 0.2,P<0.05)。


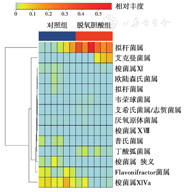
与对照组小鼠相比,脱氧胆酸组喂养24周小鼠的Chao值(186.14 ± 22.96比262.63 ± 12.90)、Simpson值(0.82 ± 0.07比0.94 ± 0.02)、Shannon值(3.92 ± 0.72比5.38 ± 0.50)明显下降(均P<0.01),提示脱氧胆酸组小鼠肠道菌群多样性明显降低。
在菌门水平上,脱氧胆酸组喂养24周小鼠肠道疣微菌门比例较对照组上升(0.05 ± 0.01比0,P<0.05),而厚壁菌门比例下降(0.26 ± 0.10比0.50 ± 0.25,P<0.05),拟杆菌门无明显改变(0.69 ± 0.11比0.47 ± 0.26,P>0.05);在菌属水平上,脱氧胆酸组喂养24周小鼠肠道中拟杆菌属比例较对照组上升(0.320 ± 0.160比0.017 ± 0.003,P<0.05),梭菌属ⅩⅠⅤa比例下降(0.0030± 0.0008比0.0600 ± 0.0020,P<0.05),见图3。

与对照组相比,脱氧胆酸组小鼠粪便中的总胆汁酸、次级胆汁酸和非结合胆汁酸浓度明显增加(均P<0.05),而初级胆汁酸浓度增加不明显(P>0.05);脱氧胆酸组粪便中T-α-MCA的浓度明显升高(P<0.05),但T-ω-MCA、T-β-MCA、石胆酸、熊去氧胆酸、鹅去氧胆酸和胆酸在两组小鼠中差异无统计学意义(均P>0.05)。见表2。
对照组和脱氧胆酸组小鼠各级胆汁酸浓度及相关基因表达
对照组和脱氧胆酸组小鼠各级胆汁酸浓度及相关基因表达
| 项目 | 对照组(n = 10) | 脱氧胆酸组(n = 10) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 胆汁酸浓度(μmol/g) | |||||
| 总胆汁酸(Mean ±SD) | 1255.80 ± 458.90 | 2592.03 ± 747.09 | 0.0093 | <0.01 | |
| 初级胆汁酸(Mean ±SD) | 115.80 ± 96.40 | 124.50 ± 12.04 | 0.9386 | >0.05 | |
| 次级胆汁酸(Mean ±SD) | 835.10 ± 363.20 | 1388.60 ± 247.40 | 0.0226 | <0.05 | |
| 非结合胆汁酸(Mean ±SD) | 921.45 ± 378.00 | 1620.32 ± 365.89 | 0.0094 | <0.01 | |
| T-α-MCA(Mean ±SD) | 910.07 ± 527.44 | 2528.09 ± 948.47 | 0.0103 | <0.05 | |
| T-ω-MCA[M(P25,P75)] | 15 140.63(11 669.98,17 083.00) | 20 822.30(13 533.27,25 378.92) | 0.4049 | >0.05 | |
| T-β-MCA[M(P25,P75)] | 10 765.51(8383.96,14 245.55) | 17 297.69(12 514.38,17 001.60) | 0.1643 | >0.05 | |
| 石胆酸(Mean ±SD) | 66 881.31 ± 19 704.47 | 5044.94 ± 24 136.90 | 0.8750 | >0.05 | |
| 熊去氧胆酸[M(P25,P75)] | 12 514.50(5423.77,11 743.60) | 12 503.02(7631.51,17 550.32) | 0.9987 | >0.05 | |
| 鹅去氧胆酸[M(P25,P75)] | 5629.28(3445.29,8099.24) | 20 179.20(14 122.72,28 432.34) | 0.332 | >0.05 | |
| 胆酸(Mean ±SD) | 5074.77 ± 1259.13 | 8956.18 ± 3710.15 | 0.0576 | >0.05 | |
| 胆汁酸相关基因(Mean ±SD) | |||||
| Ost-α | 1.27 ± 0.28 | 0.88 ± 0.27 | 0.07 | >0.05 | |
| Ost-β | 2.04 ± 0.94 | 0.68 ± 0.11 | 0.031 | <0.05 | |
| Asbt | 5.50 ± 2.22 | 5.48 ± 1.07 | 0.983 | >0.05 | |
| FXR | 1.58 ± 0.19 | 0.73 ± 0.22 | 0.008 | <0.01 | |
| FGF15 | 3.17 ± 1.15 | 1.43 ± 0.18 | 0.001 | <0.01 | |
| Cyp7a1 | 3.42 ± 0.79 | 11.49 ± 5.06 | 0.023 | <0.05 | |
| Cyp7b1 | 0.09 ± 0.03 | 1.01 ± 0.31 | 0.019 | <0.05 | |
| Cyp8b1 | 2.30 ± 0.82 | 3.00 ± 1.04 | 0.435 | >0.05 | |
| Cyp27a1 | 0.85 ± 0.25 | 7.33 ± 3.30 | 0.011 | <0.05 | |
| Shp | 1.20 ± 0.54 | 1.09 ± 0.33 | 0.712 | >0.05 | |
注:T-α-MCA为牛磺-α-鼠胆酸;T-β-MCA为牛磺-β-鼠胆酸;T-ω-MCA为牛磺-ω-鼠胆酸;Ost-α为有机溶质转运蛋白α;Ost-β为有机溶质转运蛋白β;Asbt为顶端钠依赖胆汁酸转运蛋白;FXR为法尼醇受体;FGF15为成纤维细胞生长因子15;Cyp7a1、Cyp7b1、Cyp8b1、Cyp27a1均为胆固醇羟化酶亚型;Shp为小异二聚体伴侣受体
与对照组相比,脱氧胆酸组回肠末端胆汁酸转运基因Ost-β明显减少(P<0.05),但Ost-α和Asbt改变不明显(均P>0.05),胆汁酸信号分子FXR和FGF15基因明显减少(均P<0.01),肝脏胆汁酸合成限速酶基因Cyp7a1、Cyp7b1、Cyp27a1较对照组表达明显增加(均P<0.05),但Cyp8b1和Shp未见明显增加(均P>0.05)。见表2。
我国IBD发病率逐年增高,高脂饮食明显增加IBD的患病风险[1],而IBD患者肠道菌群多样性相对降低,在动物实验中也得到验证[8]。然而在肠炎进展过程中,高脂饮食代谢产物脱氧胆酸影响肠道菌群及体内胆汁酸代谢的机制尚不明确。
研究发现肠上皮细胞反复暴露于高浓度胆汁酸是IBD发病的重要危险因素[9]。而IBD患者肠道内具有较高浓度的脱氧胆酸[10]。既往研究采用0.2%的脱氧胆酸喂养小鼠,建立IBD实验动物模型,发现干预8个月后小鼠结肠黏膜呈弥漫性增厚(约为正常厚度的2倍),固有层中有许多淋巴细胞和中性粒细胞以及较少的浆细胞炎性浸润,穿透至黏膜下层,形态学诊断为中度结肠炎[4]。本实验中对小鼠进行连续6个月脱氧胆酸干预,同样发现回肠及结肠黏膜受损,与既往研究结果基本一致。
研究表明肠腔长期暴露于高胆汁酸水平诱发肠道炎症,主要通过FXR、维生素D受体(vitamin D receptor,VDR)、孕烷X受体(pregnane X receptor,PXR)和胆汁酸G蛋白耦联受体5(the G protein-coupled receptor 5,TGR5)等来实现。在胃肠道中,主要是巨噬细胞调节细胞因子产生,巨噬细胞部分作用被次级胆汁酸与TGR5受体的结合所激活[11],巨噬细胞可以极化变成促炎性M1或抗炎性M2细胞[12]。也有研究表明,结肠固有层巨噬细胞中FXR的激活可抑制促炎性细胞因子,如白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IL-6[13]。因此,抑制FXR的激活导致促炎性细胞因子的活化。脱氧胆酸的去污剂特性会引起肠上皮细胞膜的不稳定,导致蛋白激酶C活化并释放花生四烯酸,而花生四烯酸通过环氧合酶2和脂氧合酶被转化为某些促炎和促血管生成的前列腺素和活性氧。上述过程刺激促炎细胞因子(如IL-6和TNF-α)的产生,从而促进炎症的进展。近来也有研究发现在连续12周喂养0.4%胆酸后,小鼠肠道中出现肠屏障功能受损和IL-6/STAT3相关的低度炎症[14]。因此,胆汁酸与结肠炎症之间密切相关。
本研究显示在脱氧胆酸诱导的肠道炎症发生过程中,肠道菌群多样性明显下降,拟杆菌属比例上升,而厚壁菌门比例下降,梭菌属ⅩⅠⅤa比例下降,表明肠道内高浓度脱氧胆酸可加重肠道菌群失衡现象,提示肠道菌群失衡参与肠炎进展过程。产胆盐水解酶菌包括乳酸菌、双歧杆菌及梭菌属,可以将牛磺鼠胆酸(tauro-muricholic acid,TMCA)转化成MCA,该菌的减少使TMCA积聚增多,而TMCA为FXR强拮抗剂,可抑制体内FXR信号通路[15]。肠道FXR及FGF15信号分子可进一步影响机体胆汁酸代谢。
肠腔内增加的胆汁酸可激活肠道FXR,随后激活小鼠肠上皮细胞内FGF15,FGF15在肝脏内通过激活肝脏FGFR4抑制肝细胞内胆汁酸的合成[12],也可通过FGF受体2/b-Klotho受体复合物促进胆囊内胆汁排空[16]。肝细胞内增加的胆汁酸可以激活肝脏FXR,抑制合成胆汁酸的酶如Cyp7a1等基因的转录,从而抑制胆汁酸合成[12]。本实验表明,脱氧胆酸组小鼠肠道胆汁酸转运基因Ost-β及胆汁酸信号分子FXR和FGF15转录减少,肝脏胆汁酸合成限速酶基因Cyp7a1和Cyp27a1较对照组转录增加。因此,脱氧胆酸诱导小鼠肠炎过程中胆汁酸重吸收增加,通过抑制肠道FXR-FGF15信号通路促进肝脏胆汁酸合成增加,最终导致胆汁酸池容量增加,说明脱氧胆酸导致的肠炎进展中,肠道菌群的紊乱在其中发挥至关重要的作用。
综上所述,脱氧胆酸可促进小鼠肠道菌群失衡,产胆盐水解酶菌的减少可能通过抑制胆汁酸FXR-FGF15信号通路,促进宿主肝脏胆汁酸合成,进而导致肠炎发生和发展。此外,肠道菌群失衡在脱氧胆酸诱导的小鼠肠炎进展过程中的确切作用尚需进一步的研究来揭示。
所有作者均声明不存在利益冲突



























