
探讨人类白细胞抗原(HLA)Ⅰ类(A、B、C)、Ⅱ类(DRB1、DQB1、DPB1)等位基因和单倍体多态性与中国南方汉族急性淋巴细胞白血病(ALL)、急性髓系白血病(AML)以及慢性粒细胞白血病(CML)的相关性。
收集深圳市血液中心845例中国南方汉族白血病患者(323例ALL、350例AML及172例CML)和745名中国南方汉族健康献血者的外周血样本。应用聚合酶链反应反向序列特异性寡核苷酸探针杂交(PCR-rSSO)及测序分型(PCR-SBT)方法对HLA-A、-B、-C、-DRB1、-DQB1和-DPB1进行基因分型,鉴定HLA等位基因前4位数。采用Arlequin 3.5软件分析HLA单倍体;从HLA低分辨水平(等位基因前2位数)及高分辨水平(等位基因前4位数)分别统计分析HLA等位基因和单倍体多态性与3种白血病的相关性。
经Bonferroni校正,ALL组A*02(36.22%比28.26%,χ2=13.41,PC<0.01)及其单倍体A*02-B*46-C*01(15.35%比10.23%,χ2=10.90,PC=0.02)、DRB1*12(15.79%比11.10%,χ2=9.02,PC=0.03)、A*02:03(9.75%比5.32%,χ2=14.25,PC=0.002)及其单倍体A*02:03-B*38:02-C*07:02(3.80%比1.51%,χ2=10.41,PC=0.02)的频率均高于对照组,是ALL易感因素;AML组A*11-B*15-C*08-DRB1*15-DQB1*06-DPB1*02的频率高于对照组(1.34%比0.07%,χ2=12.54,PC=0.003),是AML易感单倍体;CML组A*02(36.63%比28.26%,χ2=9.33,PC=0.02)及其单倍体A*02-B*15-C*04(2.17%比0.29%,χ2=11.74,PC=0.02)、DRB1*03:01-DQB1*02:01-DPB1*02:01(1.86%比0.14%,χ2=13.10,PC=0.01)的频率均高于对照组,是CML易感因素;CML组DRB1*13的频率低于对照组(1.45%比5.25%,χ2=9.29,PC=0.03),是CML拮抗基因。
在HLA低分辨及高分辨水平发现了白血病易感或拮抗HLA等位基因和单倍体,可为探究中国南方汉族白血病发病机制并制订有效治疗策略提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
白血病是一类造血干细胞恶性克隆性疾病,主要包括急性髓系白血病(AML)、慢性粒细胞白血病(CML)、急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)和其他罕见类型。白血病类型及其发病率具有地区、种族、年龄和性别异质性。各种白血病的男性发病率均高于女性;急性白血病中成年人以AML最为常见,而儿童以ALL较为多见;CML发病率随年龄增长逐渐升高[1,2]。国内外有关白血病与人类白细胞抗原(HLA)基因的关联性研究大多局限于HLA-A、-B、-DRB1基因[3,4,5]。HLA具有等位基因高度多态性、单倍体遗传和连锁不平衡的遗传特点。本研究通过对中国南方汉族HLA Ⅰ类(A、B、C)和Ⅱ类基因(DRB1、DQB1、DPB1)进行高分辨基因分型,分别从低分辨水平(等位基因前2位数)和高分辨水平(等位基因前4位数)探讨HLA等位基因和单倍体与3种常见白血病的相关性,以阐明HLA Ⅰ、Ⅱ类基因在中国南方汉族白血病发病机制中的作用。
选择2001年1月至2011年10月深圳市血液中心收集的各医院送检行HLA配型的初发ALL、AML和CML患者的外周血样本,以北纬30°为界,按患者自述籍贯的地理位置,划分为中国南、北方汉族,选出中国南方汉族白血病患者共845例,包括ALL组323例,男性192例,女性131例,中位年龄29岁(18~55岁);AML组350例,男性198例,女性152例,中位年龄33岁(18~57岁);CML组172例,男性125例,女性47例,中位年龄31岁(18~58岁)。健康对照组为深圳市血液中心2012年2月至2014年7月留存的健康献血者外周血样本,随机选择745名中国南方汉族献血者,男性436名,女性309名,中位年龄30岁(18~53岁)。所有受试者采集外周血5 ml,乙二胺四乙酸二钾(EDTA-K2)抗凝,-20 ℃冰箱中保存。本研究获得了深圳市血液中心医学伦理委员会批准(批准文号:SZBC2020R004)。
采用MagCore DNA提取试剂盒(台湾芮宝公司),在MagCore HF16 DNA纯化自动工作站(台湾芮宝公司)提取基因组DNA,严格按试剂盒及工作站说明书操作,调整DNA浓度为50~100 ng/μl。
采用LABType SSO Class Ⅰ A/B/C、Class Ⅱ DRB1/DQB1基因分型试剂盒(美国One Lambda公司),严格按照使用说明书,采用聚合酶链反应反向序列特异性寡核苷酸探针杂交(PCR-rSSO)方法对各样本HLA-A、-B、-C、-DRB1和-DQB1进行基因分型。
采用自主建立的聚合酶链反应测序分型(PCR-SBT)方法[6],对HLA-DPB1基因的第2号外显子进行正、反向双向测序,测序反应产物经ABI 3730测序仪电泳后,将获得的碱基序列导入Assign 4.7分析软件(澳大利亚Conexio Genomics公司),进行碱基错误排查,判定受试者的HLA-DPB1基因型。
出现不确定的基因分型结果时,依据中国人群常见及确定的(CWD)等位基因表排除罕见型等位基因,判断CWD表中等位基因及其基因组合[7]。
采用Arlequin 3.5软件分析A-B-C单倍体、DRB1-DQB1-DPB1单倍体和A-B-C-DRB1-DQB1-DPB1单倍体的类型和频率。采用SPSS 17.0软件进行统计学分析,计数资料比较采用χ2检验,计算OR及95% CI,若P ≤ 0.05,进一步进行Bonferroni校正,PC<0.05为差异有统计学意义。
在HLA低分辨水平,各白血病组与对照组间差异有统计学意义的HLA等位基因见表1,表2,表3。P值经校正后,差异仍有统计学意义的HLA等位基因包括:ALL组A*02和DRB1*12的频率均高于对照组(χ2=13.41,PC<0.01;χ2=9.02,PC=0.03);CML组A*02的频率高于对照组(χ2=9.33,PC=0.02);CML组DRB1*13的频率低于对照组(χ2=9.29,PC=0.03);未发现AML与任何HLA等位基因存在相关性。
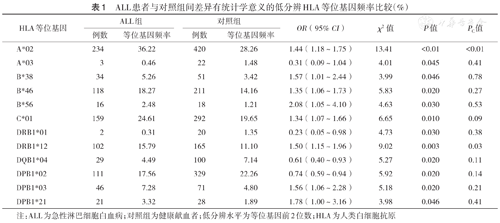
ALL患者与对照组间差异有统计学意义的低分辨HLA等位基因频率比较(%)
ALL患者与对照组间差异有统计学意义的低分辨HLA等位基因频率比较(%)
| HLA等位基因 | ALL组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 等位基因频率 | 例数 | 等位基因频率 | |||||
| A*02 | 234 | 36.22 | 420 | 28.26 | 1.44(1.18~1.75) | 13.41 | <0.01 | <0.01 |
| A*03 | 3 | 0.46 | 22 | 1.48 | 0.31(0.09~1.04) | 4.01 | 0.045 | 0.41 |
| B*38 | 34 | 5.26 | 51 | 3.42 | 1.57(1.01~2.44) | 3.99 | 0.046 | 0.78 |
| B*46 | 118 | 18.27 | 211 | 14.16 | 1.35(1.06~1.73) | 5.83 | 0.020 | 0.27 |
| B*56 | 16 | 2.48 | 18 | 1.21 | 2.08(1.05~4.10) | 4.63 | 0.030 | 0.53 |
| C*01 | 159 | 24.61 | 292 | 19.65 | 1.34(1.07~1.66) | 6.65 | 0.010 | 0.09 |
| DRB1*01 | 2 | 0.31 | 20 | 1.35 | 0.23(0.05~0.98) | 4.73 | 0.030 | 0.38 |
| DRB1*12 | 102 | 15.79 | 165 | 11.10 | 1.50(1.15~1.96) | 9.02 | 0.003 | 0.03 |
| DQB1*04 | 29 | 4.49 | 100 | 7.14 | 0.61(0.40~0.93) | 5.27 | 0.020 | 0.11 |
| DPB1*02 | 111 | 17.56 | 329 | 22.26 | 0.74(0.59~0.94) | 5.92 | 0.020 | 0.14 |
| DPB1*03 | 46 | 7.28 | 71 | 4.80 | 1.56(1.06~2.28) | 5.18 | 0.020 | 0.21 |
| DPB1*21 | 21 | 3.32 | 28 | 1.89 | 1.78(1.00~3.16) | 3.98 | 0.046 | 0.41 |
注:ALL为急性淋巴细胞白血病;对照组为健康献血者;低分辨水平为等位基因前2位数;HLA为人类白细胞抗原
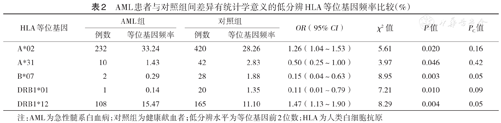
AML患者与对照组间差异有统计学意义的低分辨HLA等位基因频率比较(%)
AML患者与对照组间差异有统计学意义的低分辨HLA等位基因频率比较(%)
| HLA等位基因 | AML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 等位基因频率 | 例数 | 等位基因频率 | |||||
| A*02 | 232 | 33.24 | 420 | 28.26 | 1.26(1.04~1.53) | 5.61 | 0.020 | 0.16 |
| A*31 | 10 | 1.43 | 42 | 2.83 | 0.50(0.25~1.00) | 3.97 | 0.046 | 0.42 |
| B*07 | 2 | 0.29 | 28 | 1.88 | 0.15(0.04~0.63) | 8.95 | 0.003 | 0.05 |
| DRB1*01 | 1 | 0.14 | 20 | 1.35 | 0.11(0.01~0.79) | 7.21 | 0.010 | 0.09 |
| DRB1*12 | 108 | 15.47 | 165 | 11.10 | 1.47(1.13~1.90) | 8.29 | 0.004 | 0.05 |
注:AML为急性髓系白血病;对照组为健康献血者;低分辨水平为等位基因前2位数;HLA为人类白细胞抗原
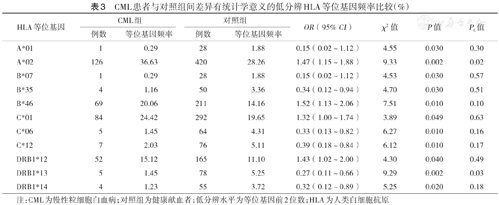
CML患者与对照组间差异有统计学意义的低分辨HLA等位基因频率比较(%)
CML患者与对照组间差异有统计学意义的低分辨HLA等位基因频率比较(%)
| HLA等位基因 | CML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 等位基因频率 | 例数 | 等位基因频率 | |||||
| A*01 | 1 | 0.29 | 28 | 1.88 | 0.15(0.02~1.12) | 4.55 | 0.030 | 0.30 |
| A*02 | 126 | 36.63 | 420 | 28.26 | 1.47(1.15~1.88) | 9.33 | 0.002 | 0.02 |
| B*07 | 1 | 0.29 | 28 | 1.88 | 0.15(0.02~1.12) | 4.53 | 0.030 | 0.57 |
| B*35 | 4 | 1.16 | 50 | 3.36 | 0.34(0.12~0.94) | 4.70 | 0.030 | 0.51 |
| B*46 | 69 | 20.06 | 211 | 14.16 | 1.52(1.13~2.06) | 7.51 | 0.010 | 0.10 |
| C*01 | 84 | 24.42 | 292 | 19.65 | 1.32(1.00~1.74) | 3.89 | 0.049 | 0.63 |
| C*06 | 5 | 1.45 | 64 | 4.31 | 0.33(0.13~0.82) | 6.27 | 0.010 | 0.16 |
| C*12 | 7 | 2.03 | 76 | 5.11 | 0.39(0.18~0.84) | 6.12 | 0.010 | 0.17 |
| DRB1*12 | 52 | 15.12 | 165 | 11.10 | 1.43(1.02~2.00) | 4.30 | 0.040 | 0.49 |
| DRB1*13 | 5 | 1.45 | 78 | 5.25 | 0.27(0.11~0.66) | 9.29 | 0.002 | 0.03 |
| DRB1*14 | 4 | 1.23 | 55 | 3.72 | 0.32(0.12~0.89) | 5.25 | 0.020 | 0.18 |
注:CML为慢性粒细胞白血病;对照组为健康献血者;低分辨水平为等位基因前2位数;HLA为人类白细胞抗原
在HLA低分辨水平,各白血病组与对照组间差异有统计学意义的HLA单倍体见表4,表5,表6。P值经校正后,差异仍有统计学意义的HLA单倍体包括:ALL组A*02-B*46-C*01的频率高于对照组(χ2=10.90,PC=0.02);AML组A*11-B*15-C*08-DRB1*15-DQB1* 06-DPB1*02的频率高于对照组(χ2=12.54,PC=0.003);CML组A*02-B*15-C*04的频率高于对照组(χ2=11.74,PC=0.02)。
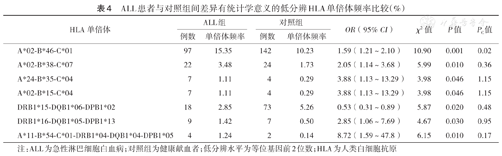
ALL患者与对照组间差异有统计学意义的低分辨HLA单倍体频率比较(%)
ALL患者与对照组间差异有统计学意义的低分辨HLA单倍体频率比较(%)
| HLA单倍体 | ALL组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 单倍体频率 | 例数 | 单倍体频率 | |||||
| A*02-B*46-C*01 | 97 | 15.35 | 142 | 10.23 | 1.59(1.21~2.10) | 10.90 | 0.001 | 0.02 |
| A*02-B*38-C*07 | 22 | 3.48 | 24 | 1.73 | 2.05(1.14~3.68) | 5.99 | 0.010 | 0.36 |
| A*24-B*35-C*04 | 7 | 1.11 | 4 | 0.29 | 3.88(1.13~13.29) | 3.98 | 0.046 | 1.15 |
| A*02-B*15-C*04 | 7 | 1.11 | 4 | 0.29 | 3.88(1.13~13.29) | 3.98 | 0.046 | 1.15 |
| DRB1*15-DQB1*06-DPB1*02 | 18 | 2.85 | 73 | 5.26 | 0.53(0.31~0.89) | 5.87 | 0.020 | 0.48 |
| DRB1*16-DQB1*05-DPB1*13 | 9 | 1.42 | 7 | 0.50 | 2.85(1.06~7.69) | 4.67 | 0.030 | 0.95 |
| A*11-B*54-C*01-DRB1*04-DQB1*04-DPB1*05 | 4 | 1.24 | 2 | 0.14 | 8.72(1.59~47.8) | 6.15 | 0.010 | 0.17 |
注:ALL为急性淋巴细胞白血病;对照组为健康献血者;低分辨水平为等位基因前2位数;HLA为人类白细胞抗原
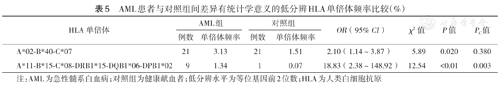
AML患者与对照组间差异有统计学意义的低分辨HLA单倍体频率比较(%)
AML患者与对照组间差异有统计学意义的低分辨HLA单倍体频率比较(%)
| HLA单倍体 | AML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 单倍体频率 | 例数 | 单倍体频率 | |||||
| A*02-B*40-C*07 | 21 | 3.13 | 21 | 1.51 | 2.10(1.14~3.87) | 5.89 | 0.020 | 0.380 |
| A*11-B*15-C*08-DRB1*15-DQB1*06-DPB1*02 | 9 | 1.34 | 1 | 0.07 | 18.83(2.38~148.92) | 12.54 | <0.01 | 0.003 |
注:AML为急性髓系白血病;对照组为健康献血者;低分辨水平为等位基因前2位数;HLA为人类白细胞抗原
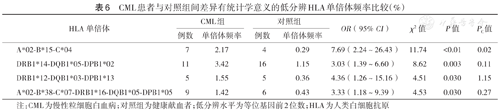
CML患者与对照组间差异有统计学意义的低分辨HLA单倍体频率比较(%)
CML患者与对照组间差异有统计学意义的低分辨HLA单倍体频率比较(%)
| HLA单倍体 | CML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 单倍体频率 | 例数 | 单倍体频率 | |||||
| A*02-B*15-C*04 | 7 | 2.17 | 4 | 0.29 | 7.69(2.24~26.43) | 11.74 | <0.01 | 0.02 |
| DRB1*14-DQB1*05-DPB1*02 | 11 | 3.42 | 16 | 1.15 | 3.03(1.39~6.60) | 8.62 | 0.003 | 0.11 |
| DRB1*12-DQB1*03-DPB1*13 | 5 | 1.55 | 5 | 0.36 | 4.36(1.26~15.16) | 4.51 | 0.030 | 1.15 |
| A*02-B*38-C*07-DRB1*16-DQB1*05-DPB1*05 | 9 | 1.42 | 6 | 0.43 | 3.33(1.18~9.39) | 4.53 | 0.030 | 0.27 |
注:CML为慢性粒细胞白血病;对照组为健康献血者;低分辨水平为等位基因前2位数;HLA为人类白细胞抗原
在HLA高分辨水平,各白血病组与对照组间差异有统计学意义的HLA等位基因见表7,表8,表9。P值经校正后,差异仍有统计学意义的HLA等位基因包括:ALL组A*02:03的频率高于对照组(χ2=14.25,PC<0.01);未发现AML或CML与任何HLA等位基因存在相关性。
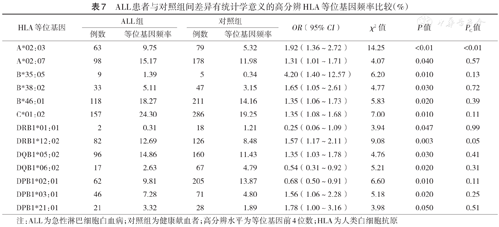
ALL患者与对照组间差异有统计学意义的高分辨HLA等位基因频率比较(%)
ALL患者与对照组间差异有统计学意义的高分辨HLA等位基因频率比较(%)
| HLA等位基因 | ALL组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 等位基因频率 | 例数 | 等位基因频率 | |||||
| A*02:03 | 63 | 9.75 | 79 | 5.32 | 1.92(1.36~2.72) | 14.25 | <0.01 | <0.01 |
| A*02:07 | 98 | 15.17 | 178 | 11.98 | 1.31(1.01~1.71) | 4.07 | 0.040 | 0.57 |
| B*35:05 | 9 | 1.39 | 5 | 0.34 | 4.20(1.40~12.57) | 6.20 | 0.010 | 0.13 |
| B*38:02 | 33 | 5.11 | 47 | 3.15 | 1.65(1.05~2.61) | 4.77 | 0.030 | 0.72 |
| B*46:01 | 118 | 18.27 | 211 | 14.16 | 1.35(1.06~1.73) | 5.83 | 0.020 | 0.39 |
| C*01:02 | 157 | 24.30 | 286 | 19.25 | 1.35(1.08~1.68) | 7.00 | 0.010 | 0.11 |
| DRB1*01:01 | 2 | 0.31 | 18 | 1.21 | 0.25(0.06~1.09) | 3.94 | 0.047 | 0.99 |
| DRB1*12:02 | 82 | 12.69 | 126 | 8.48 | 1.57(1.17~2.11) | 9.08 | 0.003 | 0.05 |
| DQB1*05:02 | 96 | 14.86 | 160 | 11.43 | 1.35(1.03~1.78) | 4.76 | 0.030 | 0.41 |
| DQB1*06:02 | 17 | 2.63 | 67 | 4.79 | 0.54(0.31~0.92) | 5.21 | 0.020 | 0.31 |
| DPB1*02:01 | 62 | 9.81 | 205 | 13.87 | 0.68(0.50~0.91) | 6.60 | 0.010 | 0.11 |
| DPB1*03:01 | 46 | 7.28 | 71 | 4.80 | 1.56(1.06~2.28) | 5.18 | 0.020 | 0.25 |
| DPB1*21:01 | 21 | 3.32 | 28 | 1.89 | 1.78(1.00~3.16) | 3.98 | 0.050 | 0.51 |
注:ALL为急性淋巴细胞白血病;对照组为健康献血者;高分辨水平为等位基因前4位数;HLA为人类白细胞抗原
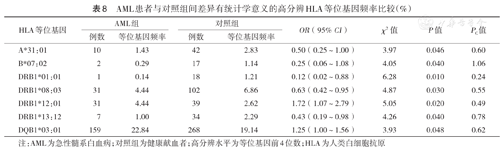
AML患者与对照组间差异有统计学意义的高分辨HLA等位基因频率比较(%)
AML患者与对照组间差异有统计学意义的高分辨HLA等位基因频率比较(%)
| HLA等位基因 | AML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 等位基因频率 | 例数 | 等位基因频率 | |||||
| A*31:01 | 10 | 1.43 | 42 | 2.83 | 0.50(0.25~1.00) | 3.97 | 0.046 | 0.60 |
| B*07:02 | 2 | 0.29 | 17 | 1.14 | 0.25(0.06~1.08) | 4.05 | 0.040 | 1.06 |
| DRB1*01:01 | 1 | 0.14 | 18 | 1.21 | 0.12(0.02~0.88) | 6.28 | 0.010 | 0.24 |
| DRB1*08:03 | 31 | 4.44 | 102 | 6.86 | 0.63(0.42~0.95) | 4.87 | 0.030 | 0.55 |
| DRB1*12:01 | 31 | 4.44 | 39 | 2.62 | 1.72(1.07~2.79) | 5.05 | 0.020 | 0.49 |
| DRB1*13:12 | 7 | 1.00 | 34 | 2.29 | 0.43(0.19~0.98) | 4.26 | 0.040 | 0.78 |
| DQB1*03:01 | 159 | 22.84 | 268 | 19.14 | 1.25(1.00~1.56) | 3.93 | 0.048 | 0.62 |
注:AML为急性髓系白血病;对照组为健康献血者;高分辨水平为等位基因前4位数;HLA为人类白细胞抗原
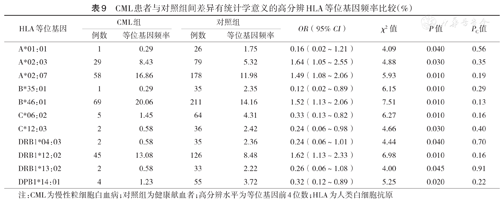
CML患者与对照组间差异有统计学意义的高分辨HLA等位基因频率比较(%)
CML患者与对照组间差异有统计学意义的高分辨HLA等位基因频率比较(%)
| HLA等位基因 | CML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 等位基因频率 | 例数 | 等位基因频率 | |||||
| A*01:01 | 1 | 0.29 | 26 | 1.75 | 0.16(0.02~1.21) | 4.09 | 0.040 | 0.56 |
| A*02:03 | 29 | 8.43 | 79 | 5.32 | 1.64(1.05~2.55) | 4.88 | 0.030 | 0.35 |
| A*02:07 | 58 | 16.86 | 178 | 11.98 | 1.49(1.08~2.06) | 5.93 | 0.010 | 0.19 |
| B*35:01 | 1 | 0.29 | 35 | 2.35 | 0.12(0.02~0.89) | 6.15 | 0.010 | 0.29 |
| B*46:01 | 69 | 20.06 | 211 | 14.16 | 1.52(1.13~2.06) | 7.51 | 0.010 | 0.13 |
| C*06:02 | 5 | 1.45 | 64 | 4.31 | 0.33(0.13~0.82) | 6.27 | 0.010 | 0.16 |
| C*12:03 | 2 | 0.58 | 36 | 2.42 | 0.24(0.06~0.98) | 4.66 | 0.030 | 0.40 |
| DRB1*04:03 | 2 | 0.58 | 35 | 2.36 | 0.24(0.06~1.01) | 4.44 | 0.040 | 0.70 |
| DRB1*12:02 | 45 | 13.08 | 126 | 8.48 | 1.62(1.13~2.33) | 6.98 | 0.010 | 0.16 |
| DRB1*13:02 | 2 | 0.58 | 33 | 2.22 | 0.26(0.06~1.08) | 4.00 | 0.045 | 0.91 |
| DPB1*14:01 | 4 | 1.23 | 55 | 3.72 | 0.32(0.12~0.89) | 5.25 | 0.020 | 0.22 |
注:CML为慢性粒细胞白血病;对照组为健康献血者;高分辨水平为等位基因前4位数;HLA为人类白细胞抗原
在HLA高分辨水平,各白血病组与对照组间差异有统计学意义的HLA单倍体见表10,表11,表12。P值经校正后,差异仍有统计学意义的HLA单倍体包括:ALL组A*02:03-B*38:02-C*07:02的频率高于对照组(χ2=10.41,PC=0.02);CML组DRB1*03:01-DQB1*02:01-DPB1*02:01的频率高于对照组(χ2=13.10,PC=0.01);未发现AML与任何HLA单倍体存在相关性。
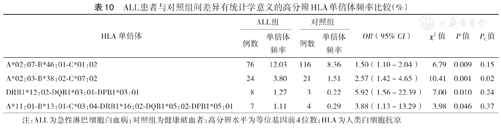
ALL患者与对照组间差异有统计学意义的高分辨HLA单倍体频率比较(%)
ALL患者与对照组间差异有统计学意义的高分辨HLA单倍体频率比较(%)
| HLA单倍体 | ALL组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 单倍体频率 | 例数 | 单倍体频率 | |||||
| A*02:07-B*46:01-C*01:02 | 76 | 12.03 | 116 | 8.36 | 1.50(1.10~2.04) | 6.79 | 0.009 | 0.15 |
| A*02:03-B*38:02-C*07:02 | 24 | 3.80 | 21 | 1.51 | 2.57(1.42~4.65) | 10.41 | 0.001 | 0.02 |
| DRB1*12:02-DQB1*03:01-DPB1*03:01 | 8 | 1.27 | 3 | 0.22 | 5.92(1.56~22.39) | 7.00 | 0.010 | 0.24 |
| A*11:01-B*13:01-C*03:04-DRB1*16:02-DQB1*05:02-DPB1*05:01 | 7 | 1.11 | 4 | 0.29 | 3.88(1.13~13.29) | 3.98 | 0.046 | 0.37 |
注:ALL为急性淋巴细胞白血病;对照组为健康献血者;高分辨水平为等位基因前4位数;HLA为人类白细胞抗原

AML患者与对照组间差异有统计学意义的高分辨HLA单倍体频率比较(%)
AML患者与对照组间差异有统计学意义的高分辨HLA单倍体频率比较(%)
| HLA单倍体 | AML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 单倍体频率 | 例数 | 单倍体频率 | |||||
| A*11:01-B*51:01-C*14:02 | 12 | 1.79 | 10 | 0.72 | 2.51(1.08~5.83) | 4.86 | 0.030 | 0.47 |
| A*11:01-B*40:01-C*07:02-DRB1*09:01-DQB1*03:03-DPB1*05:01 | 8 | 1.19 | 3 | 0.22 | 5.56(1.47~21.03) | 6.36 | 0.010 | 0.07 |
注:AML为急性髓系白血病;对照组为健康献血者;高分辨水平为等位基因前4位数;HLA为人类白细胞抗原
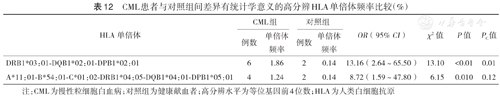
CML患者与对照组间差异有统计学意义的高分辨HLA单倍体频率比较(%)
CML患者与对照组间差异有统计学意义的高分辨HLA单倍体频率比较(%)
| HLA单倍体 | CML组 | 对照组 | OR(95% CI) | χ2值 | P值 | PC值 | ||
|---|---|---|---|---|---|---|---|---|
| 例数 | 单倍体频率 | 例数 | 单倍体频率 | |||||
| DRB1*03:01-DQB1*02:01-DPB1*02:01 | 6 | 1.86 | 2 | 0.14 | 13.16(2.64~65.50) | 13.10 | <0.01 | 0.01 |
| A*11:01-B*54:01-C*01:02-DRB1*04:05-DQB1*04:01-DPB1*05:01 | 4 | 1.24 | 2 | 0.14 | 8.72(1.59~47.80) | 6.15 | 0.010 | 0.12 |
注:CML为慢性粒细胞白血病;对照组为健康献血者;高分辨水平为等位基因前4位数;HLA为人类白细胞抗原
本研究结果提示,中国南方汉族人群中HLA-A*02、A*02:03、DRB1*12是ALL易感基因,A*02是CML易感基因,DRB1*13是CML拮抗基因。HLA Ⅰ类分子HLA-A、-B和-C将内源性抗原肽递呈给CD8+ T细胞,参与细胞毒性T细胞介导的免疫;HLA Ⅱ类分子HLA-DR、-DQ和-DP将外源性抗原肽递呈给CD4+ T细胞,在辅助性T细胞介导的免疫中起着重要作用。不同HLA分子递呈不同的抗原肽,即使递呈相同抗原肽,由于HLA分子高度丰富的基因多态性,其递呈能力和活化T细胞的能力差异有统计学意义,最终可能导致不同个体在白血病发生发展过程中的预后和转归不同[8]。HLA基因名称"*"号后4位数中第1、2位表示血清学特异性,第3、4位表示外显子碱基变异并引起氨基酸改变,高分辨基因分型比低分辨基因分型更能精确地体现不同HLA等位基因编码蛋白质的氨基酸改变。因此,我们首先对白血病组和对照组进行高分辨基因分型,鉴定受试者HLA等位基因的前4位数,然后分别从HLA低分辨水平及高分辨水平进行差异显著性数据分析。
HLA基因是紧密连锁的复等位基因,以单倍体方式遗传,存在显著的连锁不平衡现象。本研究在中国南方汉族人群中发现A*02-B*46-C*01、A*02:03-B*38:02-C*07:02是ALL易感单倍体,A*11-B*15-C*08-DRB1*15-DQB1*06-DPB1*02是AML易感单倍体,A*02-B*15-C*04是CML易感单倍体,其原因可能与汉族人群A*02-B*46、A*02:03-B*38:02、A*11:01-DRB1*15:01、A*02:05-B*15:11呈现强连锁不平衡有关[9,10]。
最早在1967年已有报道HLA-A2与白血病存在相关性。Naugler和Liwski[3]发现A*02在CML患者中的基因频率升高。Patiroglu和Akar[4]在土耳其人群中发现A*02纯合子及其单倍体A*02-B*35-DRB1*13是ALL易感基因型和单倍体;何军等[5]在江苏省汉族人群中同样发现ALL与A*02呈正相关。90%以上的CML患者肿瘤细胞出现费城染色体,形成BCR-ABL融合基因并表达具有肿瘤特异性的BCR-ABL融合蛋白,20%~30%的ALL患者肿瘤细胞也表达BCR-ABL融合蛋白。然而HLA-A2分子不能有效结合和递呈BCR-ABL融合蛋白给CD8+ T细胞[3]。携带A*02等位基因的CML患者体内与肿瘤特异性抗原高亲和力结合的T细胞克隆选择性减少,却选择性保留与肿瘤相关抗原蛋白酶3低亲和力结合的T细胞克隆[11]。虽然肿瘤相关抗原如蛋白酶3和Wilms肿瘤抗原1的HLA-A2限制性CD8+T细胞也被证实存在,但是HLA-A2较弱的肿瘤相关抗原递呈能力反而导致肿瘤特异性耐受[3]。
体外实验结果证实,BCR-ABL融合蛋白也可以被HLA-DRB1分子结合并递呈给CD4+ T细胞。不同HLA-DRB1分子递呈BCR-ABL融合蛋白给CD4+ T细胞的能力和活化CD4+ T细胞分泌干扰素γ的量都有所不同,最终导致其肿瘤杀伤效果不同[12]。BCR-ABL融合基因由于转录剪接方式不同,形成具有b2a2/b3a2、b1a2及e19a2等连接点的3种融合转录子并编码3种融合蛋白。DRB1*03:01、*04:02和*11:01均能递呈b3a2肽段,但是DRB1*11:01的递呈能力强于DRB1*03:01和*04:02;DRB1*03:01不仅递呈b3a2肽段,还可以递呈b2a2肽段[12]。
综上所述,本研究从中国南方汉族HLA Ⅰ类和Ⅱ类基因的等位基因多态性出发,发现了一些白血病易感或拮抗HLA等位基因或单倍体,可为阐明白血病发病机制以及制订有效的治疗策略提供重要参考。本研究中部分白血病易感或拮抗HLA等位基因或单倍体的作用机制目前尚未被阐明,有待更深入的研究。
所有作者均声明不存在利益冲突



























