
回顾性分析新型冠状病毒肺炎(COVID-19)患者合并细菌及真菌感染的临床特点和耐药情况。
收集同济医院2020年2月10日至3月31日血液、尿液、痰液和纤支镜冲洗液培养阳性的COVID-19患者的临床资料,采用WHONET5.6分析统计药敏数据。
共收集病原菌培养阳性COVID-19患者95例,非危重型患者23例,危重型72例,临床症状主要为发热、咳嗽咳痰、乏力、呼吸困难等,危重型男性患者占63.89%,女性患者占36.11%,危重型患者以男性居多,患者合并多种细菌和真菌感染以危重型为主,占23.61%,非危重型和危重型患者的死亡率分别为13.04%和61.11%,危重型患者的死亡率明显高于非危重型患者。病原菌共179株,大肠埃希菌在非危重型患者中检出率较危重型高,占37.50%,鲍曼不动杆菌和肺炎克雷伯菌在危重型患者中检出率较非危重型都高,各占29.87%,革兰阳性菌及真菌在非危重型和重型患者中的差异无统计学意义,但危重型患者血液真菌培养中提示近平滑念珠菌占比较高,为36.40%,临床不容忽视。药敏分析结果显示未发现大肠埃希菌对碳青霉烯类药物的耐药株,肺炎克雷伯菌对碳青霉烯类药物的耐药率为60.87%,鲍曼不动杆菌对3种抗菌药物的耐药率均为100%,耐甲氧西林金黄色葡萄球菌占71.43%,未发现万古霉素耐药的革兰阳性球菌。
COVID-19患者危重型以男性患者居多,其容易合并多种细菌和真菌感染,且死亡率比非危重型患者高。危重型患者常合并感染细菌为鲍曼不动杆菌和肺炎克雷伯菌等医院获得性菌株,其耐药性较高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新型冠状病毒(2019-nCoV)是一种新发现的β冠状病毒属,于2019年12月底首次被发现,其可导致严重的呼吸道传染病[1]。COVID-19患者以飞沫传播为主要传播途径,传染性极强,主要表现为发热、乏力、干咳等症状,病情严重患者易出现呼吸困难,有的甚至可快速进展为急性呼吸窘迫综合征、脓毒血症、全身各器官功能衰竭等。其致病机制尚未明确,亦无特效药物[2],临床以对症支持治疗为主。目前已经有较多关于2019-nCoV的基础研究(流行病学、临床特征分析等)[3,4],但缺乏2019-nCoV合并细菌及真菌感染的数据分析,本研究通过分析血液、尿液、痰液和纤支镜冲洗液培养阳性的COVID-19患者的临床资料和细菌的药敏结果,为抗疫临床医生抗生素的使用和医院感染防治提供科学依据。
收集同济医院2020年2月10日至3月31日血液、尿液、痰液和肺泡灌洗液细菌和真菌培养阳性的COVID-19患者的临床资料和药敏数据,剔除同一患者相同部位分离的重复菌株。该研究通过华中科技大学同济医学院附属同济医院伦理委员会批准,批准号IRB ID: TJ-C20200128。
哥伦比亚血平板和巧克力平板和CLED平板购自广州市迪景微生物科技有限公司,微生物质谱鉴定系统(matrix-assisted laser desorption ionization time-of-flight mass spectrometry, MALDI-TOF MS)购自德国Burker公司,药敏纸片购自美国赛默飞世尔科技公司(Thermo Fisher Scientific)。
收集整理患者临床数据,包括人口学资料、临床症状、基础疾病、培养结果、转归等临床信息,根据临床分型,将普通型和重型患者作为非危重型与危重型进行对比。
临床送检的血液、尿液、痰液以及肺泡灌洗液常规细菌培养严格按照标准操作规程进行[5]。选取单一菌落使用质谱仪进行鉴定。按照纸片扩散法(K-B法)进行药敏试验,质控菌株为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、金黄色葡萄球菌SAUATCC25923等。药敏试验结果根据2019年美国临床实验室标准化协会M100的判读标准判读[6]。
根据中华医学会检验分会关于2019年新型冠状病毒肺炎临床实验室检测的生物安全防护指南(试行第一版),该操作在生物安全二级实验室开展,在生物安全柜中进行,个人采用三级生物安全防护。
使用WHONET5.6对药敏数据进行统计和分析。SPSS21.0对COVID-19患者非危重型和危重型进行统计分析,计量资料进行正态性检验,符合正态分布以均数±标准差表示,组间比较采用t检验;非正态分布计量资料以中位数(四分位间距)表示,组间比较采用Mann-WhitneyU检验(秩和检验);计数资料以百分率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
病原菌培养阳性患者共95例(表1),非危重型23例,危重型72例,危重型男性患者占63.89%(46/72),女性患者占36.11%(26/72),危重型患者平均年龄65[53,73]岁,就病情发展而言,男性患者比女性患者更易发展为危重型(P<0.01),但年龄差异无统计学意义(P=0.05);标本来源中,血液标本占比最高,为38.95%(37/95),其次是尿液标本,为37.89%(36/95),呼吸道标本(痰液和纤支镜冲洗液)占比最少,为23.16%(22/95),但非危重型及危重型患者标本来源差异无统计学意义;危重型患者合并两种以上细菌和真菌感染占55.56%,明显高于非危重型患者(P<0.01);非危重型和危重型患者死亡率分别为13.04%和61.11%,危重型患者死亡率明显高于非危重型患者(P<0.01)。
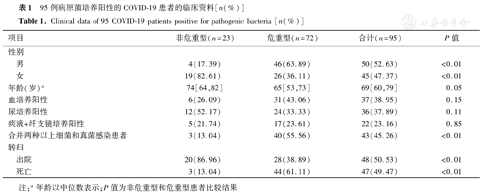
95例病原菌培养阳性的COVID-19患者的临床资料[n(%)]
Clinical data of 95 COVID-19 patients positive for pathogenic bacteria [n(%)]
95例病原菌培养阳性的COVID-19患者的临床资料[n(%)]
Clinical data of 95 COVID-19 patients positive for pathogenic bacteria [n(%)]
| 项目 | 非危重型(n=23) | 危重型(n=72) | 合计(n=95) | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 4(17.39) | 46(63.89) | 50(52.63) | <0.01 | |
| 女 | 19(82.61) | 26(36.11) | 45(47.37) | <0.01 | |
| 年龄(岁)a | 74[64,82] | 65[53,73] | 69[60,79] | 0.05 | |
| 血培养阳性 | 6(26.09) | 31(43.06) | 37(38.95) | 0.15 | |
| 尿培养阳性 | 12(52.17) | 24(33.33) | 36(37.89) | 0.11 | |
| 痰液+纤支镜培养阳性 | 5(21.74) | 17(23.61) | 22(23.16) | 0.85 | |
| 合并两种以上细菌和真菌感染患者 | 3(13.04) | 40(55.56) | 43(45.26) | <0.01 | |
| 转归 | |||||
| 出院 | 20(86.96) | 28(38.89) | 48(50.53) | <0.01 | |
| 死亡 | 3(13.04) | 44(61.11) | 47(49.47) | <0.01 | |
注:a年龄以中位数表示;P值为非危重型和危重型患者比较结果
共检出病原菌179株,非危重型患者35株,危重型患者144株(表2)。革兰阴性菌中非危重型患者检出病原菌最多为大肠埃希菌,占37.50%(6/16),危重型患者主要病原菌为鲍曼不动杆菌和肺炎克雷伯菌,各占29.87%(23/77),大肠埃希菌在非危重型患者中检出率较危重型高(P<0.05),鲍曼不动杆菌和肺炎克雷伯菌在危重型患者中检出率较非危重型高(P<0.05);革兰阳性菌中,危重型患者主要检出屎肠球菌和金黄色葡萄球菌,分别占45.00%(9/20)和30.00%(6/20),两种细菌在非危重型和危重型患者中的检出率差异无统计学意义(P均>0.05);真菌培养中,非危重型和危重型患者均为白色念珠菌检出率最高,各占53.33%(8/15)和53.19%(25/47),近平滑念珠菌在危重型患者血液中检出率较高,为36.36%(4/11)。
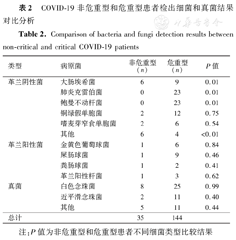
COVID-19非危重型和危重型患者检出细菌和真菌结果对比分析
Comparison of bacteria and fungi detection results between non-critical and critical COVID-19 patients
COVID-19非危重型和危重型患者检出细菌和真菌结果对比分析
Comparison of bacteria and fungi detection results between non-critical and critical COVID-19 patients
| 类型 | 病原菌 | 非危重型(n) | 危重型(n) | P值 |
|---|---|---|---|---|
| 革兰阴性菌 | 大肠埃希菌 | 6 | 9 | 0.01 |
| 肺炎克雷伯菌 | 0 | 23 | 0.01 | |
| 鲍曼不动杆菌 | 0 | 23 | 0.01 | |
| 铜绿假单胞菌 | 2 | 12 | 0.75 | |
| 嗜麦芽窄食单胞菌 | 2 | 6 | 0.54 | |
| 其他 | 6 | 4 | <0.01 | |
| 革兰阳性菌 | 金黄色葡萄球菌 | 1 | 6 | 0.84 |
| 屎肠球菌 | 1 | 9 | 0.46 | |
| 粪肠球菌 | 1 | 2 | 0.41 | |
| 革兰阳性杆菌 | 1 | 3 | 0.62 | |
| 真菌 | 白色念珠菌 | 8 | 25 | 0.99 |
| 近平滑念珠菌 | 2 | 11 | 0.40 | |
| 其他 | 5 | 11 | 0.44 | |
| 总计 | 35 | 144 |
注:P值为非危重型和危重型患者不同细菌类型比较结果
危重型患者和非危重型患者均未发现大肠埃希菌对碳青霉烯类药物的耐药株,在危重型患者中,肺炎克雷伯菌对头孢吡肟的耐药率大于90.00%,对碳青霉烯类药物的耐药率亦高达60.87%;鲍曼不动杆菌对3种抗菌药物的耐药率均为100%(表3)。检出5株耐甲氧西林的金黄色葡萄球菌,占71.43%(5/7),未发现对万古霉素、替考拉宁、利奈唑胺和替加环素耐药的革兰阳性球菌。
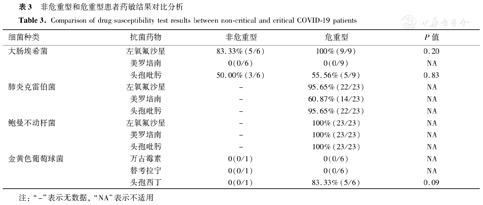
非危重型和危重型患者药敏结果对比分析
Comparison of drug susceptibility test results between non-critical and critical COVID-19 patients
非危重型和危重型患者药敏结果对比分析
Comparison of drug susceptibility test results between non-critical and critical COVID-19 patients
| 细菌种类 | 抗菌药物 | 非危重型 | 危重型 | P值 |
|---|---|---|---|---|
| 大肠埃希菌 | 左氧氟沙星 | 83.33%(5/6) | 100%(9/9) | 0.20 |
| 美罗培南 | 0(0/6) | 0(0/9) | NA | |
| 头孢吡肟 | 50.00%(3/6) | 55.56%(5/9) | 0.83 | |
| 肺炎克雷伯菌 | 左氧氟沙星 | - | 95.65%(22/23) | NA |
| 美罗培南 | - | 60.87%(14/23) | NA | |
| 头孢吡肟 | - | 95.65%(22/23) | NA | |
| 鲍曼不动杆菌 | 左氧氟沙星 | - | 100%(23/23) | NA |
| 美罗培南 | - | 100%(23/23) | NA | |
| 头孢吡肟 | - | 100%(23/23) | NA | |
| 金黄色葡萄球菌 | 万古霉素 | 0(0/1) | 0(0/6) | NA |
| 替考拉宁 | 0(0/1) | 0(0/6) | NA | |
| 头孢西丁 | 0(0/1) | 83.33%(5/6) | 0.09 |
注:"-"表示无数据,"NA"表示不适用
2019-nCoV是一种全新的冠状病毒[7,8],自暴发以来蔓延很快,给人类健康和社会经济带来很大威胁。
根据国家卫生健康委员会制定的《新型冠状病毒肺炎诊疗方案(试行第六版)》[9],将COVID-19进行临床分型。普通型:具有发热、呼吸道等症状,影像学可见肺炎表现。符合以下条件之一可诊断为重型:出现气促,呼吸频率≥30次/分;静息状态下,指氧饱和度≤93.00%;氧合指数≤300 mmHg。符合以下条件之一可诊断为危重型:出现呼吸衰竭,且需要机械通气;出现休克;合并其他器官功能衰竭需重症监护室监护治疗。本研究把普通型和重型作为一组即非危重型,与危重型进行比较,发现合并细菌和真菌感染的COVID-19主要以危重型为主,占75.79%,且危重型患者比非危重型患者合并两种以上细菌和真菌感染的比例更高(P<0.01),提示危重型患者在接收治疗过程中,病程长,侵入性治疗手段增加,更容易合并多种细菌和真菌感染。本研究中患者男女比例为10∶9,性别差异无统计学意义,但在危重型中男性患者比女性占更高的比例(P<0.01),这表明男性患者更容易发展为危重型,与相关报道一致[10]。本研究结果显示,总体死亡率为49.47%,远远超过湖北省总体COVID-19患者的死亡率(7.69%),危重型患者死亡率比非危重型患者高(P<0.05),达61.11%,与相关报道基本一致(49.00%)[11],危重型患者大部分为高龄患者,肺部病变严重,病程较长,多存在细胞免疫抑制表现,容易继发细菌或真菌感染。
病原菌构成分析中,检出179株病原菌,呼吸道感染最多,占48.60%,与李中美等[12]关于神经内科重症监护室医院感染病原菌分析结果基本一致(64.00%),分析原因,可能是由于危重患者多伴意识障碍,机体咳嗽反射降低,痰液积留肺部,发生感染风险增加;血液和尿道感染各占25.70%,这提示了中心静脉置管和导尿管等侵入性操作随着抗菌药物和免疫抑制剂等的使用,大大增加了血流感染和尿路感染的风险。研究还显示,分离的病原菌中,危重型患者主要合并感染细菌为鲍曼不动杆菌和肺炎克雷伯菌,该结果与2009年暴发的新型甲型H1N1流感患者分离的常规细菌种类不同。一项阿根廷研究显示,新型甲型H1N1流感患者主要分离细菌为流感嗜血杆菌和肺炎链球菌以及金黄色葡萄球菌[13],考虑COVID-19危重型患者病情严重,几乎所有患者均需要有创机械通气,因此容易感染环境适应能力较强的细菌,如鲍曼不动杆菌和肺炎克雷伯菌等。此外,该研究发现所有患者真菌感染也较多,占34.64%,痰液和肺泡灌洗液以白色念珠菌为主,可能是重症和危重症患者长期使用大量广谱抗生素,导致定植的白色念珠菌大量繁殖有关。研究还发现,危重型患者血流感染主要以近平滑念珠菌为主,且所有患者均有中心静脉导管置入术和气管插管等有创操作,目前亦有真菌导管相关性血流感染主要以近平滑念珠菌为主的报道[14]。
药敏分析结果显示,在危重型患者中,鲍曼不动杆菌、肺炎克雷伯菌耐药率对第四代头孢菌素耐药率均超90.00%;大肠埃希菌和肺炎克雷伯菌对喹诺酮类药物的耐药率亦均高达90.00%以上;大肠埃希菌、肺炎克雷伯菌和鲍曼不动杆菌对碳青霉烯类药物的耐药率分别为0、60.87%和100%,相对2018年CHINET数据(分别为2.10%、26.30%、73.90%)[15]和2018年全国细菌耐药监测网监测结果(分别为1.50%、10.10%、56.10%)[16]明显增加,分析原因,危重型COVID-19患者治疗过程中容易合并细菌和真菌感染,而且高龄、原发病多、病情严重,诊疗过程中有创性操作及抗生素应用均较多,患者并发医院获得性感染现象严重,导致细菌耐药性增加,近年来肺炎克雷伯菌对碳青霉烯类抗生素的耐药率逐年上升,CHINET数据显示,肺炎克雷伯对美罗培南的耐药率由2005年的2.90%上升到2018年的26.30%,碳青霉烯耐药的肺炎克雷伯菌可产生能够水解亚胺培南或美罗培南的一类β内酰胺酶,常见有A、C、D三类酶,肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniae carbapenemase, KPC)是重要的A类酶,产生KPC型碳青霉烯酶是肺炎克雷伯菌的主要耐药机制[17]。革兰阳性球菌中,金黄色葡萄球菌是导致呼吸道感染的主要致病菌,此研究显示,检出7株金黄色葡萄球菌,甲氧西林耐药的金黄色葡萄球菌(MRSA)占71.43%,根据CHINET耐药监测网监测结果显示,近年来MRSA呈逐年下降趋势,耐药率不超过40.00%,提示了危重型患者MRSA的感染不容忽视。
综上所述,COVID-19患者合并细菌和真菌感染多发于呼吸道,同时真菌性血流感染亦不容忽视,危重型患者以男性多见,且死亡率极高,病原菌感染以鲍曼不动杆菌居多,随着患者住院时间延长,使用抗菌药物种类增多,导致病原菌耐药性增加,临床要加强对患者的病原菌检测,并且进行药敏试验,根据药敏结果选择药物治疗,提升临床治疗效果、康复程度与预后质量。
所有作者均声明不存在利益冲突



























