
伴有高级别转化的胰腺实性假乳头状肿瘤相对罕见,该文报道1例33岁的女性病例,显微镜下肿瘤由囊性区、假乳头区和实性区构成,实性区可见大片出血坏死,假乳头区可见松散的上皮样细胞包绕纤维血管轴心,肿瘤细胞呈圆形和卵圆形,胞质丰富嗜酸性,核圆形,部分细胞异型性明显,并可见瘤巨细胞;免疫表型:肿瘤细胞转录因子E3(TFE3)阳性、β-catenin胞质阳性,极少数胞膜不连续性阳性,未见核阳性表达。该例形态学及免疫表型不典型,易误诊为胰腺神经内分泌肿瘤。该文描述其组织学特点、免疫表型,阐述其诊断要点,并复习和总结相关文献。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,33岁。因右中上腹隐痛1个月余于2020年1月27日就诊于南京医科大学第一附属医院。体检:右中上腹部触及6 cm×6 cm质硬肿块,有压痛、深压痛。查腹部CT示:十二指肠降部见类圆形肿块影(图1),大小6.6 cm×6.2 cm,增强扫描动脉期边缘明显强化,内伴无强化低密度区,肿块局部破裂与肠腔相通。胰腺、脾脏形态、大小及密度未见异常,胰周脂肪间隙清楚。胃镜所见:十二指肠乳头明显肿大,开口及其周围溃烂。超声所见:十二指肠乳头见巨大不规则低回声区,内部回声不均匀,挤压胰头及钩突,胰管无明显扩张,胰腺实质内未见异常回声,胆总管无扩张,周围未见肿大淋巴结。实验室检查:糖链抗原19-9(CA19-9)5.62×103U/L,癌胚抗原0.9 μg/L,甲胎蛋白1.55 μg/L,均为正常水平。2020年2月4日患者在全麻下行“保留幽门的胰十二指肠切除术”,术中所见:十二指肠降部系膜缘可及实性肿块,大小约7.0 cm×6.0 cm×5.0 cm,质地硬,与周围组织界限不清。胰头周围未及肿大淋巴结,胰头及十二指肠后方与下腔静脉和腹主动脉之间无明显粘连,第16组淋巴结未及肿大。胰腺体尾部正常。行胰十二指肠切除术,术后标本送病理检查。
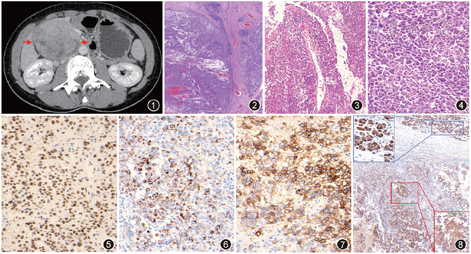

病理检查:肿瘤位于十二指肠降部,大小8.0 cm×7.0 cm×4.8 cm,囊实性,灰红灰黄,质地软,部分区坏死。与周围组织境界尚清,肿块表面十二指肠乳头处及周围黏膜隆起,部分黏膜区糜烂、破损,肿瘤肉眼累及胰腺组织;未累及胰腺远端切缘、门静脉沟切缘,未累及胰头及钩突切缘。镜下观察:大部分肿瘤与周围胰腺分界尚清楚(图2),但无明显包膜,肿瘤由囊性区、假乳头区和实性区构成。囊性区由大小不等的囊状结构组成,实性区富于细胞,可见出血、坏死;假乳头区具有纤维血管轴心,周围包绕松散的上皮样细胞(图3)。此种上皮样肿瘤细胞大小一致,呈圆形和卵圆形,胞质丰富嗜酸性,核圆形,核仁不明显,无异型性(此类细胞成分占30%),但部分肿瘤细胞异型性明显,细胞大,核大,核仁居中明显,并可见瘤巨细胞(图4),核分裂象易见(20个/10 HPF)(此类细胞成分占70%)。可见大片肿瘤细胞坏死、出血,肿瘤表面十二指肠黏膜示急慢性炎,部分区上皮细胞脱落伴片状炎性坏死渗出,肉芽组织增生。送检淋巴结20枚,其中1枚见肿瘤组织转移(1/20)。免疫组织化学检查:肿瘤细胞转录因子E3(TFE3)(图5)、p53、波形蛋白、FLI1、α-抗胰蛋白酶(AAT)阳性,广谱细胞角蛋白(CKpan)阳性(图6)、CD68、CD163散在阳性,细胞角蛋白(CK)-L、CD10(图7)、CK8/18部分阳性,CD30局灶弱阳性;WT-1个别弱阳性,β-catenin胞质阳性,极少数胞膜不连续性阳性,未见核阳性表达,周围胰腺导管、腺泡呈明确胞膜强阳性表达(图8)。癌胚抗原、神经元特异性烯醇化酶(NSE)、绒毛蛋白(Villin)、嗜铬粒素A(CgA)、CD56、CD3、CD20、ALK p80、甲状腺转录因子1(TTF1)、细胞周期蛋白D1(cyclin D1)、孕激素受体(PR)、生长抑素受体2(SSTR2)、上皮细胞钙黏蛋白(E-cadherin)、S-100蛋白、ERG、DOG1、MC、HMB45、LCA、平滑肌肌动蛋白(SMA)、CD31、CK7、CD117、CK20均阴性,MGMT、CD99可疑阳性,Ki-67阳性指数约80%。分子遗传学检测:KRAS基因第2、3、4号外显子均未检测到突变。BRAF基因V600E未检测到突变。NRAS基因第2、3、4号外显子均未检测到突变。
病理诊断:伴有高级别转化的胰腺实性假乳头状肿瘤。
随访:术后未进一步治疗。目前随访4个月,未见复发及转移。
讨论:胰腺实性假乳头状肿瘤(solid-pseudopapillary tumor,SPT)是一种罕见的具有低度恶性的胰腺外分泌肿瘤,占所有胰腺肿瘤的0.3%~3.0%。SPT于1959年由Frantz首次报道,后WHO正式将其命名为胰腺实性假乳头状肿瘤。由于完全切除后患者5年生存率可达95%且少有远处转移[1],预后相对较好,人们一直将其视为一种良性或交界性肿瘤。然而,近年来有数个案例报道了SPT伴转移、恶性转化,2010年至2019年WHO第5版均将其分类为低度恶性肿瘤,但此分类仍然存在争议[2]。
SPT多发生于年轻女性,平均发病年龄20~30岁,发病男女比例约为1∶10[3]。发生在儿童,占儿童胰腺肿瘤的6%~17%[4]。SPT可发生于胰腺任何部位,以胰头多见,其次为胰体尾部。本例肿块肉眼位于十二指肠降部的黏膜下层,但是显微镜下发现肿瘤部分位于胰头部胰腺实质内,与周围胰腺之间有一个界限,但部分肿瘤与胰腺直接相邻,推测肿瘤也是起源于胰腺并且累及十二指肠,累及十二指肠的肿瘤范围较大,故肉眼及影像学都判断为十二指肠肿瘤。SPT临床症状不典型,患者可有腹部包块、腹部不适等症状,部分患者于体检时发现影像囊实性肿块遂进一步就诊。SPT患者的肿瘤标志物常在正常范围内。本例患者为33岁年轻女性,符合SPT流行病学特点。患者以腹部阵发性隐痛并自行触及腹部包块为主要临床表现,体检触及腹部包块,有压痛、深压痛。与文献报道的临床症状及体征相似。
大部分SPT有较完整的纤维包膜,与正常胰腺分界较清。镜下SPT假乳头区表现为被覆数层上皮的分支状假乳头,假乳头内含纤维血管轴心,血管周围有黏附力弱的肿瘤细胞包绕,缺乏正常胰腺上皮分化。肿瘤细胞呈大小一致的圆形或卵圆形,胞质丰富,胞质嗜酸性,通常异型性较小[5]。值得注意的是,SPT是一种低度恶性的肿瘤,高级别转化极其罕见。本例患者除少量经典肿瘤成分外,还有部分肿瘤细胞出现弥漫性生长,明显异型性和明确的大核仁,出现多核瘤巨细胞,核分裂象易见(20个/10 HPF),伴出血、坏死、脉管内癌栓,同时肿瘤浸润胰腺实质,Ki-67高表达,故考虑为高级别转化。高级别转化失去其原有的形态学结构和细胞学特征,往往呈现弥漫性生长和大量异型性明显的细胞,此时要多取材,镜下尤其要注意寻找经典的SPT区域来帮助诊断。
免疫组织化学在SPT的诊断中有重要参考价值,WHO推荐将β-catenin、CD10、波形蛋白、CgA作为SPT的确诊依据。2017年,Foo等[6]对13例SPT患者进行免疫组织化学检测,发现9例患者肿瘤细胞核TFE3阳性。2018年,Jiang等[7]发现75例患者中,71例(94.7%)肿瘤细胞核TFE3阳性。这提示在SPT中TFE3具有诊断意义。本例中经典SPT区域及高级别转化区域均呈现TFE3阳性,对诊断具有帮助作用。本例诊断时高级别区域免疫组织化学β-catenin胞质阳性,转录因子E3(TFE3)核阳性,CD10和波形蛋白的阳性,CgA、突触素阴性,是我们排除胰腺神经内分泌肿瘤、腺泡细胞癌的重要证据,最终支持胰腺实性假乳头状肿瘤伴高级别转化的诊断。
SPT发病机制尚未完全清楚,但多数学者认可β-catenin突变在SPT发生发展中起到的作用,约90%的SPT都有编码β-catenin的 CTNNB基因的第3号外显子出现点突变[8],通过形成β-catenin-Tcf/Lef复合物,激活相关转录因子,抑制了β-catenin的降解,导致β-catenin在细胞核内聚集。同时正常情况下E钙黏蛋白的胞质末端结合至β-catenin,被输送到细胞膜作为细胞黏附分子。而大量的β-catenin从细胞质进入细胞时会造成E钙黏蛋白在细胞膜的失表达。这解释了大多数SPT的免疫组织化学特征:β-catenin的核表达及E-cadherin的胞质内表达而不是细胞膜表达。本例中,免疫组织化学并没有出现典型β-catenin核表达的表型,但出现β-catenin在细胞膜表达比例的大幅度缺失,呈现明显的胞质阳性,说明了β-catenin在胞质内的异常聚集,同时影响了E-cadherin在细胞膜表达,呈现阴性的特征,推测此种异常的β-catenin核阴性与高级别转化有关。分子病理在SPT的诊断中也具有一定价值。多数SPT存在CTNNB1的突变,汤小龙[9]发现除CTNNB1外,MAPKAPK2、FGF10也为SPT阳性突变基因。本例仅进行了KRAS基因、BRAF基因V600E及NRAS基因的检测,未发现异常,将来可进行上述相关基因的检测。
主要的鉴别诊断是胰腺神经内分泌肿瘤(PNEN):二者大体均为实性或囊实性肿块,镜下肿瘤细胞形态相似。PNEN肿瘤细胞排列可呈菊形团状、结节状、缎带状、团块状。高分化PNEN细胞形态相对一致,呈圆形或多角形、短梭形,胞质透明或嗜酸性,胞核染色质“椒盐样”,核分裂象少见。低分化PNEN肿瘤细胞多呈实性排列,肿瘤细胞体积较大,形态大小不一,细胞具有异型性,核分裂象多见,可见坏死,肿瘤浸润性生长。SPT、PNEN肿瘤细胞不同程度表达波形蛋白、突触素、CD99。PNEN特异性表达CgA,胞膜或胞质往往呈E-cadherin阳性,胞核几乎不表达β-catenin[10],而在SPT中CgA、E-cadherin往往为阴性,β-catenin和TFE3核阳性、CD10阳性可作为两者的鉴别依据。
SPT是相对少见的胰腺肿瘤,临床表现不典型,单纯SPT进行手术切除后预后良好,但SPT伴高级别转化的患者预后较差,需正确识别并鉴别诊断。本例肿瘤的形态学出现高级别,且免疫组织化学结果不典型,正确的诊断选择经典标志物如β-catenin、TFE3、CD10、波形蛋白、CgA等,同时寻找到经典的SPT区域,最终获得正确诊断。
所有作者均声明不存在利益冲突



























