
通过回顾1例扁平隆起型乙状结肠侧向发育型肿瘤(laterally spereading tumor,LST)的临床诊治过程,探讨扁平隆起型大肠LST在内镜下可能的漏诊原因,以期提高LST临床检出率;通过文献复习,对LST的内镜诊断、病理类型、临床特征与治疗情况进行分析与思考,为今后临床对LST的研究和诊治提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,67岁,因父亲及叔叔有肿瘤病史,于2017-06-23在福建中医药大学附属第二人民医院体检行结肠镜检查,发现乙状结肠距肛门18 cm有一大小2.5 cm×3.0 cm侧向生长扁平隆起型病变,表面光滑,见一大小0.2 cm×0.2 cm结节样隆起,边界清,周边可见白斑。符合内镜下切除适应证,收住消化内科。癌胚抗原定量5.15 ng/mL;全腹CT平扫+增强:乙状结肠冗长,结直肠未见明显占位性病变,肝脏多发低密度灶,考虑为血管瘤;其余检查未见明显异常。患者既往体健。家族史:其父57岁时因贲门腺癌行外科手术,术后生存37年;其叔59岁时因直肠癌行外科手术,2年后局部复发,术后生存18年。排除手术禁忌证后,拟行ESD。术前再次观察,病灶处于乙状结肠拐角处,见部分黏膜粗糙增厚,边缘呈花瓣状或伪足样突出,吸气后病灶柔软、抬高,表面欠规整(图1);靛胭脂染色见病灶黏膜明显肥厚、表面凹凸不平,呈Ⅱ-a型病变,pit分型大部分呈现Ⅴi型(轻度不整),大小不同,排列紊乱,非对称性结构(图2);窄带光成像下病灶呈茶色改变,放大内镜示不规则血管的厚度和分布相对不均匀,网格状腺管开口显示不规则光滑的腺管结构,边缘未破坏(图3)。术中沿着病灶外围0.5 cm处标记,黏膜下注射1∶10 000肾上腺素+生理盐水注射液后,抬举征(+),用Dual刀切开病灶肛侧,沿黏膜下剥离完整病灶,手术过程顺利,无活动性出血。ESD标本大小3.5 cm×4.0 cm,置入10%甲醛溶液后送病理科。术后予禁食、肛管排气、补液营养支持等治疗。术后病理诊断(图4):管状腺瘤伴高级别上皮内瘤变,伴局灶癌变(中分化管状腺癌),大小2.0 cm×1.8 cm,浸润黏膜肌层及黏膜下层,肿瘤细胞靠近边切缘及底切缘。免疫组化:p53(+++,错义突变型),Ki-67(85%+),MUC2(+),CKpan(+),Villin(+),CDX-2(+),CD34(-),TS(-),TopoII(+),CEA(+);结直肠癌微卫星不稳定性免疫组化筛查结果——微卫星稳定性(MSS):MLH1(+),MSH2(+),MSH6(+),PMS2(+)。经外科医师会诊,考虑癌细胞靠近边切缘及底切缘,遂行根治性乙状结肠癌切除术。外科术后病理:未见癌组织残留,标本两侧切端、肠周切缘均未见癌组织累犯,肠周未见淋巴结转移。术后3、6、12个月随访,患者无特殊不适。术后复查2次结肠镜及全腹平扫+增强CT,未见复发征象。
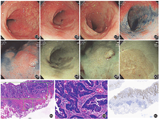

大肠侧向发育型肿瘤(LST)是一种直径>1 cm沿着肠腔内壁横向延伸,极少向肠壁深层垂直侵犯的非息肉样肿瘤病变[1]。根据黏膜表面是否有结节状隆起分为颗粒型和非颗粒型,前者根据结节大小分布进一步分为颗粒均一型和结节混合型,后者根据是否凹陷分为扁平隆起型和假凹陷型[2]。本病例按照上述分类标准,属于扁平隆起型。由于LST侧向生长的特征,白光内镜下不易观察极易漏诊,本例从形态学上为扁平隆起型,其易漏诊原因如下:①病灶在白光下仅见黏膜色泽发红,黏膜稍增厚隆起,血管网不清,易误为镜身摩擦引起;②病灶处于直乙交界处,结肠扭曲,肠腔狭窄,暴露困难,不易观察全貌。因此笔者认为内镜下应警惕黏膜表面结构改变(如粗糙、肥厚、凹陷等)、色泽异常、血管网中断或消失以及无名沟中断及其他异常表现。对于结肠某些特殊部位,如回盲瓣、升结肠、肝曲、脾曲、乙状结肠,更应有意识减慢观察或反转内镜观察。对于可疑病变可通过电子染色内镜、放大内镜、共聚焦激光内镜及色素内镜等技术强化病灶在内镜下的表现,可提高LST检出率,同时确定病变范围、肿瘤浸润深度及对组织病理学信息初步诊断。操作医师对LST清晰的认识以及提高肠道清洁程度也是肠腔内发现此类病灶的关键因素。
LST相比传统隆起型腺瘤存在更高的恶性潜能,研究表明发病部位、形态学分型、直径大小均是LST癌变相关危险因素,而与年龄、性别无明显相关[3]。对于LST好发部位,国内外学者仍存在争议,这种分布差异可能与样本量、地区和人种有关,总的研究表明LST多见直肠和右半结肠。LST发生癌变及黏膜下浸润与直径大小不存在严格相关性[4]。LST黏膜下浸润癌的发生与pit分型、JENT分型和病理有高度相关性,如有局限性的Ⅴi型(严重不规则性)或Ⅴn型腺管,微血管局限性稀疏、消失、中断,并出现表面无结构区域,则有可能发生黏膜下深浸润性癌,需要手术切除[5]。Prak等[6]回顾性分析内镜下切除的324例LST患者侧切缘阳性局部复发的长期临床转归,显示侧切缘阳性复发率约6.3%,术中联合热消融治疗复发概率可大大降低。
治疗上,相对于传统隆起型腺瘤,结肠镜下一旦发现LST,应积极干预[3]。对于未发生黏膜下浸润或转移的LST,均可选择内镜下切除。怀疑黏膜下浅层浸润的LST行诊断性ESD也被认可。因LST很少向黏膜下层浸润,故一般直径<2 cm的LST通常采用EMR切除;直径>2 cm的LST,ESD被推荐为治疗的标准方法[7]。对于术中操作困难病灶,可行黏膜分片切除术,但复发率高,术后应密切随访。病灶不能充分暴露者,直肠常选择反转法内镜黏膜切除术,回盲部、结肠可在外力辅助牵引下手术。为了一次性完整切除病灶,获得完整病理学评估,避免手术操作时间过长,降低手术难度减少并发症,也可选择预切开内镜黏膜切除术、注水法内镜黏膜切除术、多环黏膜套扎切除术等。如电子染色放大内镜检查腺体开口不规则或者无结构,局部血管增粗、迂曲,pit分型为Ⅴ型,提示黏膜下癌,内镜超声检查黏膜下层与固有肌层分界不清,提示浸润癌,常需要外科手术治疗。若发现边缘有少量肿瘤组织残瘤或局部复发危险因素,可定期随访复查或氩离子凝固术治疗,或外科手术治疗。ESD术前完整正确标记病变,术中完整、整块切除是防止复发的关键。本病例ESD术前标记在病灶外0.5 cm,术后病理提示边切缘癌组织残留,那么是否认为此类边缘呈伪足状突出的病灶,肿瘤细胞更易向周边侵袭,这与近年来学者提出的"skirt"术后局部更易复发[8]是否存在联系尚待进一步研究。因此笔者建议类似非颗粒型LST,术前评估是术式选择的关键。
所有作者声明不存在利益冲突



























