
探讨基于CT平扫冠状动脉周围(简称冠周)脂肪的影像组学模型对非钙化斑块的诊断价值。
回顾性分析461例2019年8月1日至2020年7月31日苏州大学附属第一医院放射科行冠状动脉CT血管造影(CCTA)患者的影像学资料。CCTA检出206例(355支)冠状动脉有非钙化斑块,255例(510支)冠状动脉未见异常。于CT平扫[钙化积分(CCS)序列]图像对冠周脂肪进行感兴趣区(ROI)勾画。选取距冠状动脉开口处10 mm起始的长为40 mm的冠状动脉进行冠状动脉ROI勾画并自动生成冠周脂肪ROI,随后进行冠周脂肪衰减指数(FAI)以及影像组学参数的提取。将865支冠状动脉按7∶3的比例分为训练组(n=606)和测试组(n=259)并进行组学建模,运用受试者工作特征(ROC)曲线分析评估FAI值以及组学模型对于非钙化斑块的诊断效能。
从基于平扫的冠周脂肪的图像中共提取1 692个特征,使用最大相关最小冗余(mRMR)和最小绝对收缩与选择算子(LASSO)进行特征筛选后,筛选出14个特征用于影像组学模型的建立。模型在测试组中鉴别非钙化斑块患者和冠状动脉未见异常者的准确度、灵敏度、特异度和曲线下面积(AUC)分别为70.3%、63.2%、75.2%和0.75。
基于平扫冠周脂肪影像组学模型对非钙化斑块具有较好的诊断效能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
研究表明,冠状动脉血管内炎症是冠心病发病的关键因素,而炎性细胞因子释放至冠状动脉周围(简称冠周)的脂肪组织,可影响脂肪细胞的分化以及脂肪细胞内的脂质含量,导致冠周脂肪CT衰减值改变[1, 2, 3]。脂肪衰减指数(FAI)已被证明与冠状动脉事件、斑块类型以及冠心病患者的预后相关[4, 5, 6]。影像组学可以从图像中提取大量参数,提供很多额外的信息,并且也是使影像诊断转向人工智能的基石[7, 8]。基于冠周脂肪影像组学已被证明相比FAI具有更高的诊断精确性[9, 10]。目前FAI或影像组学研究都是基于冠状动脉CT血管造影(CCTA)图像,但碘对比剂的副作用以及较高的费用限制了该技术的广泛应用[11, 12]。能否基于CT平扫图像冠周脂肪FAI以及影像组学分析行冠心病诊断,目前尚未见到相关研究报道。本文基于CCTA中的钙化积分(CCS)序列平扫图像,对冠周脂肪进行FAI以及影像组学分析,探究其对诊断非钙化斑块的可行性。
本文为病例对照研究,回顾性分析2019年8月1日至2020年7月31日苏州大学附属第一医院放射科行CCTA检查患者的临床影像学资料。在放射科影像归档和通信系统(PACS)内搜索CCTA检查患者中的“软斑块”以及“非钙化斑块”患者,作为病变组。在PACS系统内搜索CCTA检查患者中的“冠状动脉CTA未见明显异常”患者,作为对照组。病变组纳入标准:(1)图像显示清晰,冠状动脉内对比剂充盈良好;(2)冠状动脉左主干、左前降支或者右冠状动脉内有非钙化斑块。病变组排除标准:(1)病变所在支CCS序列有搏动伪影;(2)病变所在支另有钙化斑块;(3)病变所在支有支架植入;(4)患者有心脏起搏器或者人工金属瓣膜;(5)非钙化斑块位于心肌桥位置;(6)冠状动脉近段50 mm内有心肌桥;(7)冠状动脉畸形。对照组纳入标准:(1)图像显示清晰,冠状动脉内对比剂充盈良好;(2)CCTA未见明显异常。对照组排除标准:(1)CCS任意一支冠状动脉有搏动伪影;(2)冠状动脉左前降支近段50 mm内有心肌桥;(3)患者有心脏起搏器或者人工金属瓣膜;(4)冠状动脉畸形。病变组共纳入了206例355支冠状动脉,对照组共纳入255例510支冠状动脉。纳入的两组患者,按照纳入的冠状动脉总数865支,按7∶3的比例随机分为训练组和测试组,训练组共606支冠状动脉,测试组共259支冠状动脉。本研究已通过苏州大学附属第一医院伦理委员会的批准(2020-274)。
1. CCTA扫描方案:采用Revolution CT(美国GE公司)进行CCTA的动态容积扫描。CCTA以及CCS扫描参数:管电压100 kV,管电流350~600 mA,重建厚度0.625 mm。扫描范围:气管隆突至心尖下2 cm。采用非离子对比剂碘克沙醇以4.5~5 ml/s经肘静脉注入50~60 ml,注射完毕后追加40~50 ml生理盐水。
2. 冠周脂肪勾画分割:首先通过CCTA的曲面重建(CPR)图像确定病变组与对照组的冠状动脉情况(图1A、1B),再观察CCTA横断位图像中冠状动脉开口10~50 mm范围的冠状动脉(图1C、1D),之后采用Perivascular Fat Analysis Tool软件(中国数坤科技有限公司)勾画纳入的每一例患者CCS图像上的左右冠状动脉(图1E、1F),左冠状动脉以左主干起始,从冠状动脉开口处10 mm出发至左前降支,连续勾画40 mm;右冠状动脉从开口处10 mm出发,连续勾画40 mm,左回旋支因其走形迂曲并且周围脂肪较少,不予评估[5]。病变组勾画纳入的每一支冠状动脉;对照组统一勾画每一例患者的左右冠状动脉。勾画完毕后,使用Perivascular Fat Analysis Tool软件的Fat Segmentation功能,自动生成冠周的脂肪(CT值范围:-190~-30 HU)(图1G、1H)。
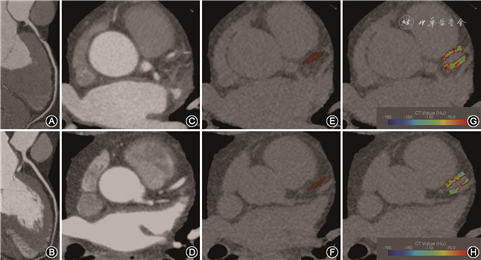

3. 影像组学特征提取:勾画完毕生成冠周脂肪感兴趣区(ROI)后,使用Perivascular Fat Analysis Tool软件保存ROI,随后使用Calculate Radiomics(影像组学计算)功能导出冠周脂肪的影像组学参数。
4. 影像组学分析:首先对提取的组学特征使用最小冗余最大相关(mRMR)去除冗余和不相关的特征,保留30个特征。然后使用最小绝对收缩与选择算子(LASSO)选择优化的子集特征构建最终的影像组学模型。
使用R软件(http://www.Rproject.org, 版本:3.5.1)进行统计分析。年龄、FAI值符合正态分布,以表示,采用独立样本t检验进行两组间比较。性别、高血压、高血脂、高血糖等定性资料采用率和频数描述,组间率的比较采用χ²检验。使用受试者工作特征(ROC)曲线评估模型的诊断效能。双侧检验,检验水准α=0.05。
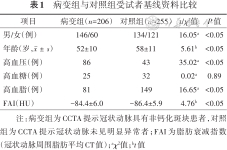
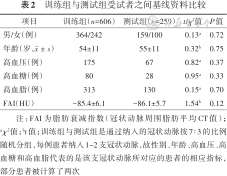
病变组206例患者中,男性146例,年龄(52±10)岁,其中有86例高血压患者、25例高血糖患者及81例高血脂患者,FAI值为(-84.4±6.0) HU;对照组255例中,男性134例,年龄(58±11)岁,其中有43例高血压患者、32例高血糖患者及149例高血脂患者,FAI值为(-86.4±5.9) HU;除高血糖患者数量以外,其余指标二组差异均具有统计学意义(均P<0.05)(表1)。训练组606支冠状动脉中有364支对应的患者为男性,年龄(54±11)岁,其中有175支对应的患者具有高血压、80支对应的患者具有高血糖、313支对应的患者具有高血脂,FAI值为(-85.4±6.1) HU;测试组259支冠状动脉中有159支对应的患者为男性,年龄(55±11)岁,其中有67支对应的患者具有高血压、28支对应的患者具有高血糖、130支对应的患者具有高血脂,FAI值为(-86.1±5.7) HU。两组间所有指标差异均不具有统计学意义(均P>0.05)(表2)。
病变组与对照组受试者基线资料比较
病变组与对照组受试者基线资料比较
| 项目 | 病变组(n=206) | 对照组(n=255) | t/χ²值 | P值 |
|---|---|---|---|---|
| 男/女(例) | 146/60 | 134/121 | 16.05a | <0.05 |
| 年龄(岁,) | 52±10 | 58±11 | 5.61b | <0.05 |
| 高血压(例) | 86 | 43 | 35.02a | <0.05 |
| 高血糖(例) | 25 | 32 | 0.02a | 0.89 |
| 高血脂(例) | 81 | 149 | 16.65a | <0.05 |
| FAI(HU) | -84.4±6.0 | -86.4±5.9 | 4.76b | <0.05 |
注:病变组为CCTA提示冠状动脉具有非钙化斑块患者,对照组为CCTA提示冠状动脉未见明显异常者;FAI为脂肪衰减指数(冠状动脉周围脂肪平均CT值);aχ²值;bt值
训练组与测试组受试者之间基线资料比较
训练组与测试组受试者之间基线资料比较
| 项目 | 训练组(n=606) | 测试组(n=259) | t/χ²值 | P值 |
|---|---|---|---|---|
| 男/女(例) | 364/242 | 159/100 | 0.13a | 0.72 |
| 年龄(岁,) | 54±11 | 55±11 | 0.32b | 0.75 |
| 高血压(例) | 175 | 67 | 0.82a | 0.37 |
| 高血糖(例) | 80 | 28 | 0.95a | 0.33 |
| 高血脂(例) | 313 | 130 | 0.15a | 0.70 |
| FAI(HU) | -85.4±6.1 | -86.1±5.7 | 1.54b | 0.12 |
注:FAI为脂肪衰减指数(冠状动脉周围脂肪平均CT值);aχ²值;bt值;训练组与测试组是通过纳入的冠状动脉按7∶3的比例随机分组,每例患者纳入1~2支冠状动脉,故性别、年龄、高血压、高血糖和高血脂代表的是该支冠状动脉所对应的患者的相应指标,部分患者被计算了两次
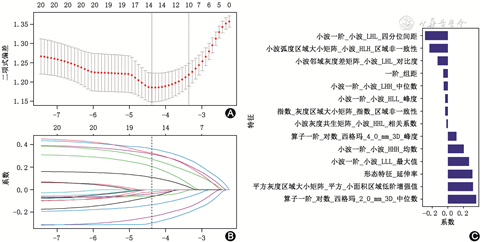
首先使用mRMR去除冗余和不相关的特征,在1 692个特征中保留30个特征。随后使用LASSO回归对影像组学特征进行筛选,利用交叉验证选择最优模型参数λ(图2A),得到的最佳λ值为0.012 5,ln(λ)=-4.38。利用得到的λ值筛选出具有非零系数的特征进行组学建模(图2B),最后筛选出来用于建模的14个组学特征(图2C)。

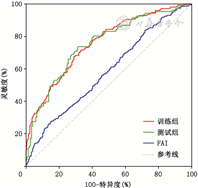
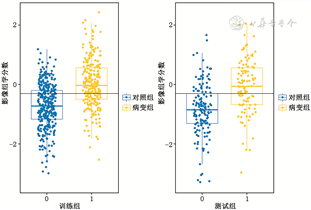
根据FAI值得到的ROC的AUC值为0.58;使用影像组学模型得到的ROC曲线,训练组AUC值为0.76,测试组AUC值为0.75(图3)。训练组的准确度、灵敏度、特异度、阳性预测值、阴性预测值分别为69.6%、67.5%、71.1%、62.0%、75.8%,测试组的准确度、灵敏度、特异度、阳性预测值、阴性预测值分别为70.3%、63.2%、75.2%、63.8%、74.7%(表3)。模型预测冠状动脉非钙化斑块准确性的散点图中,实线以上表示模型判别为病变组,实线以下表示模型判别为对照组;蓝点代表实际对照组,黄点代表实际病变组(图4)。

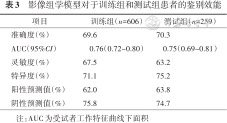
影像组学模型对于训练组和测试组患者的鉴别效能
影像组学模型对于训练组和测试组患者的鉴别效能
| 项目 | 训练组(n=606) | 测试组(n=259) |
|---|---|---|
| 准确度(%) | 69.6 | 70.3 |
| AUC(95%CI) | 0.76(0.72~0.80) | 0.75(0.69~0.81) |
| 灵敏度(%) | 67.5 | 63.2 |
| 特异度(%) | 71.1 | 75.2 |
| 阳性预测值(%) | 62.0 | 63.8 |
| 阴性预测值(%) | 75.8 | 74.7 |
注:AUC为受试者工作特征曲线下面积

冠心病患病率和死亡率持续上升[13],尤其是一些无症状或者症状轻微的患者因未能及时诊断而突发猝死。尽管CCTA在冠心病筛查和诊断中的作用越来越受到重视[14],但是受制于碘对比剂的风险及对CT设备性能要求高等原因,CCTA尚未能用于大规模人群筛查。与之相比,胸部CT平扫已成为肺癌大规模筛查的手段,且人工智能的应用大大提高了肺小结节的检出效率[15]。本研究的价值在于,有望利用胸部CT平扫的数据,借助本研究的方法,与已经大量应用的肺小结节人工智能检测联动,开展针对冠周脂肪影像组学人工智能分析,预警冠状动脉斑块特别是风险相对更高的非钙化斑块的存在。
本研究的理论基础在于冠周脂肪组织与冠状动脉管壁直接接触,冠状动脉血管炎症可通过旁分泌影响冠周脂肪。因此,冠周脂肪的CT值及其特征变化可以反映斑块内炎症程度,由此推测斑块的稳定性,已被基于CCTA的研究所证实[4,10]。由于平扫上的冠状动脉与周围组织缺乏对比,无法在重建时自动识别,因此依附于冠状动脉的冠周脂肪同样无法被计算机自动识别进而分析,这是研究的难点。本研究首次使用了数坤科技有限公司最新开发的Perivascular Fat Analysis Tool软件,使用手动的方式勾画了所需要评估的冠状动脉,通过软件自动生成冠周脂肪的ROI,从而解决了基于平扫研究冠周脂肪的技术性问题,使该研究具有可行性。
与CT常规影像学特征相比,影像组学特征能够以较低的成本客观定量地获取更多关于冠周脂肪内部异质性的信息,有助于预测临床结果[16]。本研究从冠周脂肪中提取了1 692个特征,并最终筛选出了14个最有价值的特征建立了影像组学模型,最终模型在测试组中达到了0.75的曲线下面积和70.3%的准确度。其中这14个特征中,基于小波变换的纹理特征占了8个。单纯从曲线下面积和准确度的值来说,诊断效能确实不够高。其原因可能是部分稳定性冠心病患者的冠周脂肪会恢复到与正常人相似,而一些冠状动脉内存在早期炎症但并未在冠状动脉管壁形成斑块的患者冠周脂肪同样会与病变者相似,从而影响了诊断效能。
本研究技术方法不直接显示非钙化斑块,只是提示或预警冠状动脉非钙化斑块的存在,仅作为一个初筛检查。但此技术可以将可疑患者引导向CCTA检查,从而极大地提高CCTA检查的阳性率和针对性。既不增加辐射,又节约了医疗资源和成本,是一个理念和技术上的探索和突破。
本研究还存在下列不足:(1)本研究为单中心回顾性研究,患者人群和影像学方法存在异质性,可能存在选择偏倚,有待于未来多中心研究验证组学模型;(2)本研究模型建立在冠状动脉CCS平扫基础上,尚不能直接采用普通胸部CT平扫数据,需要采取相应的技术克服心脏搏动伪影的影响,这也是我们下一步研究的重点。
总之,与现有基于CCTA的冠周脂肪研究相比[3, 4, 5, 6,9, 10],本研究尝试使用无需造影剂的平扫图像,通过冠周脂肪的影像组学分析,初步表明该方法技术对平扫上无法显示的非钙化斑块的检测具有可行性,有望成为诊断冠状动脉非钙化斑块的一个影像生物标志,有助于冠心病早发现、早诊断和早治疗。诚然,本研究尚处于初步探索阶段,许多问题还有待解决,方法和技术还需要完善,但研究结果仍然令人鼓舞。相信随着技术进步和研究深入,最终有望实现一次胸部CT平扫完成冠心病、肺癌“双筛查”的目的。
所有作者均声明不存在利益冲突



























