
近年来,即穿型人工血管的应用是血液透析用人工血管材料领域的一大进展。美国Gore公司的ACUSEAL™人工血管是国内上市使用的首款即穿型人工血管,自2016年起在国内应用,由于其中间层硅胶结构,管壁较厚,在应用过程中逐渐发现其对血管直径要求高、夹层、隧道过浅,可能导致皮肤缺血坏死的一些缺陷,从而影响其广泛应用。Flixene™是国内上市的第二款即穿型人工血管,上海中医药大学附属龙华医院血管外科于2019年8月首次使用,由于其结构不同于ACUSEAL™,从而规避了ACUSEAL™的一些缺陷,本文就我中心2例患者的应用体会汇报如下。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
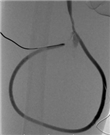
患者1 男性,63岁。因右颈内带隧道带涤纶套(tunnel-cuffed catheter,TCC)血透导管感染2个多月于2019年7月31日入院。血透通路史:患者2015年10月起因糖尿病肾病大量蛋白尿、低蛋白血症,出现全身浮肿,内科药物治疗效果不佳,遂行右颈内无隧道和涤纶套透析导管(non-cuffed catheter,NCC)临时血透4次后拔除导管。2015年12月再次出现全身浮肿,行右股NCC。至2016年1月拔除右股NCC,行右颈内TCC。2019年5月右颈内TCC感染,出现导管相关性菌血症,外院予全身性抗感染治疗及抗生素封管2周。入院后行四肢静脉造影示上腔静脉闭塞,奇静脉开放,导管尖端位于上腔静脉奇静脉开口处。下肢中心静脉通畅。患者双上肢无合适浅静脉行自体动静脉内瘘。在外周及导管血培养阴性的前提下于2019年8月8日神经阻滞麻醉下行右下肢股浅动脉-股浅静脉即穿型AVG成形术(6 mm×500 mm,Flixene,美国Atrium公司)。术后24.5 h使用17G针穿刺人工血管透析,止血时间8 min,穿刺点无渗血。并于2019年8月12日拔除右颈内TCC,2019年8月22日出院。无围术期感染、伤口延迟愈合,无单神经病变及动脉缺血发生。术后随访1年,术后8个月造影显示静脉吻合口稍狭窄,穿刺点无狭窄(图1)。

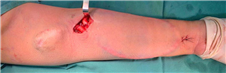
患者2 女性,50岁。因左上肢自体动静脉内缺乏静脉穿刺点于2020年7月28日入院。血透通路史:患者2009年3月因药物性肾损行左腕部桡动脉-头静脉AVF,6周后启用内瘘行规律血液透析。2009年6月因内瘘流量不佳在外院行左肘下桡动脉-正中静脉自体动静脉瘘。入院后于2020年7月30日在臂丛麻醉下行左前臂肱动脉-正中静脉即穿型AVG成形术(6 mm×500 mm,Flixene,美国Atrium公司)(图2)。术后72 h使用17G针穿刺人工血管透析,穿刺点无渗血。于2020年8月13日出院。无围术期感染、伤口延迟愈合,无单神经病变及动脉缺血发生。

常用的血液透析血管通路有AVF、AVG和中心静脉导管[1]。三种方式中,无论是AVF还是传统的AVG,都无法术后立即使用,需等待“成熟”。只有血液透析导管可以术后马上使用,但其又带来感染、中心静脉狭窄、闭塞等并发症,尤其是中心静脉病变可能最终导致无法建立任何一条血透通路。近年来,即穿型人工血管的应用是血液透析用人工血管材料领域的一大进展。有别于传统的聚四氟乙烯膨体(expanded polytetrafluoroethylene,ePTFE)人工血管,即穿型人工血管通过对其管壁的特殊结构设计,降低穿刺针眼出血的风险,无需等待人工血管与皮下组织纤维愈合的2周时间,可以在手术后立即穿刺透析,其最大的意义在于减少过渡期血液透析导管的使用,从而保护患者的中心静脉资源[2]。《中国血液透析用血管通路专家共识(第2版)》明确建议“对于已有中心静脉疾病的患者,其残存的中心静脉资源非常珍贵,如需建立移植物动静脉瘘,建议使用即穿型人工血管,以避免过渡期的中心静脉置管”[1]。
目前国际上已有五种即穿型人工血管产品:Vectra™(美国Thoratec公司)、Flixene™(美国Atrium公司)、Rapidax™(英国Vascutek)、Avflo™(以色列Nicast公司)和Acuseal™(美国Gore公司)[3],其中Acuseal™和Flixene™已批准在国内上市。国内首款上市的是Acuseal™人工血管,病例数相对较多,在使用中也发现一些问题,和其本身管壁结构相关,其管壁为三层结构,中间为硅胶层,内壁为含肝素的薄层ePTFE,外壁为ePTFE,管壁相应较厚。在临床实践中,我们发现:(1)Acuseal™管壁较厚,较僵硬,相对缝合要求高,需要确保垂直进针,全层外翻缝合,否则内壁薄层ePTFE容易掀起,造成中层硅胶裸露,可能引起继发血栓;同时与传统人工血管比较,对流出道静脉直径要求更高,建议静脉支径要求从3 mm提高到4 mm。(2)Acuseal™三层结构并不紧密,国内外多个中心均发现该血管管壁有分层现象发生,导致人工血管血栓形成。Suemitsu等[4]报道了115例Acuseal™人工血管的病例,随访21个月,有6例(5.1%)出现人工血管壁分层现象,分层发生的部位有穿刺区域,也有非穿刺区域。张丽红等[5]报道45例Acuseal™人工血管,4例出现分层。这些分层通过支架植入或置换人工血管得以恢复管腔。这也对血透护理穿刺人员提出更高要求。(3)局部皮肤缺血坏死。在本中心最初病例中,有2例病例出现隧道过浅和局部皮肤坏死[6]。本中心有千余例人工血管动静脉瘘的建立经验,这些即穿型人工血管的手术操作流程同传统人工血管相同,之所以出现皮肤缺血坏死,我们推测传统的人工血管移植物材料为ePTFE,电镜下呈现由结节和纤维组成的多孔性结构。正常情况下,当移植物被植入皮下后,组织受损机体自身发生修复,周围成纤维细胞集聚、分裂、增生,连同新生毛细血管一起长入孔洞,同时成纤维细胞可分泌基质、胶原,人工血管周围被纤维组织包裹[7]。而Acuseal™在内层和外层ePTFE之间有一层由硅胶材料构成的弹性膜,因此外周组织不能连同新生毛细血管一起穿透硅胶长入孔洞,尽管其外层微孔设计促进皮下组织与人工血管愈合,但不似传统人工血管融为一体。在再手术病例中也得到验证,Acuseal™和周围组织粘连并不紧密。这样在相同条件下,其发生局部缺血坏死及感染的风险较传统人工血管高,尤其是皮下脂肪少及组织薄弱的地方更易发生局部缺血坏死,因此在皮下脂肪薄的病例中不建议应用Acuseal™。(4)由于Acuseal™缝合要求高,是否静脉吻合口狭窄发生率会高于普通血管?张丽红等[5]将45例Acuseal™与同时期进行的75例肝素涂层人工血管做对照,认为两组间6、12个月初级及初级辅助通畅率差异均有统计学意义,Acuseal™组通畅率低于普通肝素涂层组。我中心37例Acuseal™半年及1年初级通畅率分别为(65.1±8.2)%和(46.9±10.1)%,与张丽红等报道相近[8]。但目前尚缺乏RCT研究。
Flixene™是国内上市的第二款即穿型人工血管,该款人工血管的管壁结构与Acuseal™不同,其三层均由ePTFE材料构成,只是中间层密度更高,达到减少穿刺后渗血的要求。因此该款人工血管不存在管壁分层的问题。在我们的实际应用中,均可术后早期穿刺使用,无针眼渗血、皮下血肿发生,护理操作同普通人工血管,容易穿刺。管壁较Acuseal™柔软、薄,容易缝合,与缝合传统人工血管差别不大。图2显示病例2皮下隧道非常表浅,但该病例皮肤愈合良好,未出现皮肤坏死。病例1已随访1年,术后8个月造影显示穿刺点无狭窄,仅常见的静脉吻合口狭窄,无感染、窃血、假性动脉瘤等其他并发症。文献报道显示Flixene™和传统人工血管通畅率相仿。Sutaria 和Gilbert[9]报道的141例植入Flixene病例的1年初级通畅率、初级辅助通畅率、次级通畅率分别为48.7%、56.6%、83.6%。Hinojosa等[10]报道了24例植入Flixene病例,12个月的初级通畅率为41%。相关Meta分析报道,Flixene人工血管术后12个月初级通畅率为43.3%(95%CI:31.6~55.4),次级通畅率为73.4%(95%CI:63~82.7)[11]。另外,感染发生率也不劣于传统人工血管。Sutaria 和Gilbert[9]报道的141例建立Flixene即穿型人工血管患者中,8例(5.7%)发生了移植物感染。我们的初步临床应用显示Flixene™是又一款安全、有效的即穿型人工血管,某些特性还优于Acuseal™。在手术操作中,Flixene产品自带Slider移植体放置系统,人工血管一端具有与隧道器预链接的接头。其隧道器通过性能好,弯度合适,但不适用于其他6 mm直径人工血管产品。Flixene™人工血管由柔软、透明的聚乙烯保护性操作封膜保护,待人工血管全部埋于隧道后才取出保护性封膜。可减少置入时牵拉对组织的损伤和对人工血管本身的损伤,从而降低术后水肿、感染的并发症;还可有效防止置入过程中人工血管的污染可能,从而降低手术相关感染风险。术中需注意:(1)确保预链接接头、保护性封膜完整拿出;(2)在剪切保护套时,切勿剪切人工血管壁的任何部分。
本中心的初步临床应用显示Flixene™是又一款安全、有效的即穿型人工血管,更多数据还有待更大样本及更长时间的随访结果。
所有作者均声明不存在利益冲突。



























