
探讨白蛋白结合型紫杉醇联合表柔比星和环磷酰胺在乳腺癌新辅助化疗中的有效性和安全性。
回顾性分析陕西省肿瘤医院2018年8月至2019年11月行新辅助化疗及手术治疗的48例乳腺癌患者的临床病理资料。主要观察指标为病理完全缓解(pCR)率、客观缓解率(ORR)及临床获益率(CBR)。次要观察指标为化疗不良反应。
所有患者既定化疗周期未完成率为10.4%(5/48)。pCR率为31.2%(15/48),ORR为87.5%(42/48),CBR为95.8%(46/48)。pCR率在患者年龄、临床分期、组织学分级、cN分期及人表皮生长因子受体2(HER2)状态分组中差异均无统计学意义(均P>0.05),在Ki-67高表达组(Ki-67阳性指数≥30%)中更高[46.7%(14/30)比16.7%(3/18),χ2=4.427,P=0.035]。常见的化疗不良反应为白细胞减少(93.8%,45/48)、中性粒细胞减少(93.8%,45/48)、肌肉关节疼痛(27.1%,13/48)、乏力(22.9%,11/48)、周围神经病变(18.8%,9/48)和恶心呕吐(18.8%,9/48),主要为1~2级化疗不良反应。总体3~4级化疗不良反应发生率为18.8%(9/48)。
白蛋白结合型紫杉醇联合表柔比星和环磷酰胺在乳腺癌新辅助化疗中可以取得较高的pCR率,且耐受性好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乳腺癌是女性最常见的恶性肿瘤,也是恶性肿瘤相关死亡的主要原因[1]。新辅助化疗后,患者可获得病理完全缓解(pCR),从而改善远期生存,尤其是对于三阴性和人表皮生长因子受体2(HER2)阳性乳腺癌患者[2,3]。紫杉类药物常联合蒽环类药物用于乳腺癌的新辅助化疗。普通溶剂型紫杉醇因助溶剂的使用增加了变态反应、神经毒性等药物不良反应。而且类固醇类激素的使用也增加了肥胖、失眠、糖尿病的发生。白蛋白结合型紫杉醇作为新型紫杉类药物,通过白蛋白受体(GP60)和肿瘤细胞外间质中富含半胱氨酸酸性分泌蛋白(SPARC)提高了肿瘤组织的药物浓度,减少了药物在肿瘤外组织中的分布[4]。既往研究证实,白蛋白结合型紫杉醇在晚期乳腺癌中较普通溶剂型紫杉醇具有更高的客观缓解率(ORR)和无进展生存(PFS)率[5,6]。为研究白蛋白结合型紫杉醇在乳腺癌新辅助化疗中的治疗效果,我们回顾性分析了48例乳腺癌患者的临床病理资料,现报道如下。
回顾性分析陕西省肿瘤医院乳腺科2018年8月到2019年11月行新辅助化疗及手术治疗的48例乳腺癌患者的临床病理资料。所有患者均为女性,年龄(48.3±8.6)岁,其中Ⅱ期30例,Ⅲ期18例;cN0期3例,cN1期33例,cN2期12例;HER2阳性19例,HER2阴性29例;组织学分级Ⅱ级40例,Ⅲ级8例;Ki-67高表达(Ki-67阳性指数≥30%)30例,低表达(Ki-67阳性指数<30%)18例。新辅助化疗前行空心针穿刺活组织检查证实为浸润性乳腺癌且明确雌激素受体(ER)、孕激素受体(PR)和HER2表达状态。腋窝淋巴结cN1期或cN2期在化疗前空心针穿刺活组织检查证实为癌转移。所有患者均于新辅助化疗结束后2~4周完成乳腺癌改良根治术。本研究符合2013年修订的《赫尔辛基宣言》的相关要求,患者均签署知情同意书。
纳入标准:(1)年龄18~70岁;(2)活组织检查证实为浸润性乳腺癌;(3)完成乳腺癌改良根治术且术后病理资料完整;(4)临床分期T2~4N0~2,治疗过程中无远处转移。排除标准:(1)预期寿命<6个月;(2)术后病理资料不详;(3)治疗过程中发生远处脏器转移;(4)未完成手术治疗。
所有患者均接受白蛋白结合型紫杉醇联合表柔比星及环磷酰胺治疗,表柔比星90 mg/m2,环磷酰胺600 mg/m2,每3周1次,共4个周期。序贯白蛋白结合型紫杉醇260 mg/m2,每3周1次,共4个周期。白蛋白结合型紫杉醇初始治疗时均给予足量化疗剂量,因不良反应可减量至220 mg/m2,如减量后仍无法耐受或不良反应较重则中断化疗。HER2阳性患者随白蛋白结合型紫杉醇给予曲妥珠单抗6 mg/kg(首剂8 mg/kg),每3周1次。既定新辅助化疗8个周期,于末次化疗结束后2~4周完成乳腺癌改良根治术。
主要观察指标为pCR率、ORR及临床获益率(CBR);次要观察指标为化疗不良反应。疗效评价依据实体瘤疗效评价标准(RECIST)1.1版。pCR定义为乳腺原发灶和区域淋巴结均无恶性肿瘤学证据或仅存原位癌成分。化疗不良反应评价参考世界卫生组织(WHO)化疗不良反应分级标准。
统计分析采用GraphPad Prism Version 5软件。计量资料满足正态分布,采用均数±标准差( ±s)表示。计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
±s)表示。计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
48例患者中,有5例(10.4%)未完成既定化疗周期,其中1例于5个周期化疗后超声评价为疾病进展,1例在6个周期化疗后合并4级骨髓抑制,1例于7个周期化疗后并发偶发室性早搏,2例分别于5个周期和6个周期后出现窦性心动过速。3例患者因4级骨髓抑制白蛋白结合型紫杉醇减量至220 mg/m2。
在48例患者术后病理评价中,pCR 15例,部分缓解27例,疾病稳定4例,疾病进展2例。pCR率为31.2%(15/48),ORR为87.5%(42/48),CBR为95.8%(46/48)。pCR率在患者年龄、临床分期、组织学分级、cN分期及HER2状态分组中差异均无统计学意义(均P>0.05);pCR率在Ki-67高表达的患者中更高[46.7%(14/30)比16.7%(3/18),χ2=4.427,P=0.035](表1)。
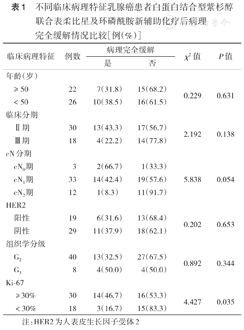
不同临床病理特征乳腺癌患者白蛋白结合型紫杉醇联合表柔比星及环磷酰胺新辅助化疗后病理完全缓解情况比较[例(%)]
不同临床病理特征乳腺癌患者白蛋白结合型紫杉醇联合表柔比星及环磷酰胺新辅助化疗后病理完全缓解情况比较[例(%)]
| 临床病理特征 | 例数 | 病理完全缓解 | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| 是 | 否 | |||||
| 年龄(岁) | ||||||
| ≥50 | 22 | 7(31.8) | 15(68.2) | 0.229 | 0.631 | |
| <50 | 26 | 10(38.5) | 16(61.5) | |||
| 临床分期 | ||||||
| Ⅱ期 | 30 | 13(43.3) | 17(56.7) | 2.192 | 0.138 | |
| Ⅲ期 | 18 | 4(22.2) | 14(77.8) | |||
| cN分期 | ||||||
| cN0期 | 3 | 2(66.7) | 1(33.3) | 5.838 | 0.054 | |
| cN1期 | 33 | 14(42.4) | 19(57.6) | |||
| cN2期 | 12 | 1(8.3) | 11(91.7) | |||
| HER2 | ||||||
| 阳性 | 19 | 6(31.6) | 13(68.4) | 0.202 | 0.653 | |
| 阴性 | 29 | 11(37.9) | 18(62.1) | |||
| 组织学分级 | ||||||
| G2 | 40 | 13(32.5) | 27(67.5) | 0.892 | 0.344 | |
| G3 | 8 | 4(50.0) | 4(50.0) | |||
| Ki-67 | ||||||
| ≥30% | 30 | 14(46.7) | 16(53.3) | 4.427 | 0.035 | |
| <30% | 18 | 3(16.7) | 15(83.3) | |||
注:HER2为人表皮生长因子受体2
常见的化疗不良反应分别为白细胞减少(93.8%,45/48)、中性粒细胞减少(93.8%,45/48)、肌肉关节疼痛(27.1%,13/48)、乏力(22.9%,11/48)、周围神经病变(18.8%,9/48)和恶心呕吐(18.8%,9/48),化疗不良反应主要为1~2级。总体3~4级化疗不良反应发生率为18.8%(9/48)。在4例(8.3%)4级骨髓抑制患者中,1例合并2级血小板减少,1例发生中性粒细胞减少性发热,均给予粒细胞集落刺激因子治疗后好转。13例肌肉关节疼痛患者中4例2级患者需要止痛治疗。心律失常发生率为6.2%(3/48),其中2例为窦性心动过速,1例为偶发室性早搏,均中断化疗。1例(2.0%)患者在首次用药过程中出现皮疹、轻度瘙痒,给予抗组胺治疗后好转,未影响后续治疗。口腔黏膜炎发生率为8.3%(4/48),均为1~2级。无治疗相关死亡患者(表2)。
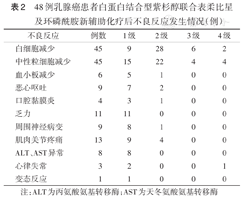
48例乳腺癌患者白蛋白结合型紫杉醇联合表柔比星及环磷酰胺新辅助化疗后不良反应发生情况(例)
48例乳腺癌患者白蛋白结合型紫杉醇联合表柔比星及环磷酰胺新辅助化疗后不良反应发生情况(例)
| 不良反应 | 例数 | 1级 | 2级 | 3级 | 4级 |
|---|---|---|---|---|---|
| 白细胞减少 | 45 | 9 | 28 | 6 | 2 |
| 中性粒细胞减少 | 45 | 15 | 22 | 4 | 4 |
| 血小板减少 | 6 | 5 | 1 | 0 | 0 |
| 恶心呕吐 | 9 | 7 | 2 | 0 | 0 |
| 口腔黏膜炎 | 4 | 3 | 1 | 0 | 0 |
| 乏力 | 11 | 11 | 0 | 0 | 0 |
| 周围神经病变 | 9 | 8 | 1 | 0 | 0 |
| 肌肉关节疼痛 | 13 | 9 | 4 | 0 | 0 |
| ALT、AST异常 | 8 | 8 | 0 | 0 | 0 |
| 心律失常 | 3 | 2 | 0 | 0 | 1 |
| 变态反应 | 1 | 1 | 0 | 0 | 0 |
注:ALT为丙氨酸氨基转移酶;AST为天冬氨酸氨基转移酶
既往研究报道紫杉醇或多西他赛联合化疗方案在新辅助化疗中的pCR率为8%~51.2%,多数集中在20%左右,不同的研究可能因为入组人群或pCR定义的差异导致结果不一[2,7,8,9]。主要的不良反应为骨髓抑制,其中3~4级中性粒细胞减少为40%~70%,3~4级中性粒细胞减少性发热约为10%,其次是乏力(15%)、恶心(13%)、口腔黏膜炎(9%)等[9,10]。另外一项研究报道了紫杉类联合蒽环类方案化疗1~2级周围神经病变发生率为54%[7]。白蛋白结合型紫杉醇作为一种新型的紫杉类药物,具有安全、高效、低敏的特点,在晚期乳腺癌解救化疗相关试验中被证实较普通溶剂型紫杉醇具有更高的ORR和PFS率[5,6,11]。
在本研究中,白蛋白结合型紫杉醇联合表柔比星和环磷酰胺化疗方案获得了较高的pCR率(31.2%)和ORR(87.5%),优于既往研究中溶剂型紫杉类联合蒽环类化疗的效果[2,7,8,9]。我们发现年龄、化疗前临床分期及组织学分级并未影响pCR。Ki-67高表达患者更易获得pCR,可能与肿瘤增长指数高提示肿瘤有丝分裂活跃有关。本研究中HER2状态并未发现与pCR有关,其原因可能与HER2阴性组中三阴性乳腺癌患者比例较高有关(57.1%)。虽然pCR率在腋窝临床分期分组中差异并未达到统计学意义,但cN0~1期患者pCR率更高(44.4%比8.3%)。本研究结果与既往研究结果相符[12]。GBG69临床试验比较了EC-P和EC-nab-P方案在早期乳腺癌新辅助化疗中的疗效,其中约90%的患者为cT1c~2期,约97%的患者为cN0~1期,主要观察点为两组的pCR率,结果显示nab-P组总体pCR率显著高于溶剂型紫杉醇组(38.4%比29.0%,P=0.000 65),中位随访49.6个月后,4年的无浸润性疾病生存(iDFS)率在nab-P组中明显优于溶剂型紫杉醇组(84.0%比76.3%,P=0.002),绝对获益率提高了7.7%[12,13]。
在不良反应方面,骨髓抑制是白蛋白结合型紫杉醇的主要不良反应,但是主要为1~2级白细胞减少、中性粒细胞减少。既往文献报道3级以上白细胞减少、中性粒细胞减少发生率为11%~78%[5,12,14,15]。本研究中3级以上白细胞减少、中性粒细胞减少发生率为16.7%,偏低的原因可能与本研究中50岁以下的患者居多有关(54.1%)。4级白细胞减少与临床研究报道相符[12,15]。肌肉关节疼痛发生率与既往研究相符,主要为1~2级不良反应,无3级以上不良反应,既往报道中3级以上肌肉关节疼痛发生率为1%~2%[10,12,14]。本研究中有1例患者用药过程中发生偶发室性早搏而停止化疗,回顾病史该患者患有7年冠心病及高血压病史,且在给予药物治疗后好转,提示化疗时要结合患者自身合并疾病特点个体化给药。周围神经病变在既往研究报道中被认为是白蛋白结合型紫杉醇相较于溶剂型紫杉醇发生率明显升高的并发症,3级以上周围神经病变发生率为7%~22%,是药物减量或延缓化疗的主要原因[11,12,14,15]。本研究中主要为1~2级(18.7%),未见3级以上周围神经病变患者,可能与我们在白蛋白结合型紫杉醇化疗中常规给予加压手套及手脚冰敷有关。一项Ⅱ期临床研究纳入了27例每周使用紫杉醇化疗的乳腺癌患者,探究针灸治疗对化疗所致的周围神经病变严重程度的影响,结果发现26例患者完成紫杉醇化疗且维持2级周围神经病变,提示针灸治疗或可减缓紫杉醇化疗所致的周围神经病变[16]。
本研究也存在一些缺点:首先样本量较小,影响结果的说服力;其次,因样本量较小,本研究未以激素受体和HER2状态细分亚组进行分析,可能是导致pCR在HER2阳性和阴性亚组中差异无统计学意义的原因;最后本研究也并未纳入入组患者的组织学类型,未能探究肿瘤组织学的异质性对pCR率的影响。综上所述,白蛋白结合型紫杉醇联合表柔比星和环磷酰胺的联合化疗方案在乳腺癌新辅助化疗中可以取得较高的pCR率,且耐受性好。
所有作者均声明不存在利益冲突



























