
探讨D-二聚体水平在弥漫大B细胞淋巴瘤(DLBCL)患者中的预后意义。
回顾性分析2015年1月至2019年6月天津市人民医院收治的70例初诊DLBCL患者的临床资料,根据受试者工作特征(ROC)曲线确定D-二聚体判断患者生存的最佳截断值,并将患者分组。比较不同D-二聚体水平患者间凝血相关指标及临床病理特征差异;采用Kaplan-Meier法对总生存(OS)进行单因素分析,采用Cox回归模型进行OS多因素分析。
根据ROC曲线,D-二聚体判断患者生存的最佳截断值为0.75 mg/L。D-二聚体≥0.75 mg/L组(36例)和<0.75 mg/L组(34例)中不同临床分期、国际预后指数评分、乳酸脱氢酶水平的患者比例比较,差异均有统计学意义(均P<0.05);血浆凝血酶原时间分别为(13.5±0.9)s和(13.0±0.8)s,活化部分凝血活酶时间分别为(37±5)s和(34±6)s,差异均有统计学意义(均P<0.05)。单因素生存分析显示,Ann Arbor分期Ⅲ~Ⅳ期、国际预后指数评分>2分、乳酸脱氢酶水平>240 U/L、有B症状、D-二聚体水平≥0.75 mg/L DLBCL患者5年OS率均降低(均P<0.05)。多因素Cox回归分析显示,D-二聚体≥0.75 mg/L为DLBCL患者OS独立危险因素(HR=0.368,95% CI 0.144~0.944,P=0.038)。
D-二聚体水平可作为判断DLBCL患者预后的临床指标,D-二聚体水平高患者预后不良。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤(NHL)中最常见的一种亚型,约占NHL的32.5%[1]。DLBCL具有高度异质性,目前有三个公认的预后评价指标被广泛应用:传统国际预后指数(IPI)、修订版IPI(R-IPI)、美国国立综合癌症网络国际预后指数(NCCN-IPI)[2,3,4],它们的局限性在于未考虑到淋巴瘤的异质性病理亚型。D-二聚体是交联纤维蛋白经纤溶酶介导所产生的降解产物。D-二聚体水平与多种恶性肿瘤的预后相关,包括肺癌、乳腺癌、胰腺癌、结直肠癌和卵巢癌等实体肿瘤[5,6,7,8,9]。但血浆D-二聚体在血液肿瘤,尤其是DLBCL患者中的临床意义和预后作用研究报道相对较少。本研究旨在探讨初诊DLBCL患者的D-二聚体水平与预后之间的相关性。
回顾性分析2015年1月至2019年6月天津市人民医院住院治疗的70例初诊DLBCL患者临床资料。纳入标准:(1)经病理确诊的DLBCL;(2)符合世界卫生组织(WHO)淋巴瘤分类诊断标准[10];(3)有完整的随访数据。排除标准:(1)有已知的先天性血栓疾病及凝血机制障碍;(2)有严重的心脑血管疾病;(3)有严重肝肾功能损害、炎症性肠病、结缔组织疾病、活动性感染等;(4)接受激素、抗凝、抗血小板聚集等药物治疗。本研究符合《赫尔辛基宣言》的相关要求,所有入组患者均签署知情同意书。70例DLBCL患者的临床病理资料见表1。
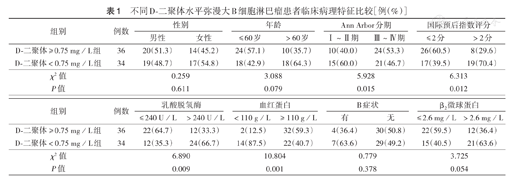
不同D-二聚体水平弥漫大B细胞淋巴瘤患者临床病理特征比较[例(%)]
不同D-二聚体水平弥漫大B细胞淋巴瘤患者临床病理特征比较[例(%)]
| 组别 | 例数 | 性别 | 年龄 | Ann Arbor分期 | 国际预后指数评分 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | ≤ 60岁 | >60岁 | Ⅰ~Ⅱ期 | Ⅲ~Ⅳ期 | ≤2分 | >2分 | ||
| D-二聚体≥ 0.75 mg/L组 | 36 | 20(51.3) | 14(45.2) | 24(57.1) | 10(35.7) | 10(40.0) | 24(53.3) | 26(60.5) | 8(29.6) |
| D-二聚体<0.75 mg/L组 | 34 | 19(48.7) | 17(54.8) | 18(42.9) | 18(64.3) | 15(60.0) | 21(46.7) | 17(39.5) | 19(70.4) |
| χ2值 | 0.259 | 3.088 | 5.928 | 6.313 | |||||
| P值 | 0.611 | 0.079 | 0.015 | 0.012 | |||||
| 组别 | 例数 | 乳酸脱氢酶 | 血红蛋白 | B症状 | β2微球蛋白 | ||||
|---|---|---|---|---|---|---|---|---|---|
| ≤ 240 U/L | >240 U/L | <110 g/L | ≥ 110 g/L | 有 | 无 | ≤ 2.6 mg/L | >2.6 mg/L | ||
| D-二聚体≥ 0.75 mg/L组 | 36 | 22(64.7) | 12(33.3) | 2(12.5) | 32(59.3) | 4(36.4) | 30(50.8) | 22(59.5) | 12(36.4) |
| D-二聚体<0.75 mg/L组 | 34 | 12(35.3) | 24(66.7) | 14(87.5) | 22(40.7) | 7(63.6) | 29(49.2) | 15(40.5) | 21(63.6) |
| χ2值 | 6.890 | 10.804 | 0.779 | 3.725 | |||||
| P值 | 0.009 | 0.001 | 0.378 | 0.054 | |||||
所有患者均接受类R-CEOP方案治疗:利妥昔单抗375 mg/m2,第0天;环磷酰胺750 mg/m2,第1天;表柔比星50 mg/m2,第1天;长春地辛2 mg/m2,第1天;泼尼松100 mg,第1天至第5天。对于体质较差的高龄患者酌情减量。21 d为1个周期,所有患者治疗中位周期数为6个(4~8个)。
根据NCCN指南中淋巴瘤疗效评价标准评价疗效。对患者生存情况采用电话、门诊随访,随访结束时间为2020年1月31日,中位随访时间26个月(4~60个月)。总生存(OS)时间定义为初诊至死于任何疾病、末次随访或观察截止的时间。
采用SPSS 22.0统计软件分析数据,D-二聚体判断患者生存的最佳截断值通过受试者工作特征(ROC)曲线计算;计数资料的比较采用χ2检验;计量资料呈正态分布,以均数±标准差( ±s)表示,两组间比较采用t检验;应用Kaplan-Meier法绘制生存曲线,log-rank法进行单因素生存分析,Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验;应用Kaplan-Meier法绘制生存曲线,log-rank法进行单因素生存分析,Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
70例DLBCL患者中位D-二聚体水平0.76 mg/L(0.18~12.01 mg/L),通过ROC曲线计算,判断患者生存的D-二聚体最佳截断值为0.75 mg/L,曲线下面积(AUC)为0.655(95%CI 0.528~0.782,P=0.034)。根据D-二聚体最佳截断值,将患者分为D-二聚体≥0.75 mg/L组(36例)和<0.75 mg/L组(34例)。两组中不同性别、年龄、B症状、β2微球蛋白水平的患者比例比较,差异均无统计学意义(均P>0.05);不同临床分期、IPI评分、乳酸脱氢酶水平、血红蛋白水平的患者比例比较,差异均有统计学意义(均P<0.05)(表1)。
D-二聚体≥0.75 mg/L组与<0.75 mg/L组的血浆凝血酶时间(TT)和血浆纤维蛋白原(FIB)水平差异均无统计学意义(均P>0.05),而血浆凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)差异均有统计学意义(均P<0.05)(表2)。
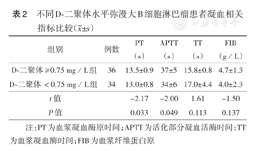
不同D-二聚体水平弥漫大B细胞淋巴瘤患者凝血相关指标比较( ±s)
±s)
不同D-二聚体水平弥漫大B细胞淋巴瘤患者凝血相关指标比较( ±s)
±s)
| 组别 | 例数 | PT(s) | APTT(s) | TT(s) | FIB (g/L) |
|---|---|---|---|---|---|
| D-二聚体≥ 0.75 mg/L组 | 36 | 13.5±0.9 | 37±5 | 15.8±0.8 | 4.7±1.3 |
| D-二聚体<0.75 mg/L组 | 34 | 13.0±0.8 | 34±6 | 17.0±4.4 | 4.0±2.3 |
| t值 | -2.17 | -2.00 | 1.61 | -1.50 | |
| P值 | 0.033 | 0.049 | 0.113 | 0.137 |
注:PT为血浆凝血酶原时间;APTT为活化部分凝血活酶时间;TT为血浆凝血酶时间;FIB为血浆纤维蛋白原
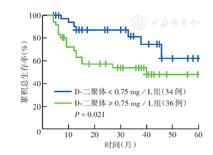
随访结束时,全部患者中死亡24例,死亡原因包括肿瘤相关因素(18例)、心肺疾病及其他因素(6例)。患者5年OS率为65.8%。Kaplan-Meier生存分析表明,D-二聚体≥0.75 mg/L组5年OS率低于D-二聚体<0.75 mg/L组(图1),Ann Arbor分期Ⅲ~Ⅳ期、IPI评分>2分、乳酸脱氢酶>240 U/L、有B症状患者5年OS率亦降低,差异均有统计学意义(均P<0.05)(表3)。多因素Cox回归分析结果表明,D-二聚体≥0.75 mg/L为DLBCL患者OS独立危险因素(HR=0.368,95%CI 0.144~0.944,P=0.038)(表4)。
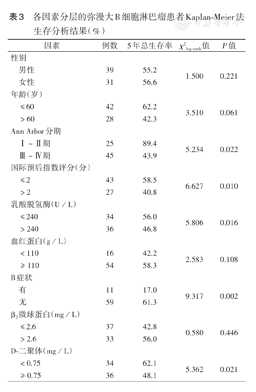
各因素分层的弥漫大B细胞淋巴瘤患者Kaplan-Meier法生存分析结果(%)
各因素分层的弥漫大B细胞淋巴瘤患者Kaplan-Meier法生存分析结果(%)
| 因素 | 例数 | 5年总生存率 | χ2log-rank值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男性 | 39 | 55.2 | 1.500 | 0.221 | |
| 女性 | 31 | 56.6 | |||
| 年龄(岁) | |||||
| ≤ 60 | 42 | 62.2 | 3.510 | 0.061 | |
| >60 | 28 | 42.3 | |||
| Ann Arbor分期 | |||||
| Ⅰ~Ⅱ期 | 25 | 89.4 | 5.234 | 0.022 | |
| Ⅲ~Ⅳ期 | 45 | 43.9 | |||
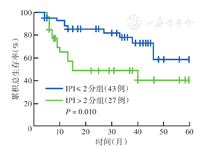
| 国际预后指数评分(分) | |||||
| ≤2 | 43 | 58.5 | 6.627 | 0.010 | |
| >2 | 27 | 40.8 | |||
| 乳酸脱氢酶(U/L) | |||||
| ≤ 240 | 34 | 56.0 | 5.806 | 0.016 | |
| >240 | 36 | 46.8 | |||
| 血红蛋白(g/L) | |||||
| <110 | 16 | 42.2 | 2.583 | 0.108 | |
| ≥ 110 | 54 | 58.3 | |||
| B症状 | |||||
| 有 | 11 | 17.0 | 9.317 | 0.002 | |
| 无 | 59 | 61.3 | |||
| β2微球蛋白(mg/L) | |||||
| ≤ 2.6 | 37 | 42.8 | 0.580 | 0.446 | |
| >2.6 | 33 | 56.0 | |||
| D-二聚体(mg/L) | |||||
| <0.75 | 34 | 62.1 | 5.362 | 0.021 | |
| ≥ 0.75 | 36 | 48.1 | |||
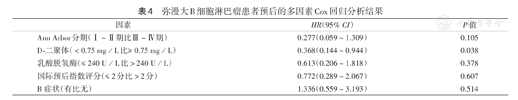
弥漫大B细胞淋巴瘤患者预后的多因素Cox回归分析结果
弥漫大B细胞淋巴瘤患者预后的多因素Cox回归分析结果
| 因素 | HR(95%CI) | P值 |
|---|---|---|
| Ann Arbor分期(Ⅰ~Ⅱ期比Ⅲ~Ⅳ期) | 0.277(0.059~1.309) | 0.105 |
| D-二聚体(<0.75 mg/L比≥ 0.75 mg/L) | 0.368(0.144~0.944) | 0.038 |
| 乳酸脱氢酶(≤ 240 U/L比>240 U/L) | 0.613(0.206~1.818) | 0.378 |
| 国际预后指数评分(≤ 2分比>2分) | 0.772(0.289~2.067) | 0.607 |
| B症状(有比无) | 1.336(0.559~3.193) | 0.514 |

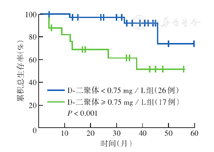
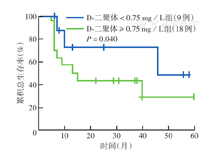
多因素分析中IPI评分不是与DLBCL患者OS相关的预后因素,因此本研究分别对IPI≤2分和IPI>2分患者的血浆D-二聚体水平进行了分层评估。Kaplan-Meier生存分析显示,IPI≤2分患者的5年OS率高于IPI>2分患者(58.5%比40.8%),差异有统计学意义(P=0.010)(图2)。进一步的亚组分析结果显示,在IPI≤2分患者中,D-二聚体<0.75 mg/L组的5年OS率高于D-二聚体≥0.75 mg/L组(74.2%比51.4%),差异有统计学意义(P<0.001)(图3);IPI>2分患者中,D-二聚体<0.75 mg/L组的5年OS率高于D-二聚体≥0.75 mg/L组(49.5%比32.8%),差异有统计学意义(P=0.040)(图4)。



D-二聚体是一个特异性的纤溶过程标志物。淋巴瘤患者往往存在不同程度的凝血与纤溶功能异常,研究表明伴有高凝状态的恶性肿瘤患者具有肿瘤负荷高、进展活跃、化疗反应低以及预后差等临床特点[11]。D-二聚体作为高凝和纤溶性指标,可能是肿瘤进展的预后因素。已有研究指出,D-二聚体可促进肿瘤细胞增殖、黏附和迁移,这也体现在高D-二聚体水平患者往往表现出更晚的临床分期[12]。本研究结果显示,D-二聚体≥0.75 mg/L组与<0.75 mg/L组的APTT和PT差异均具有统计学意义(均P<0.05),作为反映内源性与外源性凝血系统功能的重要指标,其异常提示D-二聚体≥0.75 mg/L患者的内、外源性凝血系统处于异常激活状态。
目前淋巴瘤与凝血系统异常之间的机制尚未明确,考虑可能与以下因素有关:(1)肿瘤细胞过度表达组织因子;(2)肿瘤细胞的浸润作用导致血管内皮损伤;(3)肿瘤患者抗凝与纤溶系统紊乱;(4)肿瘤细胞释放癌性促凝物;(5)肿瘤细胞高表达血管内皮生长因子。本研究结果显示,D-二聚体≥0.75 mg/L与患者临床分期Ⅲ~Ⅳ期、IPI评分>2分、乳酸脱氢酶>240 U/L、血红蛋白<110 g/L等不良临床特征相关;D-二聚体≥0.75 mg/L与患者OS率降低相关,单因素和多因素分析结果显示,D-二聚体≥0.75 mg/L是DLBCL患者预后的独立不良因素;在IPI评分≤2分和>2分的亚组分析中,D-二聚体≥0.75 mg/L组OS率低于D-二聚体<0.75 mg/L组。
Wróbel等[13]研究了52例初治NHL患者,结果表明NHL患者的D-二聚体水平高于对照组;IPI评分高危组患者的D-二聚体水平高于低危组和中危组患者;临床分期Ⅳ期患者的D-二聚体水平高于Ⅱ、Ⅲ期患者,本研究结果也显示D-二聚体≥0.75 mg/L患者具有临床分期晚、IPI评分高、乳酸脱氢酶异常升高等特点,提示与患者肿瘤高负荷正相关。Bi等[14]分析84例NK/T细胞淋巴瘤患者,发现高D-二聚体水平与较低的3年OS率相关(P<0.001),临床分期Ⅰ~Ⅱ期患者的3年OS率高于Ⅲ~Ⅳ期患者(68.0%比9.5%,P<0.001),并且通过高D-二聚体水平可以识别出早期患者中OS率显著降低的高危人群。该研究认为治疗前D-二聚体水平可作为NK/T细胞淋巴瘤患者预后的简单有效预测指标。Geng等[15]分析了D-二聚体对113例初治DLBCL患者生存的意义,结果表明,只有乳酸脱氢酶水平和年龄是影响患者预后的独立因素,仅在单因素分析中D-二聚体与患者的OS负相关,这可能是由于所设定样本量和变量不同、界定的临界值不同以及乳酸脱氢酶和年龄在预后中的主要影响掩盖了D-二聚体的重要性。Liu等[16]分析了254例DLBCL患者D-二聚体对预后的影响,发现D-二聚体可作为DLBLC患者OS的独立预测因子,这与本研究结果一致。Lekovic等[17]研究了42例原发性纵隔大B细胞淋巴瘤患者,发现静脉血栓栓塞患者D-二聚体水平较无静脉血栓栓塞患者升高,两组中位OS时间(45个月比93个月)差异有统计学意义。该研究认为高D-二聚体水平对原发性纵隔大B细胞淋巴瘤患者的生存有负面影响。姜文华等[18]分析425例NHL患者,并将这些患者分为低、中、高D-二聚体水平组,发现三组患者5年OS率分别为97.4%、86.1%、35.0%,认为高D-二聚体水平是NHL患者预后差的标志。
IPI评分于1993年被首次提出用于NHL,尤其是DLBCL,沿用至今。本研究结果表明,高D-二聚体水平可作为DLBCL患者预后的指标,D-二聚体联合IPI评分可进一步提高对DLBCL患者预后判断的准确性,是对IPI评分在利妥昔单抗时代的一种有力补充。考虑到本研究为小样本回顾性研究,结果可能存在一定偏倚,还需要大规模、前瞻性、多中心的研究来验证。
所有作者均声明不存在利益冲突



























