
食管动态反流监测是目前诊断GERD的金标准。准确的诊断需要建立在规范的操作之上,为提高食管反流监测的操作质量,中华医学会消化病学分会胃肠动力学组和大中华区胃肠动力联盟牵头制定本操作规范。本指南制定过程中邀请国内相关领域专家对国内外有关文献进行检索、讨论,并召开专家研讨会,确定指南的内容。本指南涉及食管反流监测的适应证、禁忌证、详细的操作流程和报告发放。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
食管动态反流监测是GERD诊断的金标准,该技术可用来检测胃内容物反流入食管的性质和程度,并可判断症状与反流的关联性。近年来,有学者通过食管动态反流监测技术评估食管黏膜屏障功能,并对功能性胃肠病进行分型,因此反流监测技术的应用领域正逐渐扩展。随着GERD在亚洲的发病率逐渐升高,食管动态反流监测技术在亚洲地区逐渐普及,但医师对其操作和结果的解读仍不规范,限制其进一步推广。为规范食管动态反流监测操作与应用,使其更好地服务于临床诊疗工作,中华医学会消化病学分会胃肠动力学组和大中华区消化动力联盟的专家们经过多次讨论,形成如下临床操作指南(成人),供临床医师操作时参考。
食管动态反流监测的历史最早可追溯至19世纪末,Reichman尝试将海绵置于烧心症状患者的食管下段,并在回收海绵时发现了酸性物质的浸润[1]。随着20世纪初玻璃pH计的问世,Tuttle与Grossman将pH计结合食管测压导管置入患者食管内,开创了动态监测食管反流的先河,由此食管pH值成为衡量胃食管反流严重程度的客观指标[1]。最初的食管动态反流监测设备为固定式,较为笨重,受检者在检查过程中必须卧床,无法维持日常活动。随着技术的发展,食管动态反流监测设备由固定式改良为小巧、轻便的便携式设备,受检者在检查过程中可维持日常活动和进食。pH导管也由原先的玻璃电极替换为锑电极,原材料的革新增加了导管可配置的传感通道数量,从而实现了对食管不同位置pH值的监测。1974年,Johnson和DeMeester[2]对健康人和有GERD症状的患者进行研究,提出了具有里程碑意义的标准,奠定了食管动态反流监测方法学的金标准:①食管pH值监测导管需置于食管下括约肌(lower esophageal sphincter, LES)上方5 cm处;②酸反流的定义为食管远端pH值降至<4;③DeMeester评分用于诊断GERD。随着对GERD研究的逐渐深入,非酸反流在GERD病理生理学机制中的作用引起了人们的重视。由于锑电极无法检测碱反流,1988年Baldini引入了基于分光光度计原理的胆红素测定设备(Bilitec 2000)用于监测胆汁反流[3],该技术通过检测特定波长下胆红素的特异性吸收峰,间接测量胆汁反流的严重程度。然而,胆红素监测的结果受反流物pH值、患者摄入食物种类的影响,并且由于胆红素是胆汁中的一个组分,以胆盐和胰酶等其他成分为主的胆汁反流无法通过胆红素测定设备检出,故无法直接反映胆汁反流情况。胆汁反流监测技术本身的局限性限制了胆汁反流监测的广泛应用[3]。20世纪90年代,阻抗监测技术被应用到食管动态反流监测中,相较传统的单纯pH值监测,多通道腔内阻抗联合pH值监测(multichannel intraluminal impedance and pH monitoring,MII-pH)技术既能反映反流物的性状、体积和反流高度,又有助于检出非酸反流[4,5,6],近年来被广泛应用。
无线食管动态反流监测的发展始于20世纪50年代,该技术通过内镜将胶囊固定在食管远端,使检查过程更接近生理状态。随着技术的发展,无线食管动态反流监测的胶囊体积愈发减小,并将pH值监测时间延长至48~96 h。然而,由于无线食管动态反流监测在国内的应用不如导管式监测广泛,本指南仍以介绍导管式食管动态反流监测为主。
食管动态反流监测设备包括监测导管、便携式监测记录仪和数据处理系统3个部分。监测导管根据其工作原理不同,分为pH值监测导管和阻抗-pH值监测导管(图1);根据导管电极的放置位置,又可分为远端食管反流、近端食管或咽喉部反流、胃内pH值监测导管。
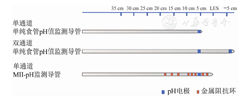

注:LES为食管下括约肌;MII-pH为多通道腔内阻抗联合pH值监测
pH值监测导管上方配置了pH传感器,传感器内含2个电极,分别为处于恒定电位的参比电极和对电极四周氢离子浓度极为敏感的指示电极,2个电极的电位差变化可指示电极四周氢离子浓度的改变。将pH值监测导管置入受检者食管内,食管内氢离子浓度的变化会引起传感器内电流的动态变化,电流信息经受检者随身佩戴的便携式记录仪保存,然后上传至计算机通过一定的程序转化为食管内pH值的变化信息,用于下一步的分析和报告生成。
MII-pH监测导管由1或2个pH电极和8个以上的金属阻抗环组成,每2个阻抗环形成1个阻抗通道。MII-pH监测导管所监测的食管腔内阻抗指食管内与传感器接触物质的导电性。传感器上相邻的2个金属阻抗环与接触物形成闭合环路,从而测量接触物的阻抗值。食管腔内各种内容物根据阻抗值高低依次为空气、食管壁、唾液、食物、胃内反流物,因此可通过阻抗值的高低判断当前食管腔内物质的性状,区分接触物为液体、气体或混合类型。另外,通过对各个阻抗通道的纵向分析,阻抗技术可以判断接触物的运动方向,从口侧到肛侧的顺行性阻抗变化即代表吞咽事件,从肛侧到口侧的逆行性阻抗变化即代表反流事件。将阻抗技术与pH值变化进行联合分析,可将反流事件分为酸反流(pH值<4)和非酸反流(pH值≥4)。
相比单纯pH值监测,MII-pH监测可以提供更多信息,如非酸反流、反流物的性状(液体、气体或混合)、反流高度、反流速度、反流物清除时间的情况。目前认为MII-pH监测是检测反流最为敏感的诊断方法。
根据导管上pH值监测电极放置位置的不同,可将食管动态反流监测设备分为远端食管反流监测、近端食管或咽喉部反流监测和胃内pH值监测。标准、统一的电极放置位置是监测结果可靠、准确的必要条件。
对于远端食管反流监测,电极通常置于食管远端LES上缘口侧5 cm处,此位置可避免电极在受检者吞咽、呼吸和一过性LES松弛的过程中落入胃内,并且目前绝大部分的诊断标准均是基于此位置的监测结果[7]。
目前暂无共识意见对近端食管或咽喉部反流监测的电极位置有定论。现有研究大多将近端食管反流监测电极置于距LES上缘20 cm处[8],咽喉部反流监测电极置于食管上括约肌(upper esophageal sphincter, UES)上缘至上缘近口侧2 cm处[9,10,11]。无法统一电极放置位置标准的原因是食管长度和LES位置存在较大的个体差异[8],目前技术无法实现近端电极放置位置的一致性。电极放置位置的不统一限制了近端食管或咽喉部反流监测结果在临床上的应用。
胃内pH值监测的电极一般置于胃底距离LES下缘肛侧7~10 cm处。胃内pH值监测可用于监测胃酸分泌情况,判断患者服药的依从性,或作为胃泌素瘤、消化性溃疡等胃酸异常分泌疾病的辅助诊断手段。
根据临床和科研需要,可分别选择单通道、双通道和多通道电极导管。单通道电极(即单纯食管pH值监测电极)一般用于监测远端食管的反流情况;在双通道电极中,一般1个电极用于监测食管远端反流情况,另1个电极则用于监测近端食管、咽喉部反流或胃内pH值的变化情况。
便携式记录仪的外形呈小盒状,受检者随身佩戴在腰间后即可在监测过程中自由活动,从而取得接近生理状态的监测数据。受检者可通过记录仪上的按键生成症状日志,记录监测时间内进食、体位改变和症状事件等。监测完毕后,将记录仪的信息上传至计算机内的数据处理系统,进行下一步的分析和报告生成。
1.需明确症状或食管黏膜损伤是否与反流相关。
2.具有反流相关症状,但抑酸剂治疗效果不佳。
3.评估反流的严重程度,以指导患者用药和预测疗效。
4.胃食管手术相关的评估,如抗反流手术的术前和术后评估,以及经口内镜下食管肌层切开术(peroral endoscopic myotomy, POEM)术后评估等。
5.功能性胃肠病的鉴别,如嗳气症、癔球症等。
1.鼻咽部或食管存在解剖结构明显异常的患者。
2.无法耐受导管的患者,这类患者可考虑换用无线pH值监测。
3.患有精神心理疾病或意识不清无法合作者,以及自行拔管不配合检查的患者。
4.严重凝血功能障碍、重度食管静脉曲张、心肺功能不全者,应慎重进行检查。
1.检查前需停用抗酸药(如铝碳酸镁、硫糖铝等)>1 d,停用胃肠道动力药物(如多潘立酮、莫沙必利、伊托必利等)和H2受体拮抗剂(如雷尼替丁、法莫替丁等)≥3 d,停用PPI(如埃索美拉唑、奥美拉唑、兰索拉唑、泮托拉唑、艾普拉唑等)和钾离子竞争性酸阻滞剂≥7 d。若患者既往未明确诊断GERD,建议停用抑酸剂,行食管动态反流监测;若患者已确诊GERD,为明确抑酸剂治疗失败的原因,可在服用抑酸剂的情况下行食管动态反流监测。
2.检查前禁食6~8 h。对于有明显吞咽困难的患者,检查前1 d晚餐应进流食,必要时延长禁食时间。
3.检查前需向患者了解病情、病史、症状,回顾检查前的上消化道造影和胃镜检查,了解是否存在解剖异常,排除禁忌证。
4.检查前向患者充分说明检查步骤,检查的意义和安全性,消除患者恐惧感,取得患者配合并签署知情同意书。
每次检查前更换新电池以确保电量充足,电极导管和便携式记录仪连接好后开启记录仪,对导管电极进行校正。校正完毕后,在记录仪上输入患者的检查编号和检查时间,并将记录仪上的按键定义为患者的主诉症状,一般食管动态反流监测的症状种类<2种,且仅记录发作性症状(如烧心、反酸、胸痛、嗳气、咳嗽等),而非持续存在症状(如咽部不适感、声嘶等)的发作情况。
(1)检查受检者鼻孔,选择通气较好的一侧进行置管。受检者取坐位,平静呼吸并保持上半身挺直,头部摆正,用表面麻醉剂麻醉受检侧鼻孔的鼻黏膜。(2)将导管轻柔地送入受检者鼻腔内,当导管触及咽后壁时嘱咐受检者低头、屈颈,使下颌贴近胸壁,随后继续进管。当导管接近咽喉部时,嘱咐患者吞咽以借助吞咽的力量使导管通过UES。(3)继续进管,将pH电极置于距LES上缘口侧5 cm处。电极的定位方法包括以下3种。①食管测压法:通过食管测压检查确定LES高压带,此处距鼻孔的长度即为LES的位置,该位置近口侧5 cm即为放置pH电极的准确位置。该方法能准确定位LES,因此首要推荐有条件的单位在反流监测前先进行食管测压以准确定位LES。②pH梯度法:检查时利用胃和食管内pH值的显著差异来确定pH电极的放置位置。先将导管插入至55~60 cm处,胃内pH值为1~2;随后往外牵拉导管,当pH值从1~2升至4~5,表明电极离开胃腔进入食管,记录此时导管距离鼻孔的长度即为LES位置;最后再往外牵拉5 cm即为pH电极的放置位置。该方法操作便捷,但受到受检者身高、LES长度的个体差异性,以及服用抑酸剂的影响,因此pH梯度法对LES定位不够准确,与测压法相比,误差约为±3 cm。③X线透视法:在无造影剂辅助条件下,取pH电极金属线与胃底穹隆线交点处为胃食管连接处,该点以上5 cm处即为X线透视法确定的电极放置位置。该方法较少单独使用,多作为食管测压法和pH梯度法的辅助手段。
当LES定位困难,如存在食管裂孔疝时,应尽量采用食管测压法对LES进行定位,如不具备食管测压的条件,可考虑使用经鼻内镜测量LES至鼻孔的距离,也可采用X线透视法进行辅助定位。
确定pH电极的放置位置后,将受检者面部的分泌物擦拭干净,用胶布将导管固定于面颊部,再将导管绕耳后经颈部固定并下行连接记录仪,最后将记录仪置入专用背包中,嘱受检者佩戴(图2)。
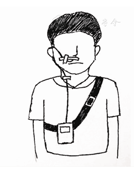

由于置管后异物刺激咽喉部容易导致唾液分泌增加,影响后续反流监测的结果,建议在置管后30 min再开始监测[12]。在开始监测前,应向受检者细致解释记录仪上按钮的意义,嘱咐并训练其在监测过程中正确按压信号按钮记录日志。记录内容包括进食起止时间(三餐),睡眠(卧位)和起床的时间,症状(如烧心、反酸、胸痛、嗳气、咳嗽等)的发作时间和服用药物的时间。必要时可在记录仪按钮上张贴文字标签提醒受检者。对于无法配合按压信号按钮的受检者,应给予纸质版日志卡,嘱咐其精确记录症状的发作时间,以及饮食和体位改变的起止时间(精确至秒)。检查期间,禁食酸性或碱性食物(如泡菜、西红柿等)和刺激性食物,禁饮酸性饮料、果汁和刺激性饮品(如咖啡、酒精等),可保持日常活动和进餐,但不得洗澡,以免损坏记录仪。
分析单纯食管pH值监测结果时,首先要人工浏览监测过程中是否存在影响结果准确性的人为或技术因素:①是否准确记录了进餐时间和进餐时间以外的液体吞咽(如较长一段时间出现pH值<4);②出现pH值漂移(pH值随着时间推移出现缓慢、有序的变化),该现象与校准失败、元件损坏有关;③pH电极的移位。若排除影响监测结果准确性的干扰因素,通过计算机程序的自动分析可得出初步的单纯食管pH值监测结果[15],后续再以人工分析的方式得出报告。分析指标主要包括食管酸暴露情况、DeMeester评分和症状-反流相关性评价参数。
食管动态反流监测没有直接量化反流至食管的胃液量,通常采用酸存在于食管内的时间评价反流的情况。酸暴露时间百分比(acid exposure time percentile, AET)是评估食管酸暴露情况最常采用的指标,该指标是指pH值<4的总时间占总监测时间的百分比。AET的值由软件自动分析生成,可重复性高。病理性酸暴露指患者的胃食管反流超出生理范围,患者所出现的症状、食管黏膜损伤和相关并发症可能是胃食管反流引起的,即存在GERD。AET的值超出正常参考值范围时,提示患者存在病理性食管酸暴露,可诊断为GERD。目前中国人群的AET的正常参考值为<4%;当AET≥4%时,考虑存在病理性酸暴露,提示GERD诊断[16]。西方国家在2018年里昂共识中提出当AET>6%时可为GERD诊断提供确切证据,而AET<4%则可排除GERD[17]。
其他反映食管酸暴露情况的参数如下:立位和卧位的AET(立位和卧位pH值<4的总时间分别占立位和卧位监测总时间的百分比),酸反流次数(pH值<4的发生次数),长酸反流次数(pH值<4持续5 min以上的次数),最长反流时间(pH值<4持续最长的时间)。
DeMeester评分是由总AET、立位AET、卧位AET、酸反流次数、长酸反流次数、最长反流时间6个食管酸暴露参数组成的综合评分。DeMeester评分≥14.72分提示食管存在病理性酸暴露。
评价症状-反流相关性的参数包括症状指数(symptom index,SI)和症状相关概率(symptom association probability,SAP)。分析症状-反流相关性参数时,以症状出现前后2 min为时间窗,若发生酸反流事件,则认为症状与该次酸反流相关。SI是酸反流相关症状发生次数与总症状发生次数的百分比。SI≥50%为阳性,提示患者症状与酸反流可能相关,但该指标没有将总酸反流次数计算在内,有可能因偶然关联而高估了症状与反流的相关性。SAP应用包含症状和酸反流的四格表卡方检验来计算[SAP=(1-P)×95%,其中P为卡方检验后得出的概率]。SAP>95%为阳性,提示症状与酸反流相关的可能性大。SI、SAP由分析软件提供,无需手动计算。
由于软件自动分析的MII-pH监测结果容易高估弱酸反流的次数(如将吞咽事件误认为反流事件),以及错误计算弱酸反流的症状关联参数,因此分析MII-pH监测结果时需同时采用人工分析。分析时可先应用软件的自动分析功能,然后手动以5或2 min的时间窗逐页检查遗漏的反流事件和剔除被误认为反流事件的吞咽事件。人工编辑分析结果后,计算机即可输出准确的监测结果。
MII-pH监测中反映食管酸暴露情况的指标与单纯pH值监测的相似,但MII-pH监测得出的AET值通常低于单纯pH值监测的结果,原因是MII-pH监测得出的AET是伴有阻抗提示反流事件的pH值<4的总时间占总监测时间的百分比。阻抗反流事件的人工分析方法见下节。
总反流次数的定义为所有类型反流事件的发生次数总和。分析总反流次数前,首先需了解如何识别单个反流事件,明确反流物的性质、反流物pH值的变化、反流高度和反流清除的情况。
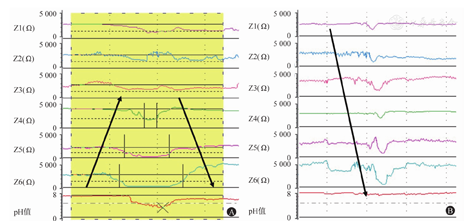
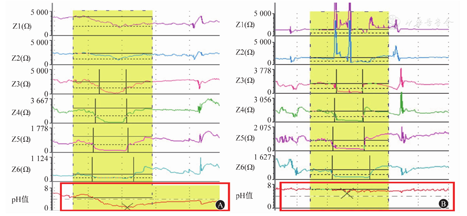
(1)反流事件的识别:反流事件需与吞咽事件进行鉴别。发生反流时,可观察到阻抗信号的改变是从远端通道至近端通道的逆行性变化(图3A)。发生吞咽时,从单个阻抗通道可观察到食团前方小团空气和通道接触导致阻抗值曲线短暂上升,随后食团通过使阻抗值曲线下降,食管蠕动导致阻抗值曲线短暂升高,随后恢复静息状态。纵行分析所有阻抗通道可发现近端通道的阻抗值首先出现变化,顺行性传递至远端通道(图3B)。

(2)反流物的性状:根据反流物的性状可将反流事件分为液体反流、气体反流和混合反流。液体反流指≥2个远端阻抗通道的阻抗值较基线阻抗值下降>50%,且持续时间≥4 s(图4A);气体反流指无吞咽动作时,≥2个远端通道的阻抗值快速上升>3 000 Ω(图4B);混合反流指同一个反流内同时混合有液体和气体反流,气体反流发生在液体反流期间或之前(图4C)。
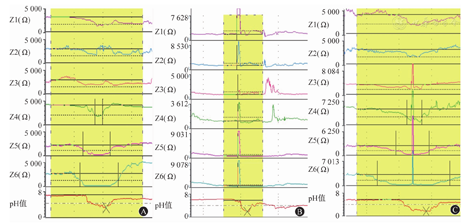

注:因各通道阻抗值差异较大,故采用分析软件的"自动量程"功能阅片
(3)反流物的pH值变化:MII-pH监测可以根据反流物的pH值将反流事件分为酸反流(pH值<4)和非酸反流(pH值≥4),其中非酸反流又可进一步分为弱酸反流(pH值为4~<7)和弱碱反流(pH值≥7)。见图5。

注:因各通道阻抗值差异较大,故采用分析软件的"自动量程"功能阅片
(4)反流的高度:分析近端反流和远端反流时,LES上方15 cm处的通道为近端食管通道,若该通道出现阻抗值下降,即可认为反流到达近端。当近端通道的阻抗值下降幅度<50%时,只要相邻远端通道的阻抗值下降>50%,就可认为是近端反流。见图6。
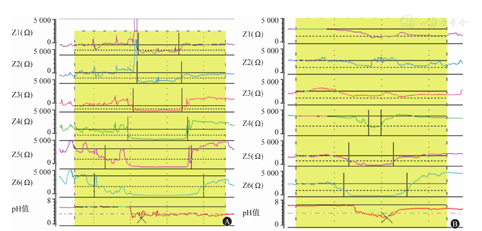

(5)反流的清除:反流的清除指食管对反流物中包括食团、胃蛋白酶、氢离子甚至是胆汁酸的清除。反流的清除可分为容量清除和化学清除2个阶段。容量清除指食管通过原发和继发蠕动推动反流物返回胃腔的过程。食团清除时间是评估食管容量清除能力的指标,该指标指在所有反流事件中,食团从进入阻抗通道到完全清除的时间中位值,人工分析的方法为所有反流事件最远端通道的阻抗值出现下降到恢复基线水平的时间中位值。化学清除指通过唾液将食管内残余的胃蛋白酶、氢离子或胆汁酸中和、稀释、冲刷返回胃内的过程。酸清除时间是评估化学清除能力的指标,指pH值<4的时间量,测量方法为pH值<4的总时间除以总反流次数。后述的反流后吞咽诱发蠕动波(post-reflux swallow-induced peristaltic wave, PSPW)指数是评估食管化学清除能力的新指标,但以上参数在临床上均不用于GERD的诊断。
在完成以上分析后,计算机程序即可输出总反流次数的结果。2018年里昂共识提出,总反流次数<40次可排除GERD的可能,总反流次数>80次为支持GERD的辅助诊断证据。然而,总反流次数不能很好地预测治疗效果,因此不推荐单纯依靠该指标诊断GERD[17]。
与单纯食管pH监测相同,MII-pH监测也采用SI与SAP评价症状-反流相关性,但MII-pH监测需报告症状分别与总反流、酸反流、弱酸反流和弱碱反流的关联性,从而指导下一步的治疗。
(1)PSPW指数:PSPW指反流事件结束后30 s内发生的吞咽事件。反流诱发的食管原发蠕动可以促进唾液对食管远端酸化的中和。PSPW指数指伴有PSPW的反流次数占总反流次数的百分比,可反映食管的化学清除能力,是近年来被新引入用于GERD评价的参数。健康人的PSPW指数>61%;低PSPW指数可作为存在病理性反流的辅助证据[17],并可预测患者对抑酸治疗的反应[18]。
PSPW指数需要人工分析,推荐使用2 min窗口,3 000 Ω的阻抗标尺进行分析。PSPW在MII-pH监测上的表现是当反流事件发生后,最远端阻抗通道恢复至基线水平(食团完全清除)后30 s内发生1次吞咽事件(从最近端至最远端,每个通道的阻抗值顺行性下降50%)。见图7。
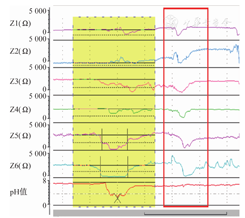

需注意以下情况:①如果吞咽事件的阻抗值变化不能传递至最远端通道,或是在最远端阻抗通道食团完全清除后30 s后发生,都不能算作PSPW;②无需每个通道都存在PSPW,但最近端和最远端通道都要存在;③PSPW不一定能完全中和或清除反流引起的远端食管酸化,但如果吞咽的同时伴有pH值下降,也不能算作PSPW。
(2)夜间平均基线阻抗(mean nocturnal baseline impedance,MNBI):食管基线阻抗值可以反映食管黏膜的完整性和通透性,MNBI是近年来被新引入用于GERD诊断的参数。健康人的MNBI>2 291 Ω,低MNBI可作为诊断病理性反流的辅助证据[17],且可预测患者对抑酸治疗的反应[18,19]。
基线阻抗的测量受吞咽和反流的影响,因此在夜晚睡眠期间测量的食管阻抗值更为准确。在夜间卧位期间,分别选取凌晨1∶00、2∶00、3∶00时3个10 min窗口,测量最远端阻抗通道的基线阻抗值,以上3个时间点的平均阻抗值即为MNBI。MNBI需人工分析,且在测量时需避开吞咽、反流和pH值下降的时间窗。
(3)胃上嗳气与胃内嗳气:嗳气指间断地出现气体从食管或胃内逸出,并在咽部发生声音的现象。这种现象一般为生理性,若出现过多嗳气令人产生不适时,则应考虑是否存在病理性原因。胃上嗳气和胃内嗳气的反流气体发生的起始部位存在本质上差异,因此罗马Ⅳ标准将嗳气症严格区分为过度胃上嗳气和过度胃内嗳气。
胃上嗳气和胃内嗳气在MII-pH监测下的表现截然不同,鉴别时应尽量采用时长较短的时间窗,明确各通道阻抗值变化的时间差。胃上嗳气指从咽部吸入或吞咽空气后,再马上经口排出的一种行为。胃上嗳气的气体既不进入胃内,也不来自胃内。胃上嗳气的表现为各通道的阻抗值首先顺行性快速上升>1 000 Ω(吸入气体),而后又出现逆行性下降(排出气体)(图8A和图8B)。胃上嗳气需与吞气鉴别:当各通道的阻抗值仅发生顺行性快速上升时,可判定该事件为吞气,吞气时最近端通道的阻抗值最快恢复至基线水平(图8C和图8D);胃上嗳气最近端通道的阻抗值最迟恢复至基线水平(图8A)。胃内嗳气的气体则来源于胃内,嗳气时常伴随LES一过性松弛,在无吞咽动作时,胃内嗳气表现为至少2个远端通道的阻抗值快速上升>3 000 Ω(图8E和图8F)。
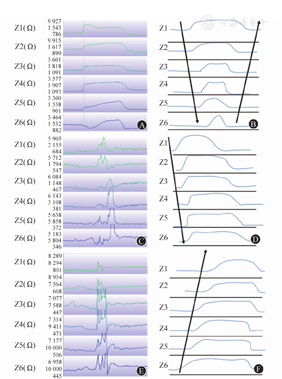

注:向下箭头表示通道阻抗值从最远端通道(Z1)至最远端通道(Z6)出现顺行性改变;向上箭头表示通道阻抗值从最远端通道(Z6)至最近端通道(Z1)出现逆行性改变。因各通道阻抗值差异较大,故采用分析软件的"自动量程"功能阅片
嗳气患者进行MII-pH监测的目的在于识别其病因和区分类型。嗳气是GERD患者常见的症状之一,MII-pH监测可以识别嗳气症是否由GERD引起,另外MII-pH监测区分嗳气类型也有助于指导治疗。过度胃上嗳气和过度胃内嗳气的治疗思路也不同:过度胃上嗳气属于一种行为异常,除病因治疗外,宜进行行为治疗,必要时可转诊至精神心理科进行治疗;过度胃内嗳气可通过调整饮食,如减少碳酸饮料的摄入进行治疗,必要时可进行药物治疗[20]。
食管动态反流监测报告可根据各单位的需要进行报告,但一般需包括以下内容。
(一)患者基本信息和临床情况:包括症状和症状评分,以及各种影像学资料等。
(二)食管酸暴露参数:DeMeester评分中各个指标的具体值和总分。
(三)反流发生情况:根据选用的监测设备类型汇报监测结果,若为单纯食管pH值监测,则汇报酸反流次数;若为MII-pH监测,需分别汇报总反流、酸反流、弱酸反流、弱碱反流的次数。
(四)症状与反流关联的评价:根据选用的监测设备类型汇报监测结果,若为单纯食管pH值监测,则汇报酸反流的SI和SAP;若为MII-pH监测,需分别汇报总反流次数,以及酸反流、弱酸反流、弱碱反流的SI和SAP。
(五)嗳气情况:对于以嗳气为主诉的患者,应汇报嗳气总次数、胃上嗳气次数和胃内嗳气次数。
(六)患者检查结果汇总:对于停药监测的患者,需汇报患者是否为病理性反流,症状与反流的关联性,以及诊断结果。对于服药监测的患者,需汇报患者服药后是否持续存在反流(酸反流或非酸反流),以及症状与反流的关联性,分析抑酸治疗无效的原因。
食管反流监测作为GERD检测的金标准,在临床上具有不可替代的作用。此外,该技术在功能性胃肠病的鉴别诊断中也具有价值。食管反流监测的规范操作、分析结果的解读对GERD的规范诊治有重要作用。统一的操作规范和结果报告,有利于我国将来进行相关领域的多中心研究和数据分析。
执笔者:肖英莲(中山大学附属第一医院消化内科),陈旻湖(中山大学附属第一医院消化内科)
参与指南修订讨论和定稿的核心成员(按姓氏汉语拼音排序):陈旻湖(中山大学附属第一医院消化内科),戴宁(浙江大学医学院附属邵逸夫医院消化内科),方秀才(北京协和医院消化内科),侯晓华(华中科技大学同济医学院附属协和医院消化内科),胡志远(香港中文大学医学院),李延青(山东齐鲁医院消化内科),林琳(江苏省人民医院消化内科),吕宾(浙江中医药大学附属第一医院消化内科),向雪莲(华中科技大学同济医学院附属协和医院消化内科),肖英莲(中山大学附属第一医院消化内科),邹多武(上海交通大学医学院附属瑞金医院消化内科)
所有作者均声明不存在利益冲突


























