
外耳道耵聍腺恶性肿瘤是头颈部较为罕见的肿瘤之一,其中复发转移的病例报道更是少见。本文报道1例外耳道耵聍腺腺样囊性癌术后69个月复发播散至颅内并可能肺部多发转移的病例。收集临床资料,分析组织学特征、免疫组织化学及分子病理特点,并复习相关文献。该病诊断时需注意与其他形态学相似的肿瘤如基底细胞癌等鉴别。因具有复发及转移风险,肿瘤进行根治性切除术后需规范放疗及密切随访。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,65岁。2020年5月1日因突发意识不清,就诊外院。颅脑CT显示右侧颞叶区占位性病变,右侧颞骨骨质破坏,考虑外耳道恶性肿瘤脑转移。为进一步治疗,于2020年5月7日就诊于福建医科大学附属第一医院,以“脑继发性恶性肿瘤”收入院。体检见患者右侧外耳道部分缺如。患者平素体健,高血压病史10年余。2014年8月因右外耳道肿瘤于外院行手术切除,术后病理:耵聍腺腺样囊性癌,并查见淋巴结转移。患者经根治性手术及术后规范放疗,术后恢复较好,放疗方案及疗程具体不详。本次住院颅脑磁共振成像(MRI)显示右侧颞骨乳突部-右颞部占位性病变并颞骨乳突及鳞部骨质破坏;T1和T2加权图像呈低信号,局灶T2图像呈高信号,FLAIR呈低信号,其内信号不均,增强扫描显示实性部分明显强化;病灶累及部分右侧外耳道,考虑恶性肿瘤复发播散可能,伴大脑镰下疝、颞叶钩回疝(图1)。胸部CT扫描显示双肺多发结节,考虑转移性肿瘤。患者入院完善相关检查后行右颞入路大脑深部肿瘤切除术。术中见肿瘤位于右侧颞叶区,侵犯硬脑膜及部分骨组织,肿瘤与周围脑组织边界尚清,部分与中颅底粘连紧密。为避免颅腔与内耳道沟通,手术切除大部分肿瘤及扩大剪除肿瘤周缘硬脑膜,送病理检查。临床评估双肺多发病灶及身体无法耐受等情况,未进一步手术处理,给予相应的对症治疗。
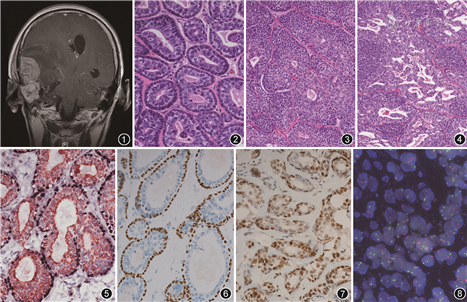

病理检查:送检不规则组织数块,总体积7.0 cm×4.3 cm×3.2 cm,切面灰白色,质中。镜下观察:肿瘤组织呈多结节样浸润性生长,无包膜,肿瘤细胞排列呈管状、实性小巢状,局灶筛状,呈混合型生长方式。管状区肿瘤由两层细胞构成,中央为管腔(图2);实性区呈巢团状,局灶伴粉刺样坏死(图3);筛状区细胞间形成大小不等的裂隙,其内充满均质黏液样物质(图4)。肿瘤主要由两种不同形态细胞组成,瘤巢或腺样结构周边由一圈单层小的基底样细胞组成,胞质少,未见明显核分裂象;中央区域或腺样结构内层由单层或多层上皮样细胞组成,细胞胞质丰富,核较浅染,核仁明显,部分核周伴空晕。核分裂象少见。周围间质微血管增生,灶状区域伴黏液样变。免疫组织化学显示两种肿瘤细胞成分为导管上皮细胞和肌上皮细胞(图5,6),导管上皮样肿瘤细胞CD117、细胞角蛋白(CK)7、上皮细胞膜抗原(EMA)阳性,肌上皮样细胞CK5/6、p63阳性。肿瘤细胞MYB、雄激素受体(AR)部分阳性(图7),Ki-67阳性指数约40%,胶质纤维酸性蛋白(GFAP)及GCDFP15阴性。免疫荧光原位杂交(FISH)显示约40%的肿瘤细胞MYB-NFIB基因融合(图8)。回顾外单位原发灶术后病理检查结果,其组织学特征与免疫组织化学特点与本次样本结果基本一致。
病理诊断:(右侧颞叶)耵聍腺腺样囊性癌复发并蔓延至颅内。
外耳道耵聍腺肿瘤首次由Wetli等[1]于1972描述。目前分类主要分为良性和恶性。良性耵聍腺肿瘤包括腺瘤、多形性腺瘤、生乳头状汗腺瘤和外分泌圆柱瘤。恶性耵聍腺肿瘤包括腺癌、腺样囊性癌和黏液表皮样癌。耵聍腺恶性肿瘤发生率极低,其中腺样囊性癌约占一半以上[2]。
目前,关于外耳道腺样囊性癌的文献大多局限于病例报道和小综研究(病例数最多为66例)。据文献报道,外耳道腺样囊性癌的发病率约为0.004/10万,发病年龄22~96岁,以50~60岁为多。通过统计3篇文献的95例患者,其中男性40例,女性55例,男女比值为1.0∶1.4[3, 4, 5]。而外耳道腺样囊性癌伴颅内播散的相关文献多为病例报道,目前检索到病例数少于10例,其中伴对侧脑转移1例[6]。
耵聍腺主要分布在外耳道外约1/3的软骨部,呈小叶状分布在皮脂腺深部,为管泡状腺。外耳道腺样囊性癌起源与耵聍腺相关,其形态学表现及免疫表型与涎腺来源的腺样囊性癌相似。形态上可分为3种,分别为筛状型、管状型及实性型,也可混合存在。其中筛状型最多见。复习相关文献[7],神经侵犯与组织学分型差异具有统计学意义,其中实性型发生神经侵犯及进展为晚期的比例更高。本例病灶播散至颅内,显微镜下实性区约占50%,并且局灶伴有坏死,可能提示恶性度较高,其发生复发转移是否与组织学分型相关目前尚不明确。
外耳道腺样囊性癌多呈浸润性生长,易侵犯神经,故主要以外耳道肿物或疼痛为主诉就诊。易复发及远处转移,最常见的转移部位依次为肺、肾、皮肤和骨组织,颅内转移者十分罕见。肿瘤播散至颅内者可继发于直接浸润、血行转移及沿神经播散等。肿瘤切除标本切面多呈灰白色,可见小囊腔。组织学表现主要由上皮-肌上皮细胞组成,可呈筛状、腺管状或实性排列;免疫组织化学表达上皮及肌上皮标志物,肿瘤细胞表达MYB,同时FISH检测显示肿瘤细胞MYB-NFIB基因融合。据相关统计[8],在涎腺腺样囊性癌中约28%的原发癌和35%的转移性癌可检测到MYB-NFIB融合,但在其他非腺样囊性癌的涎腺肿瘤中均未检测到MYB-NFIB融合,而且在携带MYB-NFIB融合的肿瘤中MYB的表达明显增高。因此,MYB-NFIB基因融合以及MYB蛋白的异常表达对于腺样囊性癌的诊断具有重要意义。MYB蛋白表达的临床预后意义目前尚不明确,我们推测如果与预后相关,那么未来MYB可能会成为治疗这种疾病的新靶点,而针对这类肿瘤的治疗可能会基于生物标志物表达和肿瘤细胞组成制定个体化的治疗方案。
诊断耵聍腺腺样囊性癌前,需根据病史、临床表现及放射影像学结果,首先排除腮腺肿瘤直接蔓延累及和涎腺的转移癌[3]。当组织学以实性巢状为主时,细小的活检组织容易被误诊为原发性皮肤肿瘤,特别是基底细胞癌[9]。因此,鉴别时需要辨别肿瘤是“累及”表皮还是“生长”于表皮。在某些情况下,避免活检等局灶取材可能是鉴别的重要方法。同时免疫组织化学检查可辅助诊断,基底细胞癌肿瘤细胞CK5/6、p63弥漫阳性,而CD117、CK7阴性。当病变播散或转移至颅内,以颅内占位性病变就诊时,除了其他转移癌之外,还需与原发性颅内肿瘤相鉴别,如分泌型脑膜瘤等。
外耳道耵聍腺源性腺样囊性癌切除术后容易局部复发,晚期甚至侵犯至颅内和发生远处转移,预后较差[6]。本例患者原发病灶经根治性切除术后69个月,肿瘤复发播散至颅内并可能肺部多发转移。因此,对腺样囊性癌患者治疗上主张早期、广泛、细致的切除,术后辅以规范放疗及密切随访,可能有助于延缓复发或降低复发的风险。
所有作者均声明不存在利益冲突



























