
探讨舌下脱敏治疗对螨虫致敏过敏性鼻炎患儿的疗效。
回顾性研究2014年3月至2019年9月就诊于首都医科大学附属北京儿童医院耳鼻咽喉头颈外科门诊490例螨虫致敏过敏性鼻炎患儿,并依据患儿的临床情况,将其分成低龄儿童组、脱敏治疗时长组、个体化剂量调整组及多重过敏疗效评估组,记录患儿在首诊、治疗12个月、24个月及36个月时的鼻部总症状评分(TNSS)、视觉模拟量表评分(VAS)及总用药评分(TMS),并计算症状药物联合评分(CSMS)。
共有374例(76.32%)患儿完成了本次研究。其中低龄儿童用药组中,≤3岁组与>3岁组在用药12个月后的CSMS(2.20±1.61、2.50±1.78)、TNSS(2.80±2.32、3.60±2.71)及VAS(3.50±1.16、3.90±1.43)显著低于首诊时的评分CSMS[(4.50±1.44、5.30±1.32)、TNSS(6.20±1.89、7.50±2.19)、VAS(5.40±2.33、5.90±1.61)];此外,在脱敏治疗不同时间组中,完成36个月脱敏治疗患儿,仅在3年组中,评分分别为TNSS(0.90±0.97)、VAS(1.30±1.19)和CSMS(1.70±1.28),完成24个月脱敏疗程患儿在2年组和3年组的评分分别为TNSS(2.10±0.95、2.00±0.97)、VAS(3.00±1.56、3.10±1.68)、CSMS(3.10±1.15、2.90±1.19),完成12个月脱敏治疗患者在1年组、2年组和3年组中评分为TNSS(3.20±1.27、3.10±1.41、3.20±1.41)、VAS(4.50±2.11、4.70±2.19、4.50±2.17)和CSMS(4.20±1.39、3.70±1.32、4.10±1.39);脱敏治疗疗效不佳患儿在进行个体化增量后6个月(即治疗后12个月)达到与对照组相近的评分,即4号4滴组、4号5滴组和对照组的评分CSMS(2.90±1.56、2.90±1.88、2.40±1.69)、TNSS(4.70±2.98、3.90±2.77、3.80±2.45)和VAS(4.20±1.29、4.50±1.62、4.20±1.14);多重过敏患者脱敏2年后最终达到与单一过敏患者相近的疗效,单一过敏组、合并1~2种过敏原和合并3种以上过敏原组评分分别为CSMS(2.30±0.50、2.10±1.01、1.90±1.01)、TNSS(3.50±2.62、3.70±2.62、3.20±2.82)和VAS(4.50±1.00、4.10±1.57、3.80±1.54)。
脱敏治疗在低龄儿童用药、多重过敏等方面均可发挥疗效,部分患儿在剂量调整后获得更好疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
过敏性鼻炎(AR)是Ⅰ型变态反应性疾病,由过敏原刺激机体后产生的特异性IgE及相关细胞因子介导,是临床最常见的呼吸道过敏性疾病之一,以鼻痒、鼻塞、流涕及喷嚏为主要临床症状[1]。对于儿童而言,过敏性疾病的发病率呈现逐年上升趋势[1],对患儿的生长发育及学习生活造成严重的影响。变应原免疫治疗(AIT)是针对于过敏性疾病病因的一种治疗措施,被认为是唯一可以改变过敏性疾病自然进程的治疗措施,目前已经在临床中得到广泛的应用[2]。我国国内AIT主流的2种给药方式分别为皮下特异性免疫治疗(subcutaneous immunotherapy,SCIT)和舌下特异性免疫治疗(sublingual immunotherapy,SLIT)[3]。临床儿科医师在开展脱敏治疗过程中,多会遇到儿童用药年龄、用药剂量、患儿过敏原种类不统一等问题,虽然有部分研究报道过相关内容,但统一缺乏系统性研究,本研究分析2014年3月至2019年9月就诊于首都医科大学附属北京儿童医院耳鼻咽喉头颈外科门诊的螨虫致敏AR患儿,开展舌下脱敏治疗,并对治疗后个体化剂量调整、用药年龄、多重过敏疗效及治疗不同周期疗效等问题进行阐述。希望为广大临床儿科医师在实际诊疗过程中提供更多有价值的参考。
本研究回顾性分析2014年3月起至2019年9月就诊于首都医科大学附属北京儿童医院耳鼻咽喉头颈外科,应用SLIT螨虫致敏AR患儿进行研究。本研究通过医院医学伦理委员会审批[批准文号:(2021)-E-039-R],患儿开展治疗前均经过监护人同意,并签署知情同意书。
本研究使用浙江我武生物科技股份有限公司生产的标准化舌下脱敏药物粉尘螨滴剂(畅迪)1~5号(分别包含1、10、100、333和1 000 ng/L变应原活性蛋白)对AR患儿进行脱敏治疗,依照说明书要求用药(年龄<14岁,前3周每周分别使用畅迪1号、2号、3号,每天按照1、2、3、4、6、8、10滴的剂量逐级递增,第4周起使用畅迪4号,1次/d,每次3滴维持;年龄≥14岁,前5周与<14岁患儿用法相同,第6周起,使用畅迪5号,1次/d,每次2滴维持),对于疗效不显著的患儿,依据其所处用药阶段,进行个体化增量用药,分别增至4号4滴和4号5滴,脱敏治疗过程中配合对症药物使用,本研究设计脱敏疗程共计3年。
在患者首诊及后续随访管理中,记录患儿鼻部总症状评分(total nasal symptoms score,TNSS):打喷嚏(个/d,≤2=0分,3~5=1分,6~10=2分,≥11=3分);流涕(次/d,0=0分,1~4=1分,5~9=2分,≥10=3分);鼻痒(无症状=0分,间断性鼻痒=1分,可以忍受的鼻痒=2分,难以忍受的鼻痒=3分);鼻塞(无症状=0分,无张口呼吸的鼻塞=1分,伴张口呼吸的严重鼻塞=2分,全天张口呼吸的严重鼻塞=3分);视觉模拟量表评分(visual analogue scale,VAS);总用药评分(total medication score,TMS)(抗组胺药物/抗白三烯药物:1分,局部糖皮质激素:2分,全身用糖皮质激素:3分)[4];症状药物联合评分(combined symptom and medication score,CSMS)=TNSS/4+TMS,用于评估脱敏治疗疗效。
纳入标准:(1)诊断为中/重度AR的患儿;(2)变应原点刺实验粉尘螨/户尘螨检测结果≥++,或血清特异性IgE检测(Unicap)≥0.7 kU/L。排除标准:(1)严重的系统性疾病:免疫性疾病、恶性肿瘤、精神紊乱性疾病等;(2)使用β受体阻滞剂或血管紧张素转换酶(ACE)抑制剂的患者;(3)不能正确服用药物及出现不良反应不能准确反馈的患儿。
采用SPSS 19.0软件进行统计学分析。计量资料组间比较采用t检验及方差分析。P<0.05为差异有统计学意义(均P>0.05)。
本研究共收集490例患儿。其中374例(76.33%)患儿完成本次研究,年龄(7.69±0.15)岁,男189例(50.53%),女185例(49.47%),共计116例中断治疗。其中89例失去随访联系,11例不配合开展,16例由于其他原因中断治疗;患儿首诊时的TNSS、VAS评分及CSMS均进行了统计学分析,差异均无统计学意义(均P>0.05)(表1)。

螨过敏性鼻炎患儿374例基线评分比较(分, ±s)
±s)
Comparison of the baseline scores of the 374 children with mite allergic rhinitis(score, ±s)
±s)
螨过敏性鼻炎患儿374例基线评分比较(分, ±s)
±s)
Comparison of the baseline scores of the 374 children with mite allergic rhinitis(score, ±s)
±s)
| 组别 | TNSS | VAS | CSMS |
|---|---|---|---|
| ≤3岁比>3岁 | 6.20±1.89比7.50±2.19 | 5.40±2.33比5.90±1.61 | 4.50±1.44比5.30±1.32 |
| 1年比2年比3年 | 7.40±2.22比7.50±2.05比7.40±2.19 | 5.90±1.61比5.8±1.70比5.80±1.53 | 7.80±1.95比7.80±2.01比7.70±1.88 |
| 对照比4号4滴比4号5滴 | 8.30±1.97比8.30±1.61比8.20±2.10 | 6.30±1.46比6.30±1.36比6.20±1.61 | 5.40±0.33比5.50±1.03比5.50±1.13 |
| 单一比1~2比3+ | 7.20±1.60比7.20±1.72比7.30±1.59 | 5.40±1.71比5.50±1.69比5.40±1.81 | 5.10±1.11比5.30±1.28比5.20±1.21 |
注:单一:单一过敏组;1~2:合并1~2种过敏原组;3+:合并3种及以上过敏原组;TNSS:鼻部总症状评分;VAS:视觉模拟量表评分;CSMS:症状药物联合评分 Single:single allergen group; 1-2:dust mite combined with 1-2 allergens group; 3 +:dust mite combined with 3+ allergens group;TNSS:total nasal symptom score;VAS:visual analogue scale;CSMS:combined symptom and medication score
共纳入3岁及以下儿童6例(1.6%)。低龄脱敏治疗组(3岁及3岁以下)患儿和常规脱敏治疗组(3岁以上)患儿首诊时的TNSS、VAS评分及CSMS评分差异均无统计学意义,且首诊评分显著高于治疗1年、2年评分(表2)。
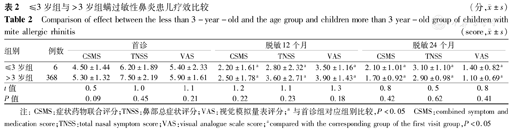
≤3岁组与>3岁组螨过敏性鼻炎患儿疗效比较(分, ±s)
±s)
Comparison of effect between the less than 3-year-old and the age group and children more than 3 year-old group of children with mite allergic rhinitis(score, ±s)
±s)
≤3岁组与>3岁组螨过敏性鼻炎患儿疗效比较(分, ±s)
±s)
Comparison of effect between the less than 3-year-old and the age group and children more than 3 year-old group of children with mite allergic rhinitis(score, ±s)
±s)
| 组别 | 例数 | 首诊 | 脱敏12个月 | 脱敏24个月 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| CSMS | TNSS | VAS | CSMS | TNSS | VAS | CSMS | TNSS | VAS | ||
| ≤3岁组 | 6 | 4.50±1.44 | 6.20±1.89 | 5.40±2.33 | 2.20±1.61a | 2.80±2.32a | 3.50±1.16a | 2.10±1.01a | 3.10±1.10a | 1.40±0.82a |
| >3岁组 | 368 | 5.30±1.32 | 7.50±2.19 | 5.90±1.61 | 2.50±1.78a | 3.60±2.71a | 3.90±1.43a | 1.70±0.92a | 2.90±0.98a | 1.10±0.69a |
| t值 | 0.5 | 1.0 | 1.1 | 1.2 | 1.1 | 1.3 | 0.8 | 0.5 | 0.8 | |
| P值 | 0.09 | 0.45 | 0.21 | 0.22 | 0.23 | 0.18 | 0.42 | 0.62 | 0.41 | |
注:CSMS:症状药物联合评分;TNSS:鼻部总症状评分;VAS:视觉模拟量表评分;a与首诊组对应组别比较,P<0.05 CSMS:combined symptom and medication score;TNSS:total nasal symptom score;VAS:visual analogue scale score;acompared with the corresponding group of the first visit group,P<0.05
本研究针对不同疗程患儿进行分析,完成1年舌下脱敏治疗者111例(29.7%),完成2年脱敏治疗者130例(34.8%),完成3年脱敏治疗者133例(35.6%)。脱敏治疗1年、2年、3年的患儿首诊时的CSMS、TNSS及VAS评分差异均无统计学意义,表明患儿基线无差别;CSMS评分组,首诊与治疗1年、2年、3年后评分差异有统计学意义,治疗1年与治疗2年、3年差异有统计学意义;此外TNSS除了具备CSMS评分的显著性特征外,治疗2年和治疗3年评分差异仍有统计学意义;VAS评分与TNSS评分的统计学趋势相同(表3)。
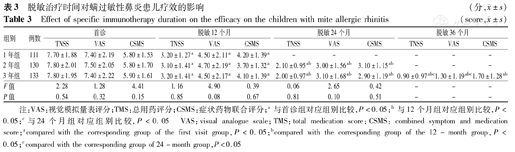
脱敏治疗时间对螨过敏性鼻炎患儿疗效的影响(分, ±s)
±s)
Effect of specific immunotherapy duration on the efficacy on the children with mite allergic rhinitis(score, ±s)
±s)
脱敏治疗时间对螨过敏性鼻炎患儿疗效的影响(分, ±s)
±s)
Effect of specific immunotherapy duration on the efficacy on the children with mite allergic rhinitis(score, ±s)
±s)
| 组别 | 例数 | 首诊 | 脱敏12个月 | 脱敏24个月 | 脱敏36个月 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TNSS | VAS | CSMS | TNSS | VAS | CSMS | TNSS | VAS | CSMS | TNSS | VAS | CSMS | ||
| 1年组 | 111 | 7.70±1.88 | 7.40±2.19 | 5.80±1.53 | 3.20±1.27a | 4.50±2.11a | 4.20±1.39a | - | - | - | - | - | - |
| 2年组 | 130 | 7.80±2.01 | 7.50±2.05 | 5.80±1.70 | 3.10±1.41a | 4.70±2.19a | 3.70±1.32a | 2.10±0.95ab | 3.00±1.56ab | 3.10±1.15ab | - | - | - |
| 3年组 | 133 | 7.80±1.95 | 7.40±2.22 | 5.90±1.61 | 3.20±1.41a | 4.50±2.17a | 4.10±1.39a | 2.00±0.97ab | 3.10±1.68ab | 2.90±1.19ab | 0.90±0.97abc | 1.30±1.19abc | 1.70±1.28ab |
| F值 | 2.28 | 1.28 | 4.41 | 1.16 | 4.90 | 0.39 | 0.06 | 2.65 | 0.42 | - | - | - | |
| P值 | 0.54 | 0.32 | 0.15 | 0.85 | 0.08 | 0.67 | 0.81 | 0.10 | 0.51 | - | - | - | |
注:VAS:视觉模拟量表评分;TMS:总用药评分;CSMS:症状药物联合评分;a与首诊组对应组别比较,P<0.05;b与12个月组对应组别比较,P<0.05;c与24个月组对应组别比较,P<0.05 VAS:visual analogue scale;TMS:total medication score;CSMS: combined symptom and medication score;acompared with the corresponding group of the first visit group,P<0.05;bcompared with the corresponding group of the 12-month group,P<0.05;ccompared with the corresponding group of 24-month group,P<0.05
本研究对脱敏治疗6个月后,依据患儿或家长的反馈情况进行评估,对于反馈疗效尚可的患儿指导其正常使用药物;对于反馈疗效不明显,或无效的患儿,TNSS评分高于4分的患儿增至4号4滴,其中部分患儿1年评估时TNSS评分仍高于4分的患儿增至4号5滴,设为个体化调整治疗组,常规用药发挥疗效的患儿作为对照组。其中个体化剂量调整4号4滴患儿15例(4%),个体化剂量调整4号5滴患儿10例(2.7%);所有患儿在首诊时评分差异无统计学意义。脱敏治疗6个月后,对照组与个体化剂量调整组间差异有统计学意义,表明对照组脱敏治疗开始发挥疗效,但个体化剂量调整组脱敏治疗疗效尚未显现;此时对个体化剂量调整组的患儿增加剂量,再经过6个月治疗后(即脱敏治疗12个月),评估其CSMS、TNSS及VAS评分,与对照组比较差异无统计学意义,表明个体化增量对前期脱敏治疗无效的患儿开始发挥疗效;但增至4号4滴的患儿在脱敏治疗12个月及24个月后,TNSS评分差异有统计学意义(表4)。
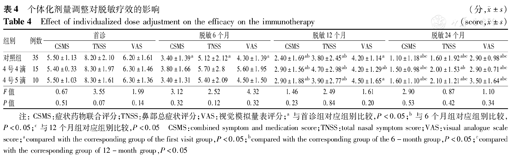
个体化剂量调整对脱敏疗效的影响(分, ±s)
±s)
Effect of individualized dose adjustment on the efficacy on the immunotherapy (score, ±s)
±s)
个体化剂量调整对脱敏疗效的影响(分, ±s)
±s)
Effect of individualized dose adjustment on the efficacy on the immunotherapy (score, ±s)
±s)
| 组别 | 例数 | 首诊 | 脱敏6个月 | 脱敏12个月 | 脱敏24个月 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CSMS | TNSS | VAS | CSMS | TNSS | VAS | CSMS | TNSS | VAS | CSMS | TNSS | VAS | ||
| 对照组 | 35 | 5.50±1.13 | 8.20±2.10 | 6.20±1.61 | 3.40±1.39a | 5.12±2.12a | 4.30±1.39a | 2.40±1.69ab | 3.80±2.45ab | 4.20±1.14a | 1.10±1.18abc | 1.60±1.92abc | 2.90±0.98abc |
| 4号4滴 | 15 | 5.40±0.33 | 8.30±1.97 | 6.30±1.46 | 3.80±1.66 | 5.70±2.8 | 5.60±1.95 | 2.90±1.56ab | 4.70±2.98ab | 4.20±1.29ab | 1.50±0.98abc | 2.00±1.53ab | 2.90±0.71abc |
| 4号5滴 | 10 | 5.50±1.03 | 8.30±1.61 | 6.30±1.36 | 3.40±1.31 | 5.40±2.09 | 4.50±1.50 | 2.90±1.88ab | 3.90±2.77ab | 4.50±1.65a | 1.60±1.10abc | 2.10±1.21abc | 3.50±1.64abc |
| F值 | 0.67 | 3.55 | 1.99 | 3.12 | 2.52 | 4.32 | 1.46 | 2.49 | 1.61 | 2.90 | 0.87 | 1.10 | |
| P值 | 0.51 | 0.07 | 0.14 | 0.32 | 0.12 | 0.32 | 0.23 | 0.84 | 0.20 | 0.53 | 0.42 | 0.34 | |
注:CSMS:症状药物联合评分;TNSS:鼻部总症状评分;VAS:视觉模拟量表评分;a与首诊组对应组别比较,P<0.05;b与6个月组对应组别比较,P<0.05;c与12个月组对应组别比较,P<0.05 CSMS:combined symptom and medication score;TNSS:total nasal symptom score;VAS:visual analogue scale score;acompared with the corresponding group of the first visit group,P<0.05;bcompared with the corresponding group of the 6-month group,P<0.05;ccompared with the corresponding group of 12-month group,P<0.05
本研究针对单一螨致敏和多重致敏患儿进行分组,其中单一螨虫过敏患儿4例(1%),除螨虫外合并其他1~2种变应原的患儿82例(21.9%),除螨虫外合并其他3种及以上变应原患儿288例(77%)。患儿在首诊时评分差异均无统计学意义,但CSMA、TNSS和VAS评分,在经过12个月脱敏治疗后,首诊与12个月治疗组间差异有统计学意义,表明脱敏治疗发挥疗效;CSMS评分和VAS评分,治疗12个月,合并3种及以上其他变应原组与单一螨虫过敏组间差异有统计学意义,治疗24个月后评分组间差异无统计学意义(表5)。
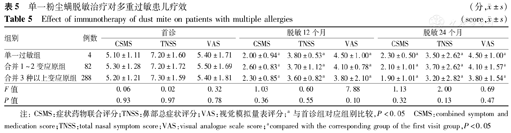
单一粉尘螨脱敏治疗对多重过敏患儿疗效(分, ±s)
±s)
Effect of immunotherapy of dust mite on patients with multiple allergies(score, ±s)
±s)
单一粉尘螨脱敏治疗对多重过敏患儿疗效(分, ±s)
±s)
Effect of immunotherapy of dust mite on patients with multiple allergies(score, ±s)
±s)
| 组别 | 例数 | 首诊 | 脱敏12个月 | 脱敏24个月 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| CSMS | TNSS | VAS | CSMS | TNSS | VAS | CSMS | TNSS | VAS | ||
| 单一过敏组 | 4 | 5.10±1.11 | 7.20±1.60 | 5.40±1.71 | 2.00±0.94a | 3.80±0.53a | 4.50±1.00a | 2.30±0.50a | 3.50±2.62a | 4.50±1.00a |
| 合并1~2变应原组 | 82 | 5.30±1.28 | 7.20±1.72 | 5.50±1.69 | 2.60±0.83a | 3.70±1.12a | 4.10±0.78a | 2.10±1.01a | 3.70±2.62a | 4.10±1.57a |
| 合并3种以上变应原组 | 288 | 5.20±1.21 | 7.30±1.59 | 5.40±1.81 | 2.30±0.85a | 3.60±0.82a | 3.80±2.10a | 1.90±1.01a | 3.20±2.82a | 3.80±1.54a |
| F值 | 0.06 | 0.02 | 0.32 | 1.03 | 0.60 | 7.88 | 1.13 | 2.00 | 0.69 | |
| P值 | 0.93 | 0.97 | 0.78 | 0.36 | 0.55 | 0.10 | 0.32 | 0.13 | 0.47 | |
注:CSMS:症状药物联合评分;TNSS:鼻部总症状评分;VAS:视觉模拟量表评分;a与首诊组对应组别比较,P<0.05 CSMS:combined symptom and medication score;TNSS:total nasal symptom score;VAS:visual analogue scale score;acompared with the corresponding group of the first visit group,P<0.05
AR是指患者暴露于过敏原环境后,诱导机体产生特异性IgE抗体,进而介导机体发生的鼻黏膜非感染性慢性疾病[5]。变应性疾病的发作主要与变应原的暴露相关,如花粉、螨虫等,同样非特定因素,如烟雾、灰尘、病毒感染、强烈的气味和冷空气等也可以触发变应性疾病[5]。近年来,变应性疾病呈现逐年上升趋势,也使得人们对变应性疾病的认知逐渐加强,世界卫生组织于1998年针对于变应性疾病提出了"四位一体"的治疗措施[6],即避免接触变应原、对症药物治疗、特异性免疫治疗及患者教育。其中避免接触变应原是有效控制变应性疾病患者发病的重要措施,也是患者做好家庭防护工作的重要内容;对症药物治疗疗效及安全性目前已经得到了临床医师的广泛认可[7],但由于常规的对症药物只能够缓解患者的临床症状,并不能够改善变应性疾病的自然进程,患者需要面临长期用药的问题。特异性免疫治疗于1911年由英国Noon医师发明,采用皮下接种方式,距今已有100多年的历史,在治疗AR及调节患者免疫平衡的过程中占据非常重要的地位,临床中脱敏治疗的疗效已经得到了充分的认证,在我国最新的AR诊断及治疗指南中,将特异性免疫疗法升级为AR的一线治疗方法,临床推荐使用,不再需要以对症药物治疗无效为前提[3]。目前国际上皮下脱敏制剂的浓度标准不一,因此建议患者在皮下接种后的一段时间内进行充分的临床观察,专人监管,以保证患者用药安全[3]。不同于传统的SCIT,SLIT由于其用药安全、使用便捷等特点[8]逐渐成为一种新的给药方式,特别是用于低龄儿童的免疫治疗。不论是SLIT还是SCIT,其药效发挥作用机制是相似的,均表现出miR-146a表达显著上升,TRAF6、白细胞介素(IL)-5、IL-10水平也呈现相似的变化趋势[9],舌下免疫治疗和皮下注射对变应性患儿具有相同的疗效[8,10]。良好的患者教育是保证脱敏治疗疗效发挥的关键步骤。
在本研究中,尝试为部分低龄儿童进行舌下脱敏治疗,脱敏治疗在开展过程中,主要考虑患儿能否正确服用药物,以及出现不良反应后的反馈能力,建议在3岁及以上的人群中开展舌下脱敏治疗[3,11],但部分低龄患儿家长对开展免疫治疗意愿强烈,且儿童具备开展舌下脱敏治疗的能力,在保证患儿安全的前提下,进行了充分的临床评估,从本研究结果可以看出,3岁儿童组与对照组儿童的评分变化趋势一致,表明脱敏治疗对于3岁及3岁以上儿童的疗效可能具有一致性。对于低龄组而言,患者选择更为严格,也更需要慎重,本研究中共选择6例3岁以下患儿,样本量相对较小,后续有待进一步扩大样本量,以得到更确实的结论。
脱敏治疗本质是调节机体的免疫平衡,国际上推荐的免疫疗程为3~5年,国内相关指南也推荐至少使用3年[3,11,12]。在实际的临床诊治中,因为各类原因,患者接受脱敏治疗的时长不尽相同。本研究对患儿不同脱敏治疗年限的研究发现,患儿进行1年脱敏治疗与首诊的评分差异有统计学意义,这提示脱敏治疗药物在使用1年后即可发挥相应疗效,除CSMS评分外,TNSS和VAS评分在治疗不同时间后差异均有统计学意义,说明,随着脱敏治疗时间的延长,药物发挥的疗效也越明显。
变应性疾病病因复杂,而脱敏治疗是精准医疗的典型代表,由于不同患者对变应原的耐受程度不同,若以相同的剂量去刺激患者的免疫系统,引起患者免疫应答能力是不同的[13]。虽然常规的给药用量能够对绝大多数患者的免疫系统起到刺激作用,但针对免疫耐受水平较低的患者容易发生不良反应,对于免疫耐受水平较高的患者,常规给药剂量并不能够起到刺激作用而发挥相应疗效,因此针对不同患者制定不同的给药方案,达到精准治疗的目的。当然脱敏治疗的疗效与不良反应分处在平衡木的两端,临床医师也应该慎重考虑[5]。相关研究表明,对于低应答组(CSMS改善率20%~50%)在脱敏治疗6个月后进行个体化增量,可以在脱敏治疗后期,达到与高应答组(CSMS改善率>50%)相同的疗效[13]。但由于个体化剂量研究分组复杂,患者样本量需求庞大,相关研究开展较少。本研究中个体化剂量调整主要针对的是前6个月治疗无效的患儿,本研究结果所示,脱敏治疗6个月后,对照组的评分显著下降,但剂量调整组评分与首诊时差异无统计学意义。6个月后对疗效不佳患儿进行增加剂量,最终达到与对照组评分一致的趋势,证明剂量调整对不同患儿个性化治疗会取得更显著疗效。
多重过敏患者接受单一脱敏治疗疗效一直备受国内外专家学者的关注,粉尘螨滴剂对单一螨虫过敏患者而言的是最具针对性的治疗药物,但临床中患儿多为多重过敏[10,14]。在本研究中,患儿的评分在脱敏治疗1年后均显著低于首诊评分,表明单一粉尘螨脱敏对多重过敏患者同样具有疗效;此外,就CSMS和VAS评分而言,治疗1年,单一粉尘螨脱敏组和合并3种以上其他变应原组间存在差异,脱敏治疗2年后组间差异消失,说明多重过敏患者需要更长治疗时间方可达到和单一过敏患者相同的疗效。特异性免疫治疗作为精准治疗的典型代表,其针对单一种类过敏的患者疗效最佳,在本研究中,虽然单一螨虫过敏患儿只有4例,但作为免疫治疗的阳性对照组是具有一定参考意义的,更为详实的病例数据将会在后续的研究中补充。
本研究为单一中心回顾性研究,证明了低龄患儿的用药与常规年龄患儿用药疗效接近,个体化剂量调整对应答能力较弱患儿有效,用药时间越长疗效发挥越稳固。
所有作者均声明不存在利益冲突



























