
为进一步规范新生儿脐静脉置管(umbilical venous catheterization,UVC)在临床应用过程中导管相关并发症的防控措施,制定本指南。本指南针对UVC感染、导管位置和护理及相关并发症3个方面相关的9个临床问题,系统检索截至2020年12月31日的国内外相关文献,进行证据合成与评价,采用推荐意见分级的评估、制定及评价(grading of recommendations assessment,development and evaluation,GRADE)方法,对证据质量和推荐意见的推荐强度进行分级,最终形成21条推荐意见。这是我国第一部UVC导管相关并发症防控循证指南。

1.制定背景:脐静脉置管(umbilical venous catheterization,UVC)是新生儿重症监护病房(neonatal intensive care unit,NICU)救治危重新生儿的重要技术。在胎龄小、出生体重(birth weight, BW)低、需要气管插管等高级生命支持、多次外周静脉穿刺均不成功等情况下,UVC是重要的救治手段[1, 2],但UVC也存在多种并发症,对于其中的导管血流感染并发症,目前有多个名词,本指南使用中心静脉导管相关血流感染(central line-associated bloodstream infection,CLABSI)[3]。目前国际、国内均无专门针对UVC并发症的防控指南。我国现今对于UVC的管理多参考美国疾病预防控制中心(Center of Disease Control,CDC)的中心静脉导管(central venous catheter,CVC)指南[3, 4]。但是我国与美国NICU疾病谱不同[5],医护床位配比也存在差异[6],对于UVC的临床管理,不能照搬美国的条例。UVC是经特殊部位的CVC,对UVC并发症的防控管理也不能完全套用CVC的措施。为了规范UVC的使用及并发症防控,中华医学会儿科学分会新生儿学组、中国妇幼保健协会医院感染控制专业委员会、国家儿童医学中心/首都医科大学附属北京儿童医院成立多学科指南工作组,共同制定本循证指南。
2.指南的目的:根据现有证据并结合临床实践,规范UVC的使用及并发症防控。
3.指南涉及的患儿:有指征使用或正在使用UVC的新生儿。
4.指南的使用人群:各级医院参与新生儿UVC留置、使用、维护管理的医护人员。
5.推荐意见、证据概述和推荐说明:本指南采用推荐意见分级的评估、制定及评价(grading of recommendations assessment, development and evaluation,GRADE)方法[7],对证据质量和推荐意见的推荐强度进行分级(表1)。

GRADE证据质量与推荐强度分级
GRADE证据质量与推荐强度分级
| 类别 | 具体描述 |
|---|---|
| 证据质量分级 | |
高(A) | 非常有把握观察值接近真实值 |
中(B) | 对观察值有中等把握:观察值有可能接近真实值,但也有可能差别很大 |
低(C) | 对观察值的把握有限:观察值可能与真实值有很大差别 |
极低(D) | 对观察值几乎没有把握:观察值与真实值可能有极大差别 |
| 推荐强度分级 | |
强(1) | 明确显示干预措施利大于弊或弊大于利 |
弱(2) | 利弊不确定或无论质量高低的证据均显示利弊相当 |
GPS | 基于非直接证据或专家意见/经验形成的推荐 |
注:GRADE为推荐意见分级的评估、制定及评价,GPS为良好实践声明
临床问题1:为降低CLABSI,UVC的留置时程应为多长时间?
【推荐意见】
1.当不再需要UVC时应尽快拔除(GPS)。
2.当患儿需要中心静脉时,在未监测到感染证据的情况下,推荐UVC保留7~10 d,但建议结合患儿具体病情及当地NICU的CLABSI发生率综合判断(1B)。
3.超过10 d的UVC留置时程,可结合患儿病情综合判断(GPS)。
【证据概要】
2017年Gordon等[8]的一篇系统评价(n=210),含1项随机对照研究(randomized controlled trail,RCT),分析了BW<1 251 g新生儿在留置7~10 d时计划性拔除UVC改为经外周静脉中心静脉置管(peripheral intravenous central catheterization,PICC)与CLABSI发生率、死亡率的关系,发现与持续使用UVC相比(最长保留至28 d),UVC置入后7~10 d计划性拔除并改为PICC未降低CLABSI发生率[相对危险度(relative risk,RR)=0.65,95%可信区间(confidence interval,CI)0.35~1.22]和出院前死亡率(RR=1.12,95%CI 0.42~2.98),该结果不支持早期计划性拔除UVC。2019年Konstantinidi等[9]的前瞻性队列研究比较了早产儿生后立即行PICC置管组与生后立即行UVC置管组的CLABSI发生率(随访至拔除导管后48 h),PICC组与UVC组置管时程分别为(11.91±6.93)d和(10.43±5.38)d,CLABSI发生率(RR=0.92,95%CI 0.06~14.12)和其他并发症发生率(RR=1.10,95%CI 0.37~3.29)的组间差异无统计学意义。2011年美国CDC推荐,当不再需要UVC时应尽快拔除,但如果无菌管理则可使用至14 d[4]。我国《实用新生儿学》[10]认为UVC留置至14 d时感染风险将明显升高。
【推荐说明】
由于新生儿的个体差异大且病情变化往往较突然,各种依赖中心静脉通路的临床极端情况较多,且不同地区NICU对UVC的管理经验存在差异,因此UVC的具体留置时程需通过综合判断患儿具体情况、结合医护人员自身经验、权衡利弊后做出决定。
临床问题2:在UVC上应用抗生素锁(即抗生素封管)或对已放置UVC的新生儿预防性全身应用抗生素的有效性和安全性如何?
【推荐意见】
1.不建议在UVC上应用抗生素锁(2A)。
2.不推荐对已放置UVC的新生儿预防性全身应用抗生素(1D)。
【证据概要】
2015年Taylor等[11]的Cochrane系统评价(n=289,3个RCT)中1篇文献针对PICC(n=103)、2篇包含UVC(n=186),分别报告了丁胺卡那霉素、夫西地酸抗生素锁与肝素化生理盐水锁对比,Meta分析结果提示应用抗生素锁可降低血培养阳性的CLABSI发生率(RR=0.19,95%CI 0.07~0.53),但对疑似CLABSI发生率(RR=1.05,95%CI 0.22~5.05)的影响不确定,夫西地酸抗生素锁对导管尖端细菌定植率(RR=1.59,95%CI 0.28~9.12)的影响不确定[12],因此使用抗生素锁可降低UVC新生儿CLABSI发生率但证据有限,且各项研究应用的抗生素各不相同,也无抗生素耐药性的评估数据。2005年Inglis和Davies[13]的一篇Cochrane系统评价(n=29,1个RCT),对接受UVC的足月儿给予预防性全身应用青霉素加庆大霉素连续3 d(干预组)和不应用抗生素(对照组)进行比较,结果提示干预组与对照组血培养阳性比例分别为5/15和5/14,该研究主观认为阳性血培养结果均为标本污染,且研究样本量小,因此不能明确预防性应用抗生素是否能降低UVC导致的CLABSI。
【推荐说明】
目前国内UVC使用抗生素锁的做法并不普及。可用于新生儿UVC抗生素锁的药物为万古霉素和夫西地酸,价格均较贵且均为针对革兰阳性球菌的窄谱限制级抗生素,而UVC导致CLABSI或UVC定植的病原菌可能是革兰阳性菌、革兰阴性菌或真菌。目前有关抗生素锁的研究样本量均不大,抗生素锁带来的耐药性问题尚无法有效评估。一篇2018年的Cochrane系统评价(n=88,1个RCT)在PICC拔除之前通过该PICC静脉应用1次抗生素,结果提示全身应用抗生素不能降低晚发败血症发生率和CLABSI发生率[14],结合UVC的证据,不推荐对已放置UVC的新生儿预防性全身应用抗生素。
临床问题3:如何判断UVC相关的CLABSI?
【推荐意见】
1.因疑似CLABSI而拔除UVC时,推荐进行导管尖端培养及血培养(GPS)。
2.对于疑似CLABSI的患儿,应同时采集导管血和外周血进行培养以帮助分辨是否存在自身感染,若两者培养分离到同一种病原体,且(1)导管血和外周血定量培养,菌落数比≥5∶1;或(2)导管血培养阳性的时间早于外周血>2 h,则考虑为UVC导致的CLABSI(GPS)。
3.常规拔除UVC置管时,不建议进行导管尖端培养(GPS)。
【证据概要】
未检索到如何判断UVC患儿出现的感染是否为CLABSI的系统评价。美国CDC对CLABSI的定义为原发性血流感染,患者在血流感染发生前48 h内有中心静脉置管,且与其他部位感染无关[15]。在与CVC相关的4篇指南中,关于CLABSI的诊断标准不尽相同[3, 4,16, 17]。国内主要采用2007年中华医学会重症医学分会指南中的分层诊断标准[16],国外大多参考美国国立卫生安全网及CDC的指南推荐[3, 4,17]。中华医学会重症医学分会认为具备下述任1项为确诊的导管来源CLABSI[16]:(1)有1次半定量导管培养阳性(每导管节段≥15 CFU)或定量导管培养阳性(每导管节段≥1 000 CFU),同时外周静脉血培养阳性并与导管节段为同一微生物;(2)从导管和外周静脉同时取血做定量血培养,两者菌落计数比(导管血∶外周血)≥5∶1;(3)从导管和外周静脉同时取血做定性血培养,导管血培养阳性出现时间比外周血培养阳性至少早2 h;(4)外周血和导管出口部位脓液培养均阳性,并为同一微生物。
【推荐说明】
新生儿发生感染的早期临床表现不典型且隐匿。国内外关于新生儿败血症的相关指南中,对包括UVC在内的所有CVC引起的血流感染均进行了一定的阐述,本指南推荐意见主要参考这些指南、经指南制定组集体讨论形成。在常规拔除UVC置管时是否送导管尖端培养的问题上,各单位可根据各自诊疗习惯进行调整。如果仅采集一份外周血标本,但培养到的微生物符合患儿自身特定部位感染病原体特征(如大肠埃希菌符合症状性尿路感染病原体特征),且血标本在特定部位感染期(窗口期与发病期)被采集,则考虑感染可能来源于自身。但新生儿血培养的阳性率低,给CLABSI的诊断带来一定挑战。
临床问题4:是否应用抗菌材质的UVC导管?
【推荐意见】
基于目前的证据,无法针对该问题形成推荐意见。
【证据概要】
2015年Balain等[18]的一篇系统评价(n=86,1个RCT)报告了在UVC置管时应用抗菌材质导管(为同直径型号的PICC导管,该导管在生产过程中将具有抑制细菌黏附作用的银沸石与聚氨酯材料混合处理)与CLABSI的关系。银沸石处理导管组与对照组(未经银沸石处理)相比CLABSI发生率更低(RR=0.11,95%CI 0.01~0.87,P=0.04)、导管留置时间更长[均数差(mean difference,MD)=2.30,95%CI 0.38~4.22,P=0.02],差异均有统计学意义,而两组导管尖端细菌定植率(RR=0.91,95%CI 0.13~6.18)和死亡率(RR=0.73,95%CI 0.21~2.53)差异无统计学意义,该研究未报道疑似/临床诊断CLABSI和晚发败血症的数据。
【推荐说明】
抗菌材质CVC或PICC导管的研究在成人重症领域已较多,但涉及新生儿UVC的RCT研究仅上述1篇报道且样本量小,而且该研究所用的抗菌材质导管并非专门的UVC导管。国内目前尚无抗菌材质UVC导管供应,该方法在现阶段的临床可及性差。基于上述研究证据和国内现状,目前暂无法形成推荐意见。
临床问题5:用哪个方法估算UVC置管深度更好?
【推荐意见】
1.推荐在UVC置管操作前进行深度估算,目前有多种估算UVC置管深度的公式(表2),均可选用(1C~1B)。
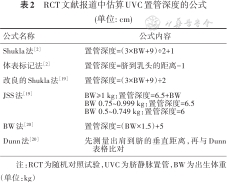
RCT文献报道中估算UVC置管深度的公式(单位:cm)
2.针对超低出生体重儿,建议使用按体表标志估算置入深度的公式:置管深度(cm)=脐到乳头的距离(cm)-1(2C)。
【证据概要】
共纳入3个比较各估算UVC置入深度公式的RCT(n=405),分别比较了Shukla法与体表标记法[2]、JSS法与改良的Shukla法[19]、BW法与Dunn法[20]的置管成功率。数据缺失44例,意向性分析结果提示Shukla法置管成功率与体表标记法差异无统计学意义(RR=0.80,95%CI 0.52~1.23);在BW<1 000 g的组别中,体表标记法估算UVC置管深度的成功率高于Shukla法(43.7%比22.5%)[2],但差异无统计学意义(RR=1.94,95%CI 0.91~4.15,P=0.07)。JSS法置管成功率与改良的Shukla法相比(RR=1.36,95%CI 0.88~2.11),BW法置管成功率与Dunn法相比(RR=1.11,95%CI 0.60~2.07),差异均无统计学意义。
【推荐说明】
UVC管尖端位置与UVC多种并发症密切相关。目前文献报道的估算UVC置入深度公式有11种,本指南仅呈现被RCT研究的6种公式。可能由于新生儿个体差异大,上述任何一种置入深度的估算方法都没有绝对优势,临床医生可根据各自的工作习惯和患儿实际情况自行选择公式。上述在BW<1 000 g新生儿中使用的体表标记法公式一次性成功率高于Shukla法,尽管其P值>0.05,但体表标记法公式的成功率绝对值约为Shukla法的2倍,因此作为弱推荐,期待大样本量、高质量RCT的进一步验证。
临床问题6:在UVC置管后如何进行尖端定位以减少位置不当并发症的发生?
【推荐意见】
1.所有UVC置管操作完成后均应进行影像学定位(GPS)。
2.推荐UVC的首次影像学定位在置管后0~2 h内进行(1B)。
3.UVC置管后首次定位时,推荐正侧位胸腹联合X线定位,可联合使用床旁超声定位(1C~1B)。
4.建议UVC置管后24~48 h和7 d再次应用影像学(有条件时床旁超声优先)监测导管尖端位置(GPS)。
【证据概要】
对9个诊断性试验[21, 22, 23, 24, 25, 26, 27, 28, 29](n=782)进行系统评价,排除1篇偏倚风险高的文献后进行敏感度分析(5篇为正位X线片结果、3篇未描述体位),与超声相比,X线定位的合并敏感度和特异度及其95%CI分别为0.86 (0.78~0.91)和0.63 (0.47~0.76),累积受试者工作特征曲线下面积及其95%CI为0.84 (0.81~0.87)。2016—2019年的6个队列研究[23, 25,30, 31, 32, 33](n=278)在UVC置管后均应用了X线和(或)超声在不同时间点对尖端位置进行监测,将各研究的时间点累积异位率进行数据整合汇总后发现,置管后0~2 h、24~48 h和7 d为各研究集中采用的时间点。
【推荐说明】
UVC置管操作完成后及留置期间的尖端位置与其并发症之间存在密切关联。X线定位(存在放射防护问题)或超声定位(存在人员资质问题)方法各有利弊,考虑当前国内NICU的床旁超声普及性可能没有床旁X线高,本指南优先推荐使用床旁X线定位,其最佳位置是UVC尖端在膈肌上0.5~1 cm或骨性标志第9胸椎水平。由于膈肌存在前高后低的屋檐样解剖特性,因此正位片上显示的UVC尖端位置可能与侧位片不同,故推荐首次定位采用X线“正位+侧位”的方法进行(注意规范操作,避免导管移位),以提高准确性,降低误诊率。
临床问题7:UVC相关胸腹腔并发症应如何预防和处理?
【推荐意见】
1.UVC置管后推荐采用床旁超声的方法进行胸腹腔影像监测(时间点参照问题6),以便及时发现和处理肝脏并发症、胸腔积液/心包积液等胸腹腔并发症(GPS)。
2.当出现UVC相关的胸腹腔并发症征象时,推荐应用床旁超声评估导管尖端位置及胸腹腔实质脏器情况,推荐在明确诊断时立即拔除UVC,建议在紧急情况下经有经验的专科医生做出临床判断时可立即拔除UVC,并根据患儿实际病情予以相应处理(GPS)。
3.UVC置管后无需常规筛查脐静脉血管中的血栓(1D)。
【证据概要】
共检索筛选UVC肝脏并发症病例报告49篇(n=49),其中发生例数较多的是肝脓肿(18例)、肝脏实质液体外渗(11例)、腹水(8例)和肝血肿(5例),有21例(21/49,42.9%)描述了并发症发生时的UVC尖端位置,其中19例(19/21,90.5%)出现移位。并发症发生前后均进行超声检查监测,治疗包括立即拔除UVC、穿刺引流、抗感染、手术干预,并随访观察。共检索到UVC胸腔积液/心包积液并发症病例报告或病例系列报告68篇(n=81),有70例(70/81,86.4%)描述了并发症发生时的UVC尖端位置,其中69例(69/70,98.6%)出现移位,并发症发生前后均进行超声及X线检查监测,治疗包括拔除UVC、穿刺引流及多学科合作综合治疗。
2014年Park等[34]有关新生儿CVC血栓的描述性系统评价纳入了26个研究(n=3 332),总的血栓发生比例为308/3 332(9.2%),其中有8个队列研究和1个RCT研究中包含UVC(n=1 229),但仅说明了处理方法,未提供血栓发生率数据;有10个研究统计了CVC相关血栓发生的部位(n=161),其中有101例(101/161,62.7%)是与UVC相关的血栓,好发部位排名前三的分别是肝门静脉(43/101,42.6%)、下腔静脉(23/101,22.8%)和右心房(12/101,11.9%),主要以心脏彩超或者腹部超声确诊。UVC相关血栓可自行消退,70%~77%的血栓无明显梗塞症状,预防性应用肝素可延长导管的使用时程,但未针对UVC人群进行肝素效果的亚组分析。2019年的前瞻性队列研究(n=40)显示UVC相关血栓很常见(30/40, 75%),均无症状且可自行消退,不建议常规筛查UVC中的血栓[35]。
【推荐说明】
导致UVC胸腹腔并发症最主要的原因是UVC导管尖端移位,仅凭临床观察较难准确做出判断,需借助影像学手段。但在高度疑似且病情危重的紧急情况下,有经验的专科医生为挽救患儿生命可做出临床判断,以便于及时做出紧急拔管的决策。床旁超声可以减少患儿接触放射线的几率,还可同时兼顾对胸腹腔脏器的监测,在UVC留置过程中的应用价值较高。上述胸腹腔并发症的发生率较低,但这些情况出现后,患儿常常出现临床危急重症的表现,临床处理上涉及危急重症救治技术和多学科联合干预,由于各医院之间在临床经验、病房条件、辅助科室等方面存在差异,因此针对上述UVC相关胸腹腔并发症的处理,各医院医护人员可根据各自的条件进行决策。
临床问题8:是否在UVC置管前后实施集束化标准护理以减少感染?UVC集束化标准护理包括哪些?
【推荐意见】
1.推荐在UVC置管前后给予集束化标准护理(1D)。
2.UVC置管前后集束化标准护理应包括但不限于:置入时最大化无菌屏障、手卫生、每天评估导管临床需求情况、使用中心静脉包、规范穿无菌手术衣、进行技术培训、使用穿刺及维护检查表。建议各中心根据特定地区的条件采取集束化护理措施(GPS)。
【证据概要】
2017年Payne等[36]的系统评价共纳入了24个研究(16个单中心研究、8个多中心研究,均非RCT研究),其中19个为质量改进的前后对照研究、2个为前瞻性队列研究,评价了对CVC新生儿实施集束化护理的有效性,发现集束化护理组的总CLABSI发生率低于常规护理组(RR=0.40,95%CI 0.31~0.51),但各研究中的集束化护理组成元素不尽相同(包括置入时最大化无菌屏障、手卫生、每天评估导管临床需求情况,使用中心静脉包、规范穿无菌手术衣、技术培训、使用穿刺及维护检查表等多方面)。2018年Schmid等[37]的系统评价纳入了27个研究,但无高质量RCT研究,其中有17个研究观察到实施集束化护理后CLABSI发生率较干预前有下降,差异有统计学意义;对其中的8个质量改进历史性队列研究进行Meta分析显示,对NICU早产儿实施集束化护理有利于预防CLABSI的发生(RR=0.58,95%CI 0.50~0.68)。
【推荐说明】
上述2个系统评价均为UVC与其他类型的CVC合并后的数据。由于UVC是经特殊部位留置的CVC,日常护理并不区分具体CVC类型,因此上述2个系统评价可作为新生儿UVC导管集束化护理的间接证据。目前缺乏关于各种不同组合的集束化标准护理对UVC患儿CLABSI影响的直接证据,各中心可根据各自工作经验来改进集束化护理措施。
临床问题9:在脐根部涂抹抗生素软膏,能否降低细菌定植率?其安全性如何?
【推荐意见】
不建议常规在脐根部使用抗生素软膏(GPS)。
【证据概要】
目前未检索到脐部局部应用抗生素软膏与细菌定植率关系及其安全性的研究。2011年美国CDC不建议常规在脐根部使用抗生素软膏[4],该推荐意见基于1项针对新生儿CVC的前瞻性研究[38](n=15),该研究在置入CVC的局部皮肤每日应用莫匹罗星软膏,发现CVC置管前、中、后的凝固酶阴性葡萄球菌耐药率为10.7% (8/75)、50.8% (33/65)、58.3% (35/60),而在取消局部涂抹莫匹罗星策略1年后,病房内该耐药率从42%下降至13%。
【推荐说明】
不少医护人员认为在脐根部局部涂抹抗生素软膏可以减少局部细菌定植从而减少CLABSI发生。但适合新生儿的抗生素软膏抗菌谱均较窄,而UVC相关CLABSI的主要病原菌有凝固酶阴性葡萄球菌、革兰阴性菌及真菌[39, 40, 41, 42, 43],而且外用抗生素软膏导致病原菌耐药的问题尚未受到临床普遍关注。
本指南的制定方法见表3。检索策略采用主题词与自由词相结合的方式,见表4。指南的证据检索、合成与评价方法见表5。制定方法参考2014年发表的《世界卫生组织指南制定手册》制定流程及相关方法学标准[7],以及指南研究与评价工具[44],并参考国际实践指南报告规范[45]撰写指南文件,在国际实践指南注册平台(http://www.guidelines-registry.cn/)注册(注册号IPGRP-2020CN142)。

指南制定方法及内容
指南制定方法及内容
| 工作步骤 | 内容 | 附加说明 |
|---|---|---|
| 指南立项 | 指南制定核心组讨论研究方案,完成指南计划书及利益冲突声明等文件 | 基金支持:北京市医院管理中心儿科协同发展中心儿科专项创新推广项目(XTCX201816)。基金资助方不参与指南制定过程且不影响最终推荐意见的形成 |
| 指南工作组 | 设4个小组:指南指导委员会、指南制定工作组、指南证据合成与评价组、指南外部评审小组 | 成员由NICU、儿内科、产科、医学影像学科、护理学、医院感染防控、医疗质量与安全控制、指南方法学、流行病学与统计学专家,专业期刊编辑,患儿监护人代表组成;其中新生儿科医师占比79% |
| 利益冲突声明 | 所有参与人员均填写利益冲突声明表 | 未见与本指南直接相关的经济和非经济利益冲突 |
| 临床问题和结局指标的遴选 | 通过文献查询、访谈、面对面共识会议,并考虑部分患儿监护人意愿和价值观的基础上,核心组多次讨论,遴选、确定本指南的临床问题和重要且关键的结局指标。由临床专家和方法学家基于PICO原则构建临床问题 | 共形成UVC相关感染、位置、护理3个方面,共9个临床问题(含11条小问题)。本指南证据概要中重点报告对临床决策重要且关键的结局指标 |
| 证据的检索、 合成与评价 | 在确定指南主题和范围、证据合成与评价的不同阶段,进行了UVC及中心静脉置管相关指南、UVC相关系统评价/Meta分析及临床研究的检索与评价 | 针对指南临床问题进行合并检索,对于无系统评价的部分临床问题,基于原始研究制定快速系统评价,并针对具体临床问题证据体进行证据质量评价 |
| 形成推荐意见 | 初步拟定22条推荐意见后,通过共2轮德尔菲调查和专家共识会议(推荐意见网络定稿会),前后共收集49条反馈意见,核心组多次讨论,最终形成21条推荐意见 | 基于各临床相关问题的系统评价证据、指南制定工作组系统查询、筛选并进行证据合成与评价,个别问题参考相关指南证据,同时考虑了我国患儿监护人的价值观、干预措施的成本等利弊平衡,逐步形成推荐意见 |
| 指南外审 | 指南初稿由9名外部同行专家评审 | 根据外审专家的反馈意见和建议进行指南完善 |
| 指南完成 | 由指南指导委员会批准 | 指南支撑数据保存于首都医科大学附属北京儿童医院 |
| 传播与实施 | 本指南分中文版和英文版。中文版将由《中华新生儿科杂志》发表,英文版将由Pediatric Investigation杂志发表 | 方法:①在相关学术会议中介绍和解读指南;②有计划地在全国范围内组织儿科、新生儿科等医护人员学习指南相关内容并能正确使用;③通过网络传播 |
| 指南更新 | 在指南发表后3~5年更新 |
注:NICU为新生儿重症监护病房,UVC为脐静脉置管,PICO为对象-干预-比较-结局方法
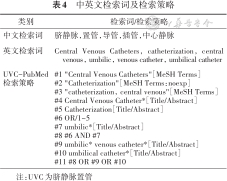
中英文检索词及检索策略
中英文检索词及检索策略
| 类别 | 检索词/检索策略 |
|---|---|
| 中文检索词 | 脐静脉,置管,导管,插管,中心静脉 |
| 英文检索词 | Central Venous Catheters, catheterization, central venous, umbilic, venous catheter, umbilical catheter |
| UVC-PubMed检索策略 | #1 "Central Venous Catheters"[MeSH Terms] #2 "Catheterization"[MeSH Terms:noexp] #3 "catheterization, central venous"[MeSH Terms] #4 Central Venous Catheter*[Title/Abstract] #5 Catheterization[Title/Abstract] #6 OR/1~5 #7 umbilic*[Title/Abstract] #8 #6 AND #7 #9 umbilic* venous catheter*[Title/Abstract] #10 umbilical catheter*[Title/Abstract] #11 #8 OR #9 OR #10 |
注:UVC为脐静脉置管

指南证据的检索、合成与评价
指南证据的检索、合成与评价
| 工作项目 | 具体内容 |
|---|---|
| 纳入标准 | ①研究对象:需要或已UVC置管的新生儿;②干预措施及对比措施:不限定;③结局指标:不限定;④研究类型:系统评价和Meta 分析;原始研究包括随机对照试验、队列研究、病例报告等 |
| 排除标准 | ①研究对象为单纯接受PICC置管的新生儿;②重复发表文献经讨论后排除其一;③会议摘要;④传统综述 |
| 数据来源 | ①数据库检索:包括PubMed、Embase、The Cochrane Library和CBM,中国知网、维普和万方数据库。检索时间截至2020年12月31日,发表语言为中文或英文。②指南相关资源:医脉通、NICE、WHO、GIN和UpToDate。③系统评价/Meta分析注册相关检索资源:国际PROSPERO注册平台。④临床试验相关资源:WHO ICTRP平台。⑤补充检索:查找UVC相关研究参考文献和百度学术 |
| 文献筛选和资料提取 | 由至少2名评价员依据纳入和排除标准及细化的干预措施和对比措施独立筛选文献,确定各临床问题的纳入文献;由2名评价员依据预先制定的资料提取表提取相关资料;意见不一致时相互讨论或咨询第三方协商 |
| 证据评价 | 使用AGREEⅡ、AMSTAR2分别对指南和系统评价/Meta分析进行方法学质量评价;采用偏倚风险评估工具对随机对照试验进行偏倚风险评估;使用纽卡斯尔-渥太华量表对队列研究进行方法学质量评价。实际质量根据具体临床问题PICO条目适当调整,重点考虑其关键条目综合判断。评价过程由2人独立完成,意见不一致时共同讨论或咨询第三方协商 |
注:UVC为脐静脉置管,PICC为经外周静脉中心静脉置管,PROSPERO为前瞻性系统评价注册平台, WHO ICTRP为世界卫生组织国际临床试验注册平台,AGREEⅡ为指南研究与评价工具Ⅱ,AMSTAR2为系统评价方法学质量评价工具2
本指南是我国第一部UVC导管相关并发症防控循证指南,存在以下局限性:(1)未涉及UVC操作过程中患儿发生病情变化时的诊治方法;(2)未涉及进行UVC操作人员的资质。
指南制定成员(按单位及姓氏汉语拼音排序)
指南制定组长:国家儿童医学中心,首都医科大学附属北京儿童医院新生儿中心(黑明燕)
指南指导委员会:北京大学第三医院儿科(朴梅花);北京大学第一医院儿科(姜毅);成都市妇女儿童中心医院新生儿科(巨容);重庆医科大学附属儿童医院新生儿诊疗中心(史源);贵阳市妇幼保健院新生儿科(刘玲);国家儿童医学中心,复旦大学附属儿科医院新生儿科(陈超);国家儿童医学中心,首都医科大学附属北京儿童医院临床流行病学及循证医学中心(彭晓霞),护理部(窦文艳、吴旭红);兰州大学循证医学中心/兰州大学GRADE中国中心(陈耀龙);首都儿科研究所附属儿童医院新生儿科(李莉);四川大学华西第二医院儿科(母得志);苏州大学附属儿童医院新生儿科(冯星);西北妇女儿童医院新生儿科(李占魁);浙江大学医学院附属儿童医院新生儿科(杜立中);中国医科大学附属盛京医院新生儿科(富建华);Pediatric Investigation编辑部(郭永丽)
指南制定工作组:新生儿专家:北京大学第三医院儿科(韩彤妍);北京大学第一医院儿科(冯琪、侯新琳);东南大学附属徐州医院儿童诊疗中心(高翔羽);国家儿童医学中心,复旦大学附属儿科医院新生儿科(张蓉、周文浩);国家儿童医学中心,首都医科大学附属北京儿童医院新生儿中心(黑明燕、齐宇洁);湖北省妇幼保健院新生儿科(夏世文);湖南省妇幼保健院新生儿科(曹蓓);吉林大学白求恩第一医院新生儿科(武辉);陆军军医大学陆军特色医学中心儿科(胡章雪);南京医科大学附属儿童医院新生儿医疗中心(程锐);内蒙古医科大学附属医院新生儿科(梅花);宁夏医科大学总医院儿童急救中心(邱银萍);温州医科大学附属第二医院新生儿科(陈尚勤);浙江大学医学院附属儿童医院新生儿科(马晓路);浙江大学医学院附属妇产医院新生儿科(朱佳骏)。影像科专家:国家儿童医学中心,首都医科大学附属北京儿童医院医学影像中心(彭芸)。产科专家:海南医学院第一附属医院妇产科(凌奕)。指南方法学专家:国家儿童医学中心,首都医科大学附属北京儿童医院临床流行病学及循证医学中心(刘雅莉)。院感专家:北京大学第一医院感染管理-疾病预防控制处(李六亿);中国人民解放军总院301医院感染管理与疾病控制科(刘运喜)。质控专家:国家儿童医学中心,首都医科大学附属北京儿童医院质量与安全控制办公室(刘敏)。护理专家:国家儿童医学中心,首都医科大学附属北京儿童医院护理部(钟学红)。NICU家长代表:高旭萌(北京三胞胎母亲)
指南证据合成与评价组:国家儿童医学中心,首都医科大学附属北京儿童医院新生儿中心(杜娟、耿文静、靳绯、杨子馨、郑旭、周婧婧);首都医科大学(罗婧洁、裴雪叶、覃菲、史明睿、朱杏);大连医科大学(张远)
指南外部评审小组:北京大学第三医院儿科(童笑梅);北京协和医院儿科(王丹华);广东省妇幼保健院新生儿科(杨杰);上海市儿童医院新生儿科(裘刚);首都医科大学附属北京友谊医院儿科(崔红);武汉大学中南医院循证与转化医学中心(靳英辉);郑州大学第三附属医院新生儿科(徐发林);中国人民解放军总院第五医学中心新生儿科(张雪峰);中南大学湘雅三医院儿科(薄涛)
(黑明燕 周文浩 李六亿 刘雅莉 郑旭 执笔)
感谢首都医科大学附属北京儿童医院图书馆老师们在文献检索方面的大力支持,感谢北京市医院管理中心儿科协同发展中心的科研经费支持(XTCX201816)
所有作者均声明不存在利益冲突


























