
分析影响肝癌肝移植术后复发受者生存状况的临床病理因素,总结诊治经验。
对102例符合"复旦标准"移植后肿瘤复发受者的临床病理特征及诊治方案进行比较(单因素分析),通过Cox多因素分析得到有独立意义的预后指标。
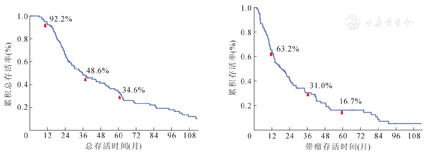
本组受者1、3、5年的总体存活率分别为92.2%、48.6%、34.6%,复发后1、3、5年的带瘤存活率分别为63.2%、31.0%、16.7%,Cox多因素分析示患者年龄、肿瘤可否切除、能否采取以靶向治疗为主的个体化诊治方案是影响总体存活率和带瘤生存率的独立预后因素。
肝移植术后肿瘤的复发转移严重影响受者生存,通过积极有效地精准诊治,部分受者仍可获得较满意的预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全球每年约有80余万病人死于肝癌,其致死率列各癌种第三位[1],肝移植在理论上彻底清除了肿瘤和肝病背景,随着围手术期技术的提高和免疫抑制剂的发展,很多患者可以长期存活,但肿瘤的复发转移仍严重影响预后。移植后肝癌复发转移的原因主要涉及术前未被发现的肝外微转移灶,手术操作过程中肿瘤的医源性播散以及术后肝癌的再形成[2]。本研究着重对移植术后肝癌复发患者生存状况和诊治策略进行分析讨论。
2001年4月至2020年9月复旦大学附属中山医院肝外科共为507例符合"复旦标准"(即单发肿瘤直径≤9 cm,或多发肿瘤≤3个,且最大肿瘤直径≤5 cm,全部肿瘤直径总和≤9 cm,无大血管侵犯、淋巴结转移及肝外转移)[3]的肝癌患者施行肝移植,随访期间共有102例受者复发,其中男性90例,女性12例,中位年龄48.5岁(30~73岁),3例患者接受活体肝移植,99例为原位经典肝移植。
移植术后免疫抑制方案采用他克莫司/环孢素A+麦考酚钠肠溶片/吗替麦考酚酯胶囊+巴利昔单抗+激素。术中甲泼尼龙(1 g,静脉注射),术后第1天总量240 mg,分4次静脉注射,以后5 d每日减少40 mg,术后第7天改口服甲泼尼龙片16 mg/d,逐渐递减,一般在移植后1个月内停止使用。复发后受者免疫抑制剂采用西罗莫司/依维莫司(Everolimus,2016年起开始使用)为主的免疫抑制方案,根据药物浓度或者CylexImmuKnow免疫细胞功能检测调整剂量,酌情加用其他类型的免疫抑制剂。
预防肿瘤复发方案:术中5-氟脲嘧啶(5-fluorouracil,5-FU)0.5 g在麻醉诱导完成以后开始静滴,5-FU另1 g稀释后冲洗腹腔防止脱落肿瘤细胞;术后如果病理提示有微血管侵犯(microvascu iar invasion,MVI)、肿瘤分化程度差等高危因素,则给予预防性全身化疗方案(FOLFOX/CapeOX)3~6个疗程或者靶向药(索拉非尼,2008年起开始使用)口服。复发患者至少每月来院随访一次,检查的肿瘤标志物包括甲胎蛋白(alpha-fetoprotein,AFP)、异常凝血酶原(des-gamma carboxyprothrombin,DCP)、甲胎蛋白异质体(AFP-L3),7种microRNA肝癌检测试剂盒推荐用于AFP阴性的患者,同时可结合循环肿瘤细胞(circulating tumor cells,CTC)监测肿瘤治疗情况。影像学检查包括肝脏超声、肝脏增强核磁共振、肺部CT等,根据肿瘤转移特点可予全身骨扫描或PET-CT/MRI。复发病灶若存在明确手术指征则予外科切除,反之根据肿瘤和病人身体状况给予肝动脉化疗栓塞术(transarterial chemoembolization,TACE)、射频消融术(radiofrequency ablation,RFA)、经皮酒精注射(percutaneous ethanol injection,PEI)、立体定向放疗(stereotactic body radiation therapy,SBRT)、靶向治疗(索拉非尼,仑伐替尼,瑞戈非尼)、全身化疗(FOLFOX/CapeOX方案)等,密切随访治疗导致的不良反应。
所有资料应用SPSS 20(IBM SPSS Statistics)统计软件处理,Kaplan-Meier方法计算总生存率和带瘤生存率,Log-Rank检验比较组间差异,多因素分析采用Cox风险比例模型,P<0.05为差异有统计学意义。
截至2020年11月,102例复发受者随访中位时间为30.3个月(6.1~194.0个月),移植至复发中位时间为12.9个月(3.1~131.2个月),共有82例受者因肿瘤复发死亡,复发后中位生存时间16.3个月(1.0~140.5个月)。本组受者1、3、5年的总体生存率分别为92.2%、48.6%、34.6% ,1、3、5年的带瘤生存率分别为63.2%、31.0%、16.7%(图1)。复发时肿瘤单发者24例、多发78例;局限于肝内复发者26例、肝外转移76例,依次是肺、骨、腹腔或腹壁、脑、淋巴结,肺转移共42例;复发后病灶不能切除者75例,可切除者27例(肝切除12例、肺切除6例、腹腔或腹壁肿瘤切除4例、肾上腺转移灶切除3例、骨转移灶切除2例)。

通过对受者年龄、性别、复发时AFP、肿瘤数目、有无远处转移、肿瘤累及器官数、肿瘤可否切除、能否采取以靶向治疗为主的个体化诊治方案(包括利用精准医学对复发肿瘤的早期发现、靶向治疗、对患者免疫状态精确调控和新型免疫抑制剂的应用等)进行单因素分析(表1),结果提示影响患者总体生存率的关键因素为复发时AFP高低、肿瘤可否手术、能否采取以靶向治疗为主的个体化诊治方案;影响带瘤生存率除了上述3个因素外还有性别。Cox多因素分析示年龄、肿瘤可否切除以及能否采取以靶向治疗为主的个体化诊治方案是影响患者总体生存率和带瘤生存率的独立预后因素(表2、表3)。
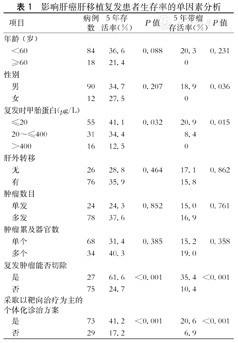
影响肝癌肝移植复发患者生存率的单因素分析
影响肝癌肝移植复发患者生存率的单因素分析
| 项目 | 病例数 | 5年存活率(%) | P值 | 5年带瘤存活率(%) | P值 | |
|---|---|---|---|---|---|---|
| 年龄(岁) | ||||||
| <60 | 84 | 36.6 | 0.088 | 20.3 | 0.231 | |
| ≥60 | 18 | 21.4 | 0 | |||
| 性别 | ||||||
| 男 | 90 | 34.7 | 0.207 | 18.9 | 0.036 | |
| 女 | 12 | 27.5 | 0 | |||
| 复发时甲胎蛋白(μg/L) | ||||||
| ≤20 | 55 | 41.1 | 0.032 | 20.9 | 0.015 | |
| 20~≤400 | 31 | 34.4 | 8.4 | |||
| >400 | 16 | 12.5 | 0 | |||
| 肝外转移 | ||||||
| 无 | 26 | 28.8 | 0.464 | 17.1 | 0.862 | |
| 有 | 76 | 35.9 | 15.8 | |||
| 肿瘤数目 | ||||||
| 单发 | 24 | 24.3 | 0.852 | 15.0 | 0.761 | |
| 多发 | 78 | 37.6 | 16.9 | |||
| 肿瘤累及器官数 | ||||||
| 单个 | 68 | 31.4 | 0.385 | 15.2 | 0.358 | |
| 多个 | 34 | 40.3 | 19.0 | |||
| 复发肿瘤能否切除 | ||||||
| 是 | 27 | 61.6 | <0.001 | 35.4 | <0.001 | |
| 否 | 75 | 24.7 | 10.4 | |||
| 采取以靶向治疗为主的个体化诊治方案 | ||||||
| 是 | 73 | 41.2 | <0.001 | 20.6 | <0.001 | |
| 否 | 29 | 17.2 | 6.9 | |||
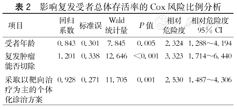
影响复发受者总体存活率的Cox风险比例分析
影响复发受者总体存活率的Cox风险比例分析
| 项目 | 回归系数 | 标准误 | Wald统计量 | P值 | 相对危险度 | 相对危险度95% CI |
|---|---|---|---|---|---|---|
| 受者年龄 | 0.843 | 0.301 | 7.845 | 0.005 | 2.324 | 1.288~4.194 |
| 复发肿瘤 | ||||||
| 能否切除 | 1.201 | 0.338 | 12.646 | <0.001 | 3.323 | 1.714~6.440 |
| 采取以靶向治疗为主的个体化诊治方案 | 0.928 | 0.271 | 11.705 | 0.001 | 2.530 | 1.487~4.306 |
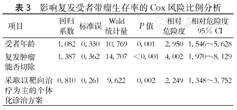
影响复发受者带瘤生存率的Cox风险比例分析
影响复发受者带瘤生存率的Cox风险比例分析
| 项目 | 回归系数 | 标准误 | Wald统计量 | P值 | 相对危险度 | 相对危险度95% CI |
|---|---|---|---|---|---|---|
| 受者年龄 | 1.082 | 0.330 | 10.769 | 0.001 | 2.950 | 1.546~5.628 |
| 复发肿瘤能否切除 | 1.387 | 0.362 | 14.707 | <0.001 | 4.002 | 1.970~8.129 |
| 采取以靶向治疗为主的个体化诊治方案 | 0.810 | 0.261 | 9.622 | 0.002 | 2.249 | 1.348~3.752 |
肝癌肝移植术后肿瘤的复发转移严重影响受者生存,本组受者5年总体存活率34.6%、带瘤生存率仅为16.7%,虽然"复旦标准"已通过国内多家中心验证,更适合中国国情,但仍需多中心协作研究以及结合其他敏感的生物标志物来提高预后判断的准确性[4,5]。2018年本中心与"Milan标准"提出者Mazzaferro教授合作,利用移植前影像学检查所示肿瘤的直径、数目和AFP等参数,验证了"Metroticket 2.0数据模型",通过官方网站(www.hcc-olt-metroticket.org)即可在术前对每例受者的预后有直观、精确地了解[6]。
由于处于免疫抑制状态,肿瘤复发后患者病情进展迅速,本研究多因素分析提示能否采取以靶向治疗为主的个体化诊治方案是影响预后的独立因素,两组受者在5年总体存活率和带瘤存活率上差异无统计学意义(41.2%比17.2%,20.6%比6.9%P<0.001)。经过20年的研究和经验积累,本中心采取以下个体化诊治措施以提高复发受者预后:(1)利用高通量生物信息检测、液体活检等新技术尽早发现肿瘤的复发转移,比如CTCs[7]、miRNA-7试剂盒[8]、cfDNA 5-羟甲基胞嘧啶[9](Cell free DNA 5-hydroxymethylcytosines)等新型检测指标的应用,当然这些生物标志物在肝移植领域的推广还需进一步临床验证。通过本次研究,让我们更加认识到肝癌肝移植受者长期随访的必要性,有2例受者在移植后10年余出现AFP逐渐升高,经过密切跟踪,分别在术后131.2个月和126.5个月发现肝外转移灶(1例髂骨转移、1例膈肌转移,均通过手术病理证实),由于处理及时,受者治疗效果均较理想(1例受者已带瘤生存45个月,另1例痊愈,都未发现肝内新发病灶)[10]。(2)根据二代测序(next generation sequencing,NGS)或人源异种移植模型(patient-derived xenograft,PDX)检测结果制定个体化靶向治疗方案[11];由于移植后受者肝功能和身体状况都较术前改善,对靶向药物续贯治疗的耐受性良好,Iavarone等[12]报道肝癌肝移植复发患者口服索拉非尼序贯瑞戈非尼中位生存期可达到38.4个月(95% CI 18.5~58.4个月)。(3)通过CylexImmuKnow免疫细胞功能检测对患者免疫抑制剂进行精确调整。中心前期研究观察到复发患者CD4+淋巴细胞腺苷三磷酸(ATP)含量明显低于未复发者(137.8±66.4) μg/L比(289±133.9) μg/L(P<0.01)[13],因此在避免排异反应发生的前提下,尽可能减少免疫抑制剂的使用。对于移植后肿瘤复发受者,我们选用西罗莫司作为主要的免疫抑制剂,既往研究证明西罗莫司可以协同靶向药物通过多种机制抑制肿瘤[14],其衍生物依维莫司有较强的抗癌效果[15],可能对复发受者的应用价值更大。(4)免疫检查点抑制剂的应用尝试。近年来免疫检查点抑制剂在肝癌治疗领域取得令人瞩目的效果[16,17],但41%的移植患者使用免疫检查点抑制剂后出现排斥反应[18],2020年起本中心对拟使用程序性死亡-受体1(programmed death-1,PD-1)抑制剂的移植受者先行肝穿刺活检以排除肝组织上有程序性死亡-配体1(programmed death ligand 1,PD-L1)的表达,这对减少急性排斥的发生有一定指导意义。本组中有1例受者尽管穿刺提示肝组织中有PD-L1表达,由于病人已尝试其它各种治疗方法失败,在充分了解用药的重大风险后,仍强烈要求使用PD-1抑制剂,受者在治疗后第7天出现肝损,病理证实为急性排斥反应,虽然给予激素冲击,仍在治疗后第146天死于急性排斥反应导致的肝功能衰竭[19],可见肝癌肝移植复发受者使用免疫检查点抑制剂需十分慎重,同时希望筛选出敏感的生物标志物来预测哪些移植受者更适合肿瘤免疫治疗。
本研究单因素和多因素分析还提示如果能手术切除病灶,可明显延长受者总体存活率和带瘤存活率(61.6%比24.7%、35.4%比10.4%P<0.001),本组中有1例受者移植后8个月出现肝内复发,手术切除后辅以其他综合治疗,无瘤生存达到91个月,可见外科手术对移植后肿瘤的复发治疗依然起到重要作用。Cox多因素分析还提示年龄也是影响受者预后的独立因素,推测年轻受者身体状况、对治疗的耐受程度都较老年受者好,可以有更多的治疗选择。由于本研究属于回顾性分析,纳入受者的时间跨度较大,在不同时期接受的诊治方案也不尽相同,对某些危险因素的分析可能存在一定偏倚,需要前瞻性、多中心的临床研究加以进一步证实。
综上所述,肝癌肝移植术后肿瘤复发转移是影响受者生存的重要因素,通过精准医学对复发肿瘤的早期发现、个体化的靶向药物治疗、对受者免疫状态的精确调控、新型免疫抑制剂的应用、慎重地使用肿瘤免疫治疗以及结合手术切除等综合治疗手段可以延长受者生存期,因此对移植术后肿瘤的复发转移应采取积极有效的应对措施,部分受者仍可获得较满意的预后。
所有作者均声明不存在利益冲突



























