
炎症性肠病(IBD)是累及胃肠道的一种慢性非特异性炎性疾病。维得利珠单克隆抗体(VDZ)作为一种新型生物制剂,通过阻止淋巴细胞向肠道炎症部位募集发挥治疗作用,具有肠道靶向性好、不良反应小的特点。本文就VDZ治疗IBD的药物机制、临床疗效及安全性、疗效相关预测因素进行论述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是一种累及胃肠道的慢性、复发性、非特异性炎性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)。随着饮食习惯、生活方式及环境的改变,我国IBD的发病率和患病率逐年上升[1]。
近年来,IBD的治疗方式不断进展,除了传统治疗药物5-氨基水杨酸、糖皮质激素、免疫抑制剂外,新型生物制剂使IBD患者获益良多。环境和遗传因素作用下肠道菌群失衡造成机体异常免疫反应被认为是IBD发病的重要机制,调节机体异常免疫反应是近年来药物研发的重要方向。维得利珠单克隆抗体(vedolizumab,VDZ;单克隆抗体以下简称"单抗")作为目前唯一的肠道选择性新型生物制剂,通过阻止淋巴细胞向肠道炎症部位募集发挥治疗作用,具有肠道靶向性好、不良反应小的特点。本文就VDZ治疗IBD的药物机制、临床疗效及安全性、疗效相关预测因素进行论述。
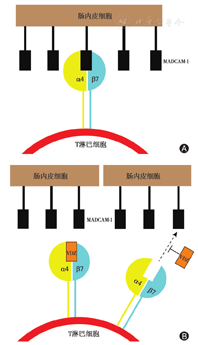
整合素(intergin)是一种表达于淋巴细胞表面的跨膜受体蛋白,介导细胞间及细胞与细胞外基质之间相互识别和黏附,在免疫调节方面发挥重要作用。整合素α4β7主要表达于记忆T淋巴细胞表面,通过与其配体黏膜地址素细胞黏附分子-1(mucosal addressin cell adhesion molecule-1,MAdCAM-1)相互作用,特异性地介导淋巴细胞向派氏小结、肠系膜淋巴结等内脏相关淋巴组织归巢,在肠道炎性疾病中发挥重要作用。正常情况下,MAdCAM-1低表达,整合素处于静息状态。胃肠道发生炎症反应时,多种促炎细胞因子诱导肠黏膜内皮细胞过表达MAdCAM-1;趋化因子作用下淋巴细胞通过炎症部位时其表面的整合素α4β7受体蛋白被激活,与配体MAdCAM-1呈高亲和状态,促进淋巴细胞在肠道炎症部位黏附,加重炎症反应[2]。
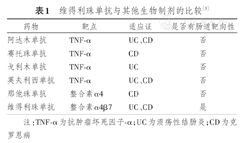
VDZ是一种靶向于整合素α4β7的重组人源化IgG单抗,特异性地与整合素α4β7结合,抑制淋巴细胞与MAdCAM-1相互作用,封闭T淋巴细胞、嗜酸性粒细胞在胃肠道黏附、外渗,抑制炎性细胞向肠道募集,选择性抑制胃肠道炎症,改善肠道炎症状态[3](图1)。与其他生物制剂相比,VDZ具有肠道靶向性好的特点(表1)[3]。

维得利珠单抗与其他生物制剂的比较[3]
维得利珠单抗与其他生物制剂的比较[3]
| 药物 | 靶点 | 适应证 | 是否有肠道靶向性 |
|---|---|---|---|
| 阿达木单抗 | TNF-α | UC、CD | 否 |
| 赛托珠单抗 | TNF-α | CD | 否 |
| 戈利木单抗 | TNF-α | UC | 否 |
| 英夫利西单抗 | TNF-α | UC、CD | 否 |
| 那他珠单抗 | 整合素α4 | CD | 否 |
| 维得利珠单抗 | 整合素α4β7 | UC、CD | 是 |
注:TNF-α为抗肿瘤坏死因子-α;UC为溃疡性结肠炎;CD为克罗恩病
2020年3月12日VDZ获得我国国家药品监督管理局批准,用于对传统治疗或抗肿瘤坏死因子(tumor necrosis factor,TNF)-α单抗应答不充分、失应答或不耐受的中重度活动性成年UC和CD患者。
临床随机对照试验(GEMINI I/II/III)发现,与安慰剂相比,VDZ可有效诱导和维持IBD患者临床缓解。VDZ能实现持久的临床缓解和黏膜愈合[5,6,7]。VERSIFY研究发现,CD患者使用VDZ治疗的26周、52周内镜缓解率分别为11.9%和17.9%,磁共振肠造影检查影像学缓解率分别为21.9%和38.1%,结肠组织学应答率分别为24.4%和20.5%,回肠组织学应答率分别为28.3%和34.3%,完全黏膜愈合率随着给药时间的延长而增加[4]。此外,Sands等[8]一项3期随机双盲多中心对照研究头对头比较了VDZ与阿达木单抗治疗成人中重度UC患者的疗效,治疗52周两组患者临床缓解率分别为31.3%和22.5%,内镜改善率分别为39.7%和27.7%,VDZ治疗UC患者的临床疗效明显优于阿达木单抗。
随着VDZ在各个国家上市,探究其安全性和有效性的真实世界临床研究越来越多。美国VICTORY联盟的一项多中心回顾性研究报道了VDZ治疗中重度CD患者6、12、18个月后的临床缓解率分别为18%、35%和54%,治疗12个月后的累计黏膜愈合率与深度缓解(临床缓解且黏膜愈合)率为63%和26%[9]。同样,欧洲GETAID的一项临床研究发现,在治疗第6周,32% UC患者和31% CD患者达到了临床缓解;第54周有40.5% UC患者和27.2% CD患者达到无激素临床缓解[10]。这两项真实世界临床研究进一步证实VDZ对使用过抗TNF-α单抗的患者同样有效。
一项多中心队列研究纳入151例并发肛周病变的CD患者,22.5%患者经VDZ治疗6个月后临床检查无引流瘘(draining fistula)、无原发性肛门溃疡。经分析,使用VDZ治疗之前已使用抗TNF-α单抗超过3次或与其他生物制剂共计超过3次的患者,VDZ治疗后肛周病变改善的可能性小[11]。
除累及胃肠道外,IBD还可侵犯多个肠外器官,如皮肤(坏疽性脓皮病、结节性红斑、银屑病)、肝脏(肝炎、原发性硬化性胆管炎)、眼部(虹膜炎、葡萄膜炎)、关节等。UC、CD肠外表现发生率分别为35%、55%,严重影响患者生活质量。Thomas等[12]总结了大量的临床研究数据认为,VDZ虽无法有效治疗已发生的肠外表现(原发性硬化性胆管炎、关节痛、关节炎、皮肤病变),但对于CD患者,新发关节炎和关节痛在VDZ治疗组与安慰剂组中的发生率分别为28%和39%。经分析,新的肠外表现(风湿症状)在VDZ治疗组发生率明显低于安慰剂组,VDZ治疗与CD患者关节炎和(或)关节痛的新发或恶化的可能性降低有关;而在UC患者中,使用VDZ与安慰剂治疗组关节炎和(或)关节痛的新发或加重的发生率是相似的[12,13]。
Cohen等[14]分析了VDZ上市后报道的不良反应事件,最常见的为胃肠道不良反应(包括疾病的恶化、腹泻、腹痛、恶心、便血、呕吐等),占所有不良反应事件的15%。恶性肿瘤(包括下消化道肿瘤、肾癌和膀胱癌、淋巴瘤、呼吸道恶性肿瘤、皮肤癌等)、肝胆疾病(肝酶升高和丙氨酸转氨酶升高)、注射部位反应(外渗、疼痛、挫伤)的发生率均占所有不良反应事件的不到1%。大部分不良反应较轻,常发生于70岁以下的患者,迄今为止没有发现新的安全问题,进一步证实了VDZ良好的安全性。这可能与VDZ选择性作用于胃肠道,抑制胃肠道炎症反应,而不影响其他组织器官的免疫功能相关。
Verstockt等[15]的前瞻性研究收集使用VDZ治疗的IBD患者炎性结肠活组织进行RNA测序与免疫组化分析,发现达到内镜缓解与未达到内镜缓解的患者基线水平有4个基因(PIWIL1,MAATS1,RGS13,DCHS2)表达存在显著性差异,提示基线时结肠组织中这些基因的表达水平与VDZ治疗能否达到内镜缓解有关,对临床疗效有预测作用。
黏膜屏障功能障碍在CD患者肠道炎症反应中扮演了重要的作用,肠上皮细胞焦亡近来被视为是导致屏障功能障碍的原因之一。Osterman等[16]发现CD患者基线水平时回肠活检焦亡细胞比例小于1.4%,对VDZ的临床应答率、临床缓解率更高;当回肠活检焦亡细胞比例小于2.2%,VDZ治疗后的内镜改善更好。焦亡作为一种先天免疫激活的黏膜生物标志物,是一种有效的临床应答和临床缓解的预测因子,也是VDZ治疗达到内镜缓解的决定因素之一。
包括T淋巴细胞、嗜酸性粒细胞在内的白细胞向胃肠道炎症部位迁移是IBD病理特点的关键。组织学上,肠黏膜嗜酸性粒细胞的存在是疾病活动度的标志。一项回顾性队列研究纳入65例使用VDZ治疗的IBD患者,发现对VDZ无应答的患者在基线水平时黏膜平均嗜酸性粒细胞数量较多,经多因素分析发现,结合结肠黏膜嗜酸性粒细胞密度与预先使用过抗TNF-α单抗来预测患者使用VDZ治疗6个月无应答的准确率高[17]。
Bertani等[18]纳入27例中重度UC患者使用VDZ治疗54周发现,治疗后黏膜愈合患者的IL-8基线表达水平高于未愈合患者[22.07(17.99,33.75)pg/ml比8.16(5.73,19.27)pg/ml,P = 0.01];治疗前6周IL-6和IL-8水平与基线值相比显著下降的患者,VDZ治疗临床缓解、黏膜愈合的可能性更高,预测VDZ治疗54周后黏膜愈合和临床缓解的敏感度和特异度分别为83%和82%、90%和87%。
一项前瞻性研究纳入32例UC患者接受VDZ治疗发现,在临床缓解与内镜缓解患者中,血清可溶性整合素α4β7浓度随时间迅速上升,达到临床缓解的患者在14周及26周后可溶性整合素α4β7浓度较高;可溶性MAdCAM-1与脉管细胞黏附分子-1的浓度随时间迅速下降。UC患者使用VDZ维持治疗期间可以使用这些生物标志物进行临床疗效、内镜疗效预测。可溶性TNF-α与细胞间黏附分子-1的浓度随时间的变化只与内镜缓解相关,与临床缓解无明显相关[19]。这些指标可作为VDZ治疗的潜在预测因子,而其对VDZ治疗疗效的真正预测作用尚需进一步的研究证实。
Guidi等[20]发现第14周VDZ谷浓度水平较高(>16.55 μg/ml),预测使用VDZ维持治疗1年获得临床疗效(即在无需激素、新的免疫抑制剂或者是手术条件下,临床症状明显改善)的灵敏度为73.3%,特异性为59.4%,且该指标与临床缓解和黏膜愈合均相关;UC患者VDZ谷浓度水平与治疗1年获得临床疗效的可能性相关,有统计学意义(HR 2.18,P = 0.047),而在CD患者中差异无统计学意义(HR 2.39,P = 0.16)。早期VDZ谷浓度的监测有助于指导患者在治疗的诱导期达到足够高的药物浓度,从而在第1年获得更好的临床疗效。
一项回顾性研究分析IBD患者使用VDZ治疗14周的临床效果,发现UC患者病变发生在远端或左半结肠者更容易诱导临床缓解,而炎症涉及广泛结肠、疾病的临床活动度与VDZ治疗后临床缓解呈负相关。UC患者黏膜炎症的发生部位是VDZ治疗后诱导临床缓解的决定性因素之一[21]。
生物制剂治疗过程中,患者对药物失应答是临床实践中的一个重要问题。Shmidt等[22]量化了VDZ失应答率,评估了不同策略对VDZ失应答管理的有效性,发现IBD患者在使用VDZ治疗半年、一年后继发性失应答累计发生率分别为20%和35%,其中UC患者失应答率更高;既往对抗TNF-α单抗失应答、基线时C-反应蛋白浓度高是VDZ治疗过程中失应答的预测因素,而缩短给药间隔有助于患者对VDZ重新获得应答。
Dulai等[23,24,25]制定了一套VDZ治疗IBD患者疗效预测的临床决策支持工具(clinical decision support tool,CDST)(表2)。该工具经外部验证综合性能好、准确性高,可在基线时准确预测暴露-疗效关系,帮助确定患者是否可通过缩短给药周期而获益,同时有着高度的敏感性来排除VDZ治疗临床疗效不佳的患者,有助于临床医生对IBD患者优化个体化的治疗方案。
| 疾病类型 | 评分标准(分) | 结果(评分,对VDZ应答的可能性) |
|---|---|---|
| UC | 未使用抗TNF-α单抗(+3) | 评分≤26分,低可能性 |
| 病程≥2年(+3) | 26分<评分≤32分,中可能性 | |
| 基线内镜检查疾病活动度为中重度(+2) | 评分>32分,高可能性 | |
| 基线血清蛋白浓度(+0.65每单位白蛋白浓度) | ||
| CD | 未做过肠道手术(+2) | 评分≤13分,低可能性 |
| 未使用抗TNF-α抗体(+3) | 13分<评分≤19分,中可能性 | |
| 无瘘管病史(+2) | 评分>19分,高可能性 | |
| 基线白蛋白水平(+0.4每单位白蛋白) | ||
| 基线C反应蛋白水平(3 ~ 10 mg/L:-0.5;大于10 mg/L:-3) |
注:UC为溃疡性结肠炎;CD为克罗恩病;TNF-α为肿瘤坏死因子-α;VDZ为维得利珠单抗
随着对IBD发病机制越来越清晰的认识,IBD治疗正进入"精准"治疗的新时代。VDZ在IBD治疗中显示了良好的安全性及有效性,尤其可用于治疗难治性中、重度UC患者及使用抗TNF-α单抗治疗失败的患者。VDZ在中国的获批使IBD患者获得了更多的治疗选择。影响VDZ应用的因素包括临床医生对药物的认识、药效疗效以及药物的售价等,未来也需要更多我国的临床数据对用药进行指导。此外,采用新技术对药物进行优化的研究也在不断进行,如通过改变给药方式使药物使用更便捷,通过纳米载药技术增加疗效、降低药物成本、减少不良反应发生等,必将使患者获得更大收益。
所有作者均声明不存在利益冲突




























