
探索真实世界中,围手术期化疗对胃癌患者预后的影响。
采用回顾性队列研究方法,收集2014年1月1日至2016年1月31日期间辽宁省肿瘤医院、天津医科大学肿瘤医院等全国33家医院胃癌围手术期化疗及手术+辅助化疗病例的真实世界资料。病例纳入标准:(1)经病理组织学确诊的胃腺癌,临床分期cT2~4aN0-3M0(AJCC第8版);(2)行D2胃癌根治手术;(3)至少完成1周期的新辅助化疗;(4)至少完成4周期辅助化疗[SOX(替吉奥+奥沙利铂)或CapeOX(卡培他滨+奥沙利铂)]。排除标准:(1)合并其他恶性肿瘤;(2)接受过放疗;(3)资料数据不全者。将入组患者中接受了新辅助化疗和辅助化疗者纳入围手术期化疗组,将单纯接受术后辅助化疗的患者纳入手术+辅助化疗组。采用倾向性评分匹配法控制和减小选择性偏倚。结局指标为两组患者倾向评分匹配后的总生存时间(OS)和肿瘤无进展生存时间(PFS),OS定义为第1次新辅助化疗时间(手术+辅助化疗组自手术时间)至末次有效随访时间或患者死亡时间;PFS定义为第1次新辅助化疗时间(手术+辅助化疗组自手术时间)至患者首次影像学诊断进展时间或死亡时间。采用Kaplan-Meier法估计生存率,使用Cox比例风险回归模型比较两组患者的OS和PFS。
纳入病例2 045例,其中手术+辅助化疗组1 293例,围手术期化疗组752例。倾向评分匹配后,围手术期化疗组和手术+辅助化疗组各492例患者资料纳入研究,两组患者性别、年龄、体质指数、治疗前肿瘤分期、肿瘤部位的差异均无统计学意义(均P>0.05)。与手术+辅助化疗组相比,围手术期化疗组患者的全胃切除术比例更高(χ2=40.526,P<0.001),切除肿瘤最大直径更小(t=3.969,P<0.001),转移淋巴结数目少(t=1.343,P<0.001),侵犯脉管(χ2=11.897,P=0.001)和神经(χ2=12.338,P<0.001)的比例更低。围手术期化疗组和手术+辅助化疗组胃癌D2根治术后分别有24例(4.9%)和17例(3.4%)出现并发症,组间比较差异无统计学意义(χ2=0.815,P=0.367)。围手术期化疗组中位OS长于手术+辅助化疗组(65个月比45个月,HR:0.74,95% CI:0.62~0.89,P=0.001);围手术期化疗组的中位PFS也长于手术+辅助化疗组(56个月比36个月,HR=0.72,95% CI:0.61~0.85,P<0.001)。亚组OS和PFS森林图分析结果显示,无论男、女都能从围手术期新辅助化疗中获益(均P<0.05);45岁以上年龄(P<0.05)和正常体质量(P<0.01)患者获益明显,cTNMⅡ期和Ⅲ期患者有获益趋势或者显著获益(P<0.05);印戒细胞癌患者获益不明显(P>0.05);胃体、胃窦部位肿瘤获益更明显(P<0.05)。
新辅助化疗能够改善胃癌患者的预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是世界范围内第5位常见的恶性肿瘤,第3位癌症死因[1]。我国是胃癌的高发国家,2015年胃癌的发病率和死亡率位居所有恶性肿瘤的第2位,仅次于肺癌[2]。目前,胃癌的治疗方法主要包括手术、化疗、放疗、靶向药物治疗和免疫治疗。对于局部进展期胃癌,胃癌D2根治术为标准手术[3,4,5];D2手术+辅助化疗为标准治疗方案[6]。而MAGIC研究的结果,使得围手术期化疗(术前新辅助化疗和术后辅助化疗)成为了胃癌的规范治疗策略之一[7]。新辅助化疗可以清除术前播散在术野外微小转移的癌细胞,使原发肿瘤降期缩小,甚至能达到病理完全缓解,使手术达到更高的R0切除率。
中国新辅助化疗自2010年逐渐起步。为更好地探索胃癌围手术期的治疗方案,比较围手术期化疗与单纯术后辅助化疗的疗效,本研究收集国内33家医疗中心产生的胃癌围手术期化疗的真实世界数据,系统分析了围手术期的安全性,以及其对患者总体生存(overall survival,OS)和无进展生存(progression-free survival,PFS)的影响。
本研究为多中心真实世界回顾性研究。本研究的开展通过天津医科大学肿瘤医院医学伦理委员会审批(审批号:E2020216)。
病例纳入标准:(1)组织学确诊胃腺癌,临床分期cT2~4aN0~3M0(美国癌症联合会指南第8版[5]);(2)行D2胃癌根治手术(日本胃癌治疗指南第5版[3]);(3)至少完成1周期的新辅助化疗(不限化疗方案);(4)至少完成4周期辅助化疗,化疗方案为SOX(替吉奥+奥沙利铂)或CapeOX(卡培他滨+奥沙利铂)。排除标准:(1)合并其他恶性肿瘤;(2)接受过放疗。剔除2014年以前和2016年1月31日以后的局部进展期胃癌病例。
按照上述标准,回顾性收集了辽宁省肿瘤医院、天津医科大学肿瘤医院等全国33家医院2014年1月1日至2016年1月31日期间,接受围手术期化疗或单纯接受辅助化疗的3 074例局部进展期胃癌患者临床病理资料,病例来源单位见表1。在统计过程中,发现有129例不符合入组条件,进一步予以排除,最终共计2 945例患者入组,其中1 293例为仅术后接受辅助化疗者(手术+辅助化疗组),752例接受了术前新辅助化疗+手术+辅助化疗(围手术期化疗组)。本研究的开展通过天津医科大学肿瘤医院医学伦理委员会审批(审批号:E2020216);所有患者均获知情同意。

3 074例胃癌病例来源单位分布情况(例)
3 074例胃癌病例来源单位分布情况(例)
| 来源单位 | 病例数 |
|---|---|
| 辽宁省肿瘤医院 | 421 |
| 河北医科大学第四医院 | 300 |
| 山西省肿瘤医院 | 291 |
| 天津医科大学肿瘤医院 | 270 |
| 解放军总医院 | 238 |
| 上海交通大学医学院附属瑞金医院 | 218 |
| 新疆医科大学附属肿瘤医院 | 149 |
| 山东大学齐鲁医院 | 130 |
| 空军军医大学唐都医院 | 129 |
| 浙江省肿瘤医院 | 100 |
| 福建省肿瘤医院 | 84 |
| 河南省肿瘤医院 | 74 |
| 福建医科大学附属协和医院 | 70 |
| 哈尔滨医科大学附属肿瘤医院 | 63 |
| 复旦大学附属肿瘤医院 | 61 |
| 青岛大学附属医院 | 54 |
| 浙江大学医学院附属第二医院 | 48 |
| 吉林大学中日联谊医院 | 42 |
| 云南省肿瘤医院 | 38 |
| 无锡明慈心血管病医院 | 33 |
| 南昌大学第二附属医院 | 30 |
| 山东省立医院 | 30 |
| 山东省肿瘤医院 | 30 |
| 华中科技大学同济医学院附属协和医院 | 24 |
| 东部战区总医院 | 22 |
| 南昌大学第一附属医院 | 21 |
| 中南大学湘雅医院 | 21 |
| 山东第一医科大学第三附属医院 | 20 |
| 新疆医科大学第一附属医院 | 17 |
| 江西省肿瘤医院 | 16 |
| 四川省肿瘤医院 | 13 |
| 北京协和医院 | 11 |
| 宁波市第一医院 | 6 |
主要观察指标为OS和PFS。OS定义为第1次新辅助化疗时间(手术+辅助化疗组自手术时间)至末次有效随访时间或患者死亡时间;PFS定义为第1次新辅助化疗时间(手术+辅助化疗组自手术时间)至患者首次影像学诊断进展时间或死亡时间。次要观察指标为手术情况及术后并发症发生情况,包括手术范围、手术方式、手术根治度以及淋巴结清扫、切除肿瘤最大径、病理分化类型、累犯血管淋巴管和神经等手术情况及术后并发症(包括腹腔感染、吻合口漏、肠梗阻等)。同时对OS和PFS进行亚组分析。
采用门诊、电话方式和社交网络平台进行随访,了解患者术后生存情况。随访截至2020年9月。
采用SPSS 26与R 4.03软件包进行统计学分析。
对围手术期化疗组和手术+辅助化疗组采用倾向性评分匹配法(propensity score matching,PSM)进行OS和PFS以及手术安全性的分析比较。平衡因素包括年龄、性别、体质指数(body mass index,BMI)、病理分化类型和肿瘤部位,完全匹配因素包括病例来源单位和治疗前肿瘤临床TNM分期(cTNM)。PSM以1∶1比例匹配(卡钳值为0.1)进行分析,匹配后的组间均衡性比较采用标准化差异,小样本临床研究中,标准化差异<0.1表示该因素在两组有较好的均衡性;若需平衡的因素过多,标准化差异>0.1的因素应尽量优化至0.1。
服从正态分布的计量资料采用 ±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(范围)表示,组间比较采用Mann-WhitneyU秩和检验。计数资料采用[例(%)]表示,组间比较采用χ2检验或Fisher精确检验。采用Kaplan-Meier法估计生存率,采用Cox比例风险回归模型比较两组生存状况,同时估计风险比(HR)及95% CI;对于平衡因素进行亚组分析,且以森林图的形式呈现。以上检验均为双侧检验,设定α=0.05,即P<0.05差异有统计学意义。
±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(范围)表示,组间比较采用Mann-WhitneyU秩和检验。计数资料采用[例(%)]表示,组间比较采用χ2检验或Fisher精确检验。采用Kaplan-Meier法估计生存率,采用Cox比例风险回归模型比较两组生存状况,同时估计风险比(HR)及95% CI;对于平衡因素进行亚组分析,且以森林图的形式呈现。以上检验均为双侧检验,设定α=0.05,即P<0.05差异有统计学意义。
倾向性评分匹配后,手术+辅助化疗组和围手术期化疗组各得到492例共计984例患者纳入生存分析,入组流程见图1。
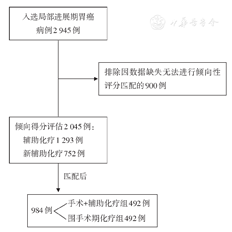

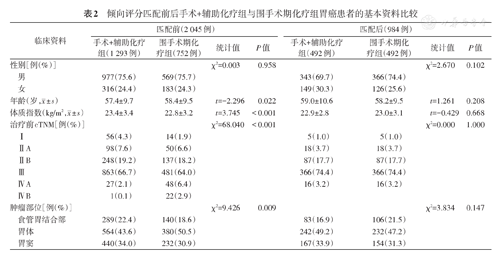
匹配前,与手术+辅助化疗组相比,围手术期化疗组患者的年龄偏大、BMI偏低、肿瘤临床分期较晚、肿瘤多位于胃中部(均P<0.05);匹配后,两组间标准化差异均接近0.1,表明两组间控制因素均衡性较好,具有可比性。匹配前后两组患者基本资料见表2。
倾向评分匹配前后手术+辅助化疗组与围手术期化疗组胃癌患者的基本资料比较
倾向评分匹配前后手术+辅助化疗组与围手术期化疗组胃癌患者的基本资料比较
| 临床资料 | 匹配前(2 045例) | 匹配后(984例) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 手术+辅助化疗组(1 293例) | 围手术期化疗组(752例) | 统计值 | P值 | 手术+辅助化疗组(492例) | 围手术期化疗组(492例) | 统计值 | P值 | ||
| 性别[例(%)] | χ2=0.003 | 0.958 | χ2=2.670 | 0.102 | |||||
| 男 | 977(75.6) | 569(75.7) | 343(69.7) | 366(74.4) | |||||
| 女 | 316(24.4) | 183(24.3) | 149(30.3) | 126(25.6) | |||||
年龄(岁, ±s) ±s) | 57.4±9.7 | 58.4±9.5 | t=-2.296 | 0.022 | 59.0±10.6 | 58.2±9.5 | t=1.261 | 0.208 | |
体质指数(kg/m2, ±s) ±s) | 23.4±3.4 | 22.8±3.2 | t=3.745 | <0.001 | 22.9±2.8 | 23.0±3.1 | t=-0.429 | 0.668 | |
| 治疗前cTNM[例(%)] | χ2=68.040 | <0.001 | χ2=0.000 | 1.000 | |||||
| Ⅰ | 56(4.3) | 14(1.9) | 5(1.0) | 5(1.0) | |||||
| ⅡA | 98(7.6) | 50(6.6) | 18(3.7) | 18(3.7) | |||||
| ⅡB | 248(19.2) | 137(18.2) | 87(17.7) | 87(17.7) | |||||
| Ⅲ | 863(66.7) | 481(64.0) | 366(74.4) | 366(74.4) | |||||
| ⅣA | 27(2.1) | 48(6.4) | 16(3.2) | 16(3.2) | |||||
| ⅣB | 1(0.1) | 22(2.9) | |||||||
| 肿瘤部位[例(%)] | χ2=9.426 | 0.009 | χ2=3.834 | 0.147 | |||||
| 食管胃结合部 | 289(22.4) | 140(18.6) | 83(16.9) | 106(21.5) | |||||
| 胃体 | 564(43.6) | 380(50.5) | 242(49.2) | 232(47.2) | |||||
| 胃窦 | 440(34.0) | 232(30.9) | 167(33.9) | 154(31.3) | |||||
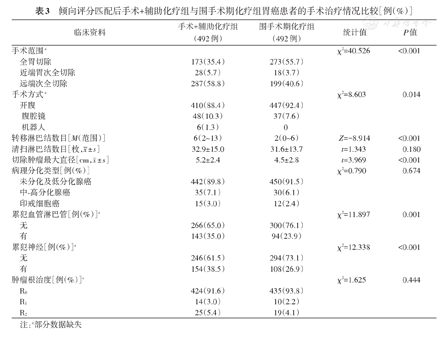
与手术+辅助化疗组治疗情况相比,围手术期化疗组行全胃切除术比例更高、切除肿瘤最大直径小、转移淋巴结的数目少、侵犯脉管和神经的比例更低,差异均有统计学意义(均P<0.05)。见表3。
倾向评分匹配后手术+辅助化疗组与围手术期化疗组胃癌患者的手术治疗情况比较[例(%)]
倾向评分匹配后手术+辅助化疗组与围手术期化疗组胃癌患者的手术治疗情况比较[例(%)]
| 临床资料 | 手术+辅助化疗组(492例) | 围手术期化疗组(492例) | 统计值 | P值 | |
|---|---|---|---|---|---|
| 手术范围a | χ2=40.526 | <0.001 | |||
| 全胃切除 | 173(35.4) | 273(55.7) | |||
| 近端胃次全切除 | 28(5.7) | 18(3.7) | |||
| 远端次全切除 | 287(58.8) | 199(40.6) | |||
| 手术方式a | χ2=8.603 | 0.014 | |||
| 开腹 | 410(88.4) | 447(92.4) | |||
| 腹腔镜 | 48(10.3) | 37(7.6) | |||
| 机器人 | 6(1.3) | 0 | |||
| 转移淋巴结数目[M(范围)] | 6(2~13) | 2(0~6) | Z=-8.914 | <0.001 | |
清扫淋巴结数目[枚, ±s] ±s] | 32.9±15.0 | 31.6±13.7 | t=1.343 | 0.180 | |
切除肿瘤最大直径[cm, ±s] ±s] | 5.2±2.4 | 4.5±2.8 | t=3.969 | <0.001 | |
| 病理分化类型[例(%)] | χ2=0.790 | 0.674 | |||
| 未分化及低分化腺癌 | 442(89.8) | 450(91.5) | |||
| 中-高分化腺癌 | 35(7.1) | 30(6.1) | |||
| 印戒细胞癌 | 15(3.0) | 12(2.4) | |||
| 累犯血管淋巴管[例(%)]a | χ2=11.897 | 0.001 | |||
| 无 | 266(65.0) | 300(76.1) | |||
| 有 | 143(35.0) | 94(23.9) | |||
| 累犯神经[例(%)]a | χ2=12.338 | <0.001 | |||
| 无 | 246(61.5) | 294(73.1) | |||
| 有 | 154(38.5) | 108(26.9) | |||
| 肿瘤根治度[例(%)]a | χ2=1.625 | 0.444 | |||
| R0 | 424(91.6) | 435(93.8) | |||
| R1 | 14(3.0) | 10(2.2) | |||
| R2 | 25(5.4) | 19(4.1) | |||
注:a部分数据缺失
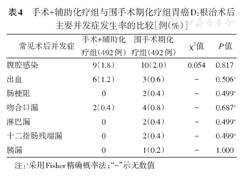
围手术期化疗组和手术+辅助化疗组胃癌D2根治术后各有24例(4.9%)和17例(3.4%)发生并发症,组间比较差异无统计学意义(χ2=0.815,P=0.367)。见表4。
手术+辅助化疗组与围手术期化疗组胃癌D2根治术后主要并发症发生率的比较[例(%)]
手术+辅助化疗组与围手术期化疗组胃癌D2根治术后主要并发症发生率的比较[例(%)]
| 常见术后并发症 | 手术+辅助化疗组(492例) | 围手术期化疗组(492例) | χ2值 | P值 |
|---|---|---|---|---|
| 腹腔感染 | 9(1.8) | 10(2.0) | 0.054 | 0.817 |
| 出血 | 6(1.2) | 3(0.6) | - | 0.506a |
| 肠梗阻 | 0 | 2(0.4) | - | 0.499a |
| 吻合口漏 | 2(0.4) | 4(0.8) | - | 0.687a |
| 淋巴漏 | 0 | 2(0.4) | - | 0.499a |
| 十二指肠残端漏 | 0 | 2(0.4) | - | 0.499a |
| 胰漏 | 0 | 1(0.2) | - | 1.000 |
注:a采用Fisher精确概率法;"-"示无数值
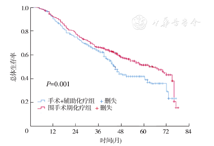
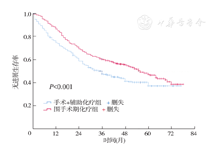
手术+辅助化疗组和围手术期化疗组中位OS分别为45个月和65个月,组间比较,差异有统计学意义(HR=0.74,95% CI:0.62~0.89,P=0.001),见图2。手术+辅助化疗组和围手术期化疗组中位PFS分别为36个月和56个月,组间比较,差异也有统计学意义(HR=0.72,95% CI:0.61~0.85,P<0.001),见图3。


(1)总体生存:匹配后,不同性别、年龄、体质指数、cTNM分期、病理分化类型和肿瘤部位各亚组的OS比较,差异有统计学意义(均P<0.05)。森林图结果显示,无论男、女患者都能从新辅助化疗中获益;45岁以上年龄和体质指数正常患者获益明显,cTNM ⅡA期患者显著获益,Ⅲ期患者有获益趋势;印戒细胞癌患者获益不明显;各部位肿瘤都有获益的趋势。见图4。(2)无进展生存:匹配后不同性别、年龄、体质指数、cTNM分期、病理分化和肿瘤部位各亚组的PFS比较,差异也均有统计学意义(均P<0.05)。森林图结果显示,无论男、女患者都能从新辅助化疗中获益;45岁以上年龄和正常体质量患者获益明显;cTNMⅡ期和Ⅲ期患者有获益趋势或者显著获益;印戒细胞癌患者获益不明显;胃体、胃窦部位肿瘤获益更明显。见图5。
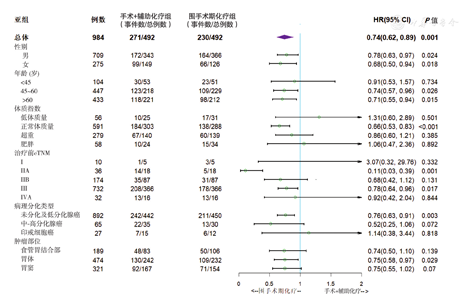

注:事件数为死亡病例数
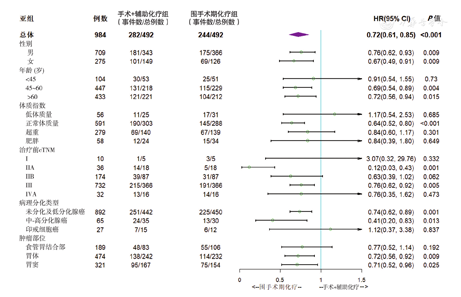

注:事件数为疾病发生进展病例数
2019年,美国国立综合癌症网络胃癌治疗指南对于无远处转移、潜在可切除的cT2以上病例,推荐进行围手术期化疗或手术[8]。日本胃癌治疗指南(2018年,第5版)推荐,对cT2~4、具有融合淋巴结的病例进行新辅助化疗[3]。FLOT4研究中,T3~4期患者比例超过70%[9]。我国的胃癌人群有别于日本、韩国,存在以进展期胃癌为主和5年OS低等特点。早些年,我国胃癌治疗以手术+辅助化疗为主,围手术期化疗正处于起步阶段,多选择分期相对较晚、手术难度相对较大的患者实施围手术期化疗。所以,本研究中围手术期化疗组患者的肿瘤分期相对较晚,匹配前围手术期化疗组Ⅲ和Ⅳ期胃癌患者占73.3%,手术+辅助化疗组为68.9%(χ2=68.040,P<0.001);本研究除了平衡年龄、性别、BMI、病理分化类型与肿瘤部位因素外,将cTNM作为完全匹配因素,其目的是为了更好地评估围手术期化疗对治疗和预后的影响。
RESONANCE研究结果显示,新辅助化疗可以显著提高R0切除率(94.8%比83.8%,P<0.001)[10]。与上述研究相比,本研究倾向评分匹配后,两组间R0切除率的差异虽然没有统计学意义,但围手术期化疗组为93.8%,与手术+辅助化疗组的91.6%相比(χ2=1.625,P=0.444),有增高的趋势。
有研究显示,清扫的淋巴结数目≥15枚,才能够保证胃癌根治手术的质量,而且肿瘤大小、N分期、清扫淋巴结数目是影响胃癌预后的因素[9,11,12]。本研究倾向评分匹配后,手术+辅助化疗组清扫淋巴结数目为(32.9±15.0)枚,围手术期化疗组为(31.6± 13.7)枚(t=1.343,P=0.180),两组间清扫淋巴结数目相当,说明新辅助化疗对手术的质量没有影响。在胃癌的TNM分期中,淋巴结转移数目的多少决定N分期,围手术期化疗组的中位转移淋巴结数目(2枚)少于手术+辅助化疗组(6枚),差异有统计学意义(P<0.001);说明新辅助化疗达到了使肿瘤分期降低的效果,可能是本研究中围手术期化疗组预后较好的原因之一。
围手术期化疗组切除肿瘤最大直径小于手术+辅助化疗组,虽然胃癌的大小并不影响TNM分期,但是肿瘤缩小,有可能减少肿瘤向周围的浸润,有利于降低手术难度,更容易达到R0切除。有研究表明,累及脉管(血管和淋巴管)、神经是影响胃癌预后的危险因素[13,14]。本研究中,手术+辅助化疗组累犯血管和淋巴管及累犯神经的比例均高于围手术期化疗组,猜测新辅助化疗可以减少血管和淋巴管的浸润,这也可能是本研究围手术期化疗组预后较好的原因之一。
英国的MAGIC研究显示,围手术期化疗组5年OS为36%,单纯手术组为23%(P=0.009)[7,9]。RESOLVE研究入组患者为临床T4a/N+M0或T4b/NxM0胃癌患者,比较SOX(S-1+奥沙利铂)新辅助化疗组(364例)、SOX辅助化疗组(365例)和XELOX(卡培他滨+奥沙利铂)辅助化疗组(365例)治疗的效果;与辅助化疗方案XELOX相比,SOX新辅助化疗组的3年DFS有显著优势(62.0%比54.8%)[15]。另一项韩国的PRODIGY研究,入组了临床分期为T2~3/N+M0或T4/NanyM0的局部进展期胃癌或食管胃结合部腺癌患者,新辅助治疗组(238例)术前接受DOS方案(多西他赛+奥沙利铂+替吉奥)新辅助化疗3周期,之后行手术治疗,术后继续替吉奥辅助化疗;辅助治疗组(245例)为直接手术后行替吉奥辅助化疗;结果提示,新辅助治疗组3年PFS明显优于辅助治疗组(66.3%和60.2%,HR=0.70,P=0.023)[16]。本研究病例倾向评分匹配后的结果显示,围手术化疗组的PFS(56个月比36个月)和OS(65个月比45个月)均优于手术+辅助化疗组。与已发表的前瞻性随机对照研究结果相似。因此,本研究结果表明,围手术期化疗能够改善患者的PFS和OS。
目前,国内外关于围手术期化疗的大样本研究很少。在FLOT4研究的生存亚组分析中,男性患者生存获益明显,女性具有获益趋势;不同年龄的患者都有从围手术期化疗中获益趋势;食管胃结合部和胃部肿瘤都有生存获益的趋势;T3~4期患者获益显著;无论淋巴结是否有转移都有从围手术期化疗获益的趋势[9]。与FLOT4研究的结果相似,本研究OS的亚组分析结果显示,匹配后,不同性别、年龄、体质指数、cTNM、病理分化和肿瘤部位各亚组的OS差异有统计学意义(均P<0.05),无论男、女都能从新辅助化疗中获益;45岁以上年龄和BMI正常患者获益明显;cTNM ⅡA期和Ⅲ期患者有获益趋势或者显著获益;印戒细胞癌患者获益不明显;各部位肿瘤都有获益的趋势。PFS的亚组分析结果显示,匹配后不同性别、年龄、BMI、cTNM分期、病理分化和肿瘤部位各亚组的PFS比较,差异均有统计学意义(P<0.05)。无论男、女都能从围手术期化疗中获益;45岁以上年龄和正常BMI患者获益明显,cTNMⅡ期和Ⅲ期患者有获益趋势或者显著获益;印戒细胞癌患者获益不明显;胃体、胃窦部位肿瘤获益更明显。所以围手术期化疗可能是改善胃癌患者预后的有效方法。
目前,对胃癌新辅助化疗的药物选择和周期数还没有达成共识。Wang等[17]回顾了162例胃癌新辅助化疗病例,其中74例为双药方案(氟尿嘧啶和铂类),88例为三药方案(氟尿嘧啶、铂类和紫杉醇),中位DFS为38.0个月和3.0个月(P=0.377),中位OS为59.0个月和56.5个月,两组间差异没有统计学意义(P=0.256)。Hayashi等[18]研究显示,术前4周期DCS(多西他赛/替吉奥/顺铂)组的3年OS为71.9%,优于2周期DCS组的48.5%、2周期CS(替吉奥/顺铂)组和4周期CS(替吉奥/顺铂)组的58.1%。与FLOT4和RESOLVE等前瞻性研究不同,本研究围手术期化疗组包括不同的用药方案,说明围手术期化疗中不同的用药方案都可能改善患者的预后。Ramachandra等[19]研究显示,新辅助化疗并没有增加胃癌化疗的出血、吻合口漏等并发症。与上述的研究结果相似,本研究围手术期化疗组与手术+辅助化疗组总并发症发生率、肺感染、腹腔感染、出血、吻合口漏、十二指肠残端漏等常见的术后并发症差异没有统计学意义(均P>0.05)。
由于本研究为回顾性分析,存在一定的不足之处:(1)由于病例选择偏倚、围手术期化疗的方案和周期不是统一的标准。(2)由于数据获取限制,未对不同的围手术期化疗方案和周期数、肿瘤退缩分级等亚组患者进行分析。期待今后有更高级别证据的研究,以得出更为可靠的结论。
综上,基于国内多中心的真实世界的数据,胃癌围手术期化疗是安全可行的,能够改善胃癌患者的OS和PFS。
顾永恩、宋丰举在本文统计学方面的贡献
所有作者均声明不存在利益冲突



























