
变应性鼻炎、支气管哮喘等呼吸道过敏性疾病呈现24 h波动特点,与生物钟的调控密切相关。经典免疫细胞如树突状细胞、T细胞、肥大细胞(MC)、嗜酸性粒细胞等,可周期性表达多种时钟基因Clock、Bmal1、Per、Rev-erbα,参与IgE介导的呼吸道过敏性疾病的昼夜节律性发作。在现代社会中,机体内在生物钟与外界生物钟“失同步”产生的生物节律紊乱,有可能加重呼吸道过敏性疾病的发展进程。药理性上调MC中Per2基因或重设内外时钟节律活动,可以“迟滞”呼吸道过敏性疾病的时相反应,从而抑制其症状发作。本文重点介绍生物钟调控呼吸道过敏性疾病的作用机制和临床新进展,以期为呼吸道过敏性疾病的“时间生物学疗法”提供科学依据和理论参考。

变应性鼻炎(AR) 、支气管哮喘(简称哮喘)等呼吸道过敏性疾病具有24 h昼夜波动特点,多在夜间至晨起发作,表现为时相反应[1]。有研究指出,生物钟在AR和哮喘发病中发挥关键作用,影响其时相反应[2]。呼吸道过敏性疾病的发病率逐年攀升,严重影响了人们的日常工作、生活以及夜间睡眠质量,给社会造成巨大的经济负担[3]。以往研究认为Th2样细胞因子释放、嗜酸性粒细胞浸润以及肥大细胞(MC)脱颗粒是AR和哮喘发病中的重要病理生理过程,并据此制定了相应的防治策略,但部分患者的临床疗效仍差强人意[1, 2]。新近研究表明,现代社会西方化生活方式(昼夜颠倒/光暴露紊乱等)引起的机体生物节律紊乱,可能加重呼吸道过敏性疾病的发生和发展[4]。基于此,本文简要介绍生物钟基本原理、时钟基因调控呼吸道过敏性疾病时相反应的作用机制以及生物节律紊乱影响呼吸道过敏性疾病的研究进展,以期从时间医学角度为AR和哮喘的防治提供新思路和新策略。
在整体层面上,哺乳动物体内的中枢生物钟位于下丘脑视交叉上核(SCN)[5]。自然条件下光照刺激视网膜后激活视觉感光细胞,后者可特异性表达感光色素受体和视黑素受体,直接交联到SCN;SCN借助于下丘脑-垂体-肾上腺轴(HPA轴)分泌内源性糖皮质激素的周期活动,整合并“同步”外周靶器官(诸如鼻腔、肺脏、肝脏、皮肤等)的生物节律活动[6, 7, 8]。这一过程主要依赖神经-内分泌途径完成,其内在机制归因于SCN调控外周靶细胞的自主节律性活动,即生物钟反应[1, 2]。
在细胞层面上,生物钟的运转机制通过时钟基因的转录-翻译来完成,该过程涉及一系列基因的正负反馈调控,大约24 h内完成一次循环活动[9]。生物钟主要涉及两个反应环路,为核心环路和辅助环路。在核心环路中,生物钟循环输出蛋白(Clock)为大脑和肌肉芳香烃受体核转运样蛋白-1(Bmal1) 基因通过bHLH—PAS结构域形成Clock/Bmal1异二聚体,结合到周期基因Per(1~3)和隐花色素基因(Cry1~2)上游启动子位点E盒(CACGTG),激活Per和Cry的转录和翻译,当胞质中PERs/CRYs蛋白含量持续积聚达到峰值时,PERs/CRYs转移至细胞核内直接作用于Clock和Bmal1,抑制其异二聚体的活性[1]。这一正负反馈循环是细胞内的主要环路,涉及诸多分子机制,且每一机制似乎都均等地参与了生物钟的时相稳定和精准定时[2]。在辅助环路中,Clock/Bmal1异二聚体能够与视黄酸相关孤儿受体α(Rorα)和反红细胞增多病毒α(Rev-erbα)基因上游启动子位点E盒(CACGTG)相结合,促进其对应蛋白Rorα和Rev-erbα合成,其中Rorα作为激活蛋白,与Bmal1启动子的反应元件RORE结合进而促使Bmal1转录,Rev-erbα作为抑制蛋白,与Bmal1启动子的反应元件RORE结合进而阻遏Bmal1转录,二者通过交替作用维持细胞内 24 h生物节律活动[4,7]。这一途径是细胞内存在的关键性辅助和补充环路[9](图1)。
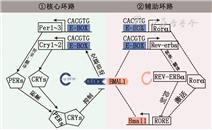

注:①核心环路:以实线标注,正性反应元件包括Clock(生物钟循环输出蛋白)和Bmal1(大脑和肌肉芳香烃受体核转运样蛋白-1),负性反应元件包括Per(周期基因)和Cry(隐花色素基因);②辅助环路:以虚线标注,正性反应元件包括Clock和Bmal1,激活因子Rorα(视黄酸相关孤儿受体α),抑制因子Rev-erbα(反红细胞增多病毒α)
呼吸道过敏性疾病被认为是以Th2主导的慢性炎症反应,涉及上皮细胞损伤、细胞因子如白细胞介素(IL)-4、IL-5、IL-13、IL-33释放、IgE合成、嗜酸性粒细胞浸润、MC脱颗粒、杯状细胞增生等病理改变[10, 11]。研究证实,生物钟存在于多种免疫细胞中,能够启动并激活呼吸道黏膜上皮细胞周期性释放IL-33,促进树突状细胞抗原提呈、Th2细胞优势分化,借助于IL-33/ST2信号通路与MC或嗜碱性粒细胞发生“桥连”反应,诱发MC脱颗粒释放炎症介质,包括MC特异性蛋白酶Mcpt-5、Mcpt-7、类胰蛋白酶、组胺和白三烯等[8,12]。这也是IgE/MC介导的呼吸道过敏性疾病呈现时间依赖性发作的病理机制之一。
1. 上呼吸道高反应性疾病:以AR为代表,其主要症状(鼻痒、鼻塞、发作性喷嚏、清水样鼻涕)呈现昼夜“谷峰式”发作特点,多在晨起或夜间加重,伴清晨鼻腔分泌物中嗜酸性粒细胞和MC含量升高[6]。研究表明,时钟基因存在于人和鼠的鼻黏膜组织中,调控鼻周期的时间性反应[6,13]。动物实验研究证实,小鼠鼻黏膜上皮细胞、血管内皮细胞以及黏膜下神经纤维末梢均可表达Per2基因,而Per2与血清中内源性糖皮质激素的节律性分泌呈正相关,于ZT0时(6∶00)显著下调、ZT12时(18∶00)显著上调,提示内源性糖皮质激素通过介导Per2的节律性变化进而重设鼻黏膜时相反应,表明生物钟参与AR发病的神经-免疫-内分泌调控机制[13]。前期研究表明,单侧或双侧肾上腺切除导致HPA轴功能缺陷,引发内源性糖皮质激素紊乱,进而影响AR发病中Th1/Th2免疫平衡以及Treg细胞反应[10];进一步研究提示Per2基因具有抗炎作用,其潜在机制可能与周期性下调Th2正向转录因子GATA3以及上调Th17负向转录因子E4bP4的表达有关[6]。Nakamura等[14]研究发现,采用不同药物(PF670462、皮质酮、氨茶碱)上调MC和嗜碱性粒细胞中Per2基因,能够“迟滞”FcεRⅠ受体(主要是β亚单位)的周期性表达,有效阻断IgE/FcεRⅠ诱导的MC脱颗粒反应,从而减弱AR症状。这种药理性干预MC生物钟活动,有助于维持鼻腔黏膜最低炎症反应状态,抑制AR的时间性发作。
一项针对季节性AR的临床研究发现,与19∶00点相比,嗜碱性粒细胞中Per1和Per3在7∶00点时呈现高表达,伴活化标志物CD203c含量升高[12]。利用IgE刺激野生型小鼠骨髓源性嗜碱性粒细胞,可周期性释放IL-4和组胺,这一现象在Clock-/-小鼠中缺如[12]。以上研究结果能够部分解释季节性AR发病的时间规律,即时钟基因可能参与抗原或IgE诱导嗜碱性粒细胞的周期性脱颗粒以调控季节性AR。
2. 下呼吸道高反应性疾病:以哮喘为代表。公元5世纪前后,Aurelianus Caelius首次提出哮喘的昼夜节律现象[15]。近年来,研究者对这一现象进行了探究和剖析。中-重度哮喘患者外周血和痰液中嗜酸性粒细胞及其标记物CCL11的含量在凌晨4∶00点显著高于下午16∶00点,伴FEV1值显著降低[16]。在昼夜24 h内,每间隔4 h收集中-重度、持续性、屋尘螨致敏的哮喘患者外周血,分离并提纯嗜碱性粒细胞,采用不同浓度IgE刺激后发现嗜碱性粒细胞脱颗粒释放组胺在8∶00点明显高于20∶00点,与哮喘症状的峰值相吻合,而正常人则无明显差异[8]。研究发现脂多糖(LPS)诱导小鼠肺部炎症疾病的时相反应,主要依赖于呼吸道上皮细胞中Bmal1的周期性表达,这种现象在Bmal1-/-小鼠中消失[17]。Rev-erbα作为Bmal1基因的下游反应元件之一,在哮喘发病中具有重要的作用[18, 19]。新近研究显示,Rev-erbα能够调控呼吸道黏膜胆碱能受体(M1、M3)的周期性表达;噻托溴铵喷雾剂作为长效抗胆碱能药物,可竞争性抑制M3受体,引起呼吸道平滑肌松弛从而达到缓解哮喘的目的[18]。基于生物钟理论,设想在凌晨M3受体高表达时,适时或提前用药进行干预,将可能极大地提高药物的生物利用度和治疗效果。以Rev-erbα为靶点的药物研究,推动了探寻呼吸道过敏性疾病“时间生物学”治疗的热潮。
在自然状态下,光照是最重要的外源性授时因子(zeitgeber),“同步”机体内在生物钟与外界生物钟的时相变化[1]。异常光暴露会影响固有的睡眠-觉醒周期,引起机体内在生物节律紊乱[2]。在真实世界中,现代社会快速时空变换的生活模式,诸如轮班作业、频繁跨时区飞行等,常常造成机体内在生物钟与外界生物钟“失耦联”[4]。昼夜轮班制作业人员,多见于医生、护士、飞行员和警察等[20]。流行病学数据显示,睡眠障碍或轮班作业者罹患变应性疾病、代谢性疾病的风险显著升高[2,4]。不规律昼夜倒班制护士较白夜班固定的护士更容易发生食物过敏,提示生物节律紊乱不仅影响了食物过敏的昼夜节律,也增加了IgE/MC轴介导的变应性疾病的易感性[21]。通过采集不同人群的血液样品,研究证实昼夜倒班制护士外周血B细胞中Clock含量显著升高,而转化生长因子(TGF)-β含量显著降低[20]。
有关生物节律紊乱对呼吸道过敏性疾病的研究,目前主要聚焦于哮喘领域,较少关注AR[11,18,22]。通过在实验条件下模拟并构建慢性时差动物模型,研究表明慢性时差在一定程度上对应压力应激,可能干扰HPA轴的神经-内分泌活动,使中枢生物钟与外周生物钟“脱钩”后出现生物节律紊乱[9]。生物节律紊乱显著加重了小鼠的哮喘样症状,其作用机制涉及气道阻力增大、乙酰甲胆碱的敏感性增加以及肺脏黏液蛋白muc5ac分泌增多[11]。Bmal1-/-小鼠的哮喘症状较野生型小鼠明显加重,与肺脏和血清中嗜酸性粒细胞数量以及IL-5水平升高有关[11]。笔者团队正在尝试探究生物节律紊乱影响AR发病的作用机制,以期有所发现,为临床应用和转化提供借鉴意义。由此可知,合理有效的生活方式干预以及“时钟编辑器”的应用,可能为呼吸道过敏性疾病的精准防控提供新的策略[2,4]。
从生物钟与疾病的关系探讨呼吸道过敏性疾病发生发展的规律,为研究免疫系统疾病的发病机制和防治策略提供新的视角。借助于人体和动物实验的数据结果,生物钟研究将会为揭开呼吸道过敏性疾病的昼夜节律这一“神秘面纱”提供理论基础,使医生和患者群体更深刻地认识和重视这类疾病,从而为患者带来更加精准的临床诊疗方案,比如选择AR和哮喘患者最佳的抽血化验或炎症指标监测时间,将更能准确反映疾病的客观数值[3,15]。将生物钟理念运用于疾病治疗过程中,可能最大限度地提高疗效、减少副作用。目前一些药物已被探索用于治疗呼吸道过敏性疾病。AR的临床一线药物抗组胺、白三烯受体拮抗剂在夜间给药比清晨给药的疗效更佳[15]。类固醇激素治疗哮喘患者的最佳时间点可能与人体内源性糖皮质激素的周期波动有关[3],但具体机制仍待继续挖掘。
进一步探究时钟基因调控呼吸道过敏性疾病的分子机制,有助于从更深层次认识疾病发生的诸多因素及其交互作用关系。例如,以Rev-erbα为靶点的研究,在体外合成外源性REV-ERBα配体,可能调控IL-6和CCL2的合成与释放,为哮喘的治疗带来新的突破[19]。再有,利用Per2周期性调控MC合成FcεRⅠ受体影响IgE/FcεRⅠ信号“偶联”这一分子通路,通过基因编辑或RNA沉默技术,从上游基因处事先干预,破坏MC脱颗粒的时相反应,可以有效阻断AR的发展进程,为呼吸道过敏性疾病时间医学和精准医学奠定理论基础和实践价值。
所有作者均声明不存在利益冲突



























