
膀胱输尿管反流(vesicoureteral reflux,VUR)是常见的儿童泌尿系统畸形。内镜注射治疗应用于低级别原发性VUR,在欧美国家是首选和主流方法,在国内尚方兴未艾。右旋糖酐/透明质酸共聚物(dextranomer/hyaluronic acid copolymer,Dx/HA)是业内公认安全有效的注射剂,膀胱扩张注射术(hydrodistention implantation technique,HIT)及Double HIT注射术是常用的操作方法。内镜注射治疗安全、有效、微创,能够有效预防及控制VUR所导致的尿路感染、减少肾瘢痕形成、防止肾功能损害,应用前景广泛。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
膀胱输尿管反流(vesicoureteral reflux,VUR)是指因输尿管膀胱连接部的抗反流机制异常引起的尿液自膀胱逆流入输尿管、肾盂的一种病理现象,分为原发性和继发性,临床以原发性多见。由于尿液反流的存在,VUR常引起反复尿路感染(urinary tract infection,UTI)、肾盂肾炎、肾瘢痕形成,最终导致肾性高血压及终末期肾病。VUR有明显的家族聚集现象。研究表明,遗传因素在其发病机制中起着重要作用,目前已知的相关基因有GATA3、PAX2、KAL1-6、HOXA13、NIPBL等,但尚未发现特定致病基因位点[1,2]。
VUR的主要治疗目的是控制尿路感染及减少肾损伤。根据反流分级和风险评估,目前国内对原发性VUR的治疗方法主要为保守治疗和手术治疗。保守治疗包括定期监测和连续预防性使用抗生素(continuous antibiotic prophylaxis,CAP);手术治疗包括开放手术、腔镜手术及机器人手术,开放手术以Cohen术式最常用。从首例内镜下注射聚四氟乙烯治疗原发性VUR取得成功至今已有近40年的历史。随着注射剂和注射方法的不断更新与改进,内镜注射治疗疗效已趋近于手术治疗。国外已将内镜注射治疗作为治疗低级别原发性VUR的第一选择和主要方法。本文现从注射剂、注射方法、适用人群、影响疗效的因素及并发症等方面对注射治疗进行综述。
1984年O’Donnell和Puri首次应用聚四氟乙烯(polytetrafluoroethylene,PTFE)注射治疗原发性VUR并取得成功,临床数据提示PTFE治疗成功率高达95%[3,4]。但之后有动物实验报道,直径<80 μm的PTFE颗粒可通过输尿管-膀胱交界处的小血管进入静脉循环迁移至肺部和颅脑,因此该材料被迅速摒弃[5]。随后聚二甲基硅氧烷(Macroplastique/Silicone)被尝试用于注射治疗。虽然其高粘性和不可吸附性似乎增加了该产品的可靠性,但也被动物实验证实部分直径<80 μm的聚二甲基硅氧烷颗粒存在多器官迁移风险,且注射部位可因免疫反应出现严重的膀胱输尿管连接部梗阻(vesicoureteral junction obstruction, VUJO)致尿脓毒血症、梗阻性急性肾功能衰竭[6]。因此该材料也未能得到普及。
现用于注射治疗原发性VUR的注射剂主要有右旋糖酐/透明质酸共聚物(dextranomer/hyaluronic acid copolymer,Dx/HA)和聚丙烯酸酯-多元醇共聚物(polyacrylate polyalcohol copolymer,PPC)。Dx/HA是一种可生物降解、不易迁移、无免疫原性的高粘性凝胶,由右旋糖酐微球和非动物性透明质酸组成,其微球直径为80~250 μm。PPC是2008年后用于注射治疗VUR的新材料,属丙烯酸类不可生物降解合成物质,由PPC颗粒浸在含有40%甘油和生理溶液的载体中形成,其平均直径约320 μm。关于这2种注射剂的疗效对比研究提示两者短期疗效相似,Dx/HA因生物可降解性导致远期复发率稍高(10%~26%)[7,8]。但更值得关注的是,使用PPC注射治疗后,因输尿管纤维化所导致的VUJO发生率(7.8%)明显高于Dx/HA(0.5%),且行输尿管再植术更为困难[6,7,8]。由于Dx/HA的疗效尚可且更具安全性,自2001年Dx/HA被美国食品药品管理局(Food and Drug Administration,FDA)批准用于治疗VUR后,至今仍是国外最受欢迎的注射剂,也是国内唯一报道应用于临床的注射剂[7,9]。
随着内镜注射技术的不断改进,先后出现了经尿道输尿管口下注射术(subureteral transurethral injection,STING)、膀胱扩张注射术(hydrodistention implantation technique,HIT)及Double HIT等方法。其原理均是在膀胱镜直视下将注射剂注射于输尿管口或输尿管膀胱壁内段的黏膜下层,抬高并缩窄输尿管口,人工形成抗反流生物瓣,以达到治疗目的。
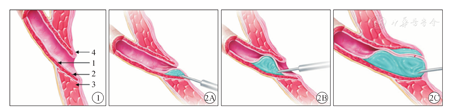
三种注射方法的主要区别在于注射位点不同(图1)。STING法是从输尿管外口6点钟位置下方2~3 mm处进针,并向前推进3~5 mm,于膀胱黏膜下层注射0.2~0.5 ml注射剂,使输尿管口形成一个类似"新月形"的隆起,抬高和缩窄输尿管口至完全闭合(图2A)[4]。HIT法是利用0.8~1.0米高的静水压使输尿管扩张并可视化,当膀胱充盈约1/2预计容量时,医生根据输尿管口及输尿管远端扩张程度进行HD分级(Hydrodistention分级):①H0级,未见输尿管口扩张;②H1级,仅见输尿管口扩张;③H2级,可见输尿管膀胱壁内段管腔;④H3级,可见输尿管膀胱壁内段以外的管腔[10]。于输尿管内口6点钟位置进针,在输尿管膀胱壁内段的中段黏膜下层注入0.5~1.5 ml注射剂,剂量以HD分级达到H0~H1级为宜(图2B)。Double HIT法是在HIT法基础上增加了输尿管膀胱壁内段的远端黏膜下注射,注射剂量以产生的丘状凸起使输尿管口达到H0级为宜。单侧输尿管约注射1.0~1.5 ml注射剂。只有少数病例行Double HIT法治疗后仍未能使输尿管口缩窄至H0级,可通过增加STING注射或输尿管上注射来达到理想效果(图2C)[8]。Alizadeh等[8]报道STING、HIT、Double HIT的成功率分别为79%、92%和96%。Double HIT法通过增加注射位点和注射剂量,可以有效提高治疗成功率,避免部分患儿重复注射治疗,是美国小儿泌尿科医师最常用的注射方法。
国外关于内镜下注射治疗原发性VUR的研究已趋于成熟,但目前其适应证和禁忌证尚未达成共识。现公认的注射治疗适用人群主要为:1岁以上且存在持续反流、经CAP治疗仍反复发生UTI、有进行性肾瘢痕形成的原发性VUR患儿[9,11,12]。对于注射治疗前合并有排尿功能障碍、后尿道瓣膜、神经源性膀胱、膀胱憩室、重复输尿管、输尿管异位开口、或膀胱肠道功能障碍等解剖和功能异常的患儿,其注射治疗的成功率仅50.0%~69.5%,不建议行注射治疗[3,13]。
众所周知,原发性VUR在低级别反流和年幼患儿中具有高自发消退率,现各医学协会和相关指南建议年龄<1岁的原发性VUR患儿首选CAP治疗[11,14]。但国内外不少研究表示,高级别原发性VUR的自发消退率较低且婴儿期肾瘢痕形成的概率较高,早期对Ⅳ~Ⅴ级原发性VUR患儿行内镜注射治疗是安全和必要的[9,13,15]。
由于各研究间入组标准及对"治疗成功"的定义不同,目前报道注射治疗的成功率差异较大,在68.0%~93.7%之间[7,8,16]。Rao等[17]以Dx/HA为注射剂,采用HIT法和Double HIT法治疗Ⅰ~Ⅲ级无肾瘢痕的原发性VUR患儿,其成功率达90%~100%,并不低于传统手术治疗的成功率(92%~98%)[14]。
近年来,国内江浙沪地区率先开展了内镜下注射治疗原发性VUR患儿的研究,并取得初步成果。陈光杰等[9]报道的内镜治疗成功率为54.55%,且未发生严重并发症。虽然其治疗成功率略低,但排除其受到样本量的限制以及注射技术尚未成熟等因素的影响,仍可证实内镜注射治疗是一种安全、有效的治疗方法,前景非常可观。
注射前有无肾瘢痕形成和VUR分级是影响疗效的最重要因素。研究表明,肾瘢痕形成与注射治疗失败显著相关[15,18]。在有肾瘢痕形成的患儿中,注射治疗后VUR的复发率更高[13]。术前VUR分级是单次注射治疗疗效的显著预测因素这一观点已被广泛认可[7,10,15]。Kim等[3]的多中心研究报告显示,内镜下注射Dx/HA治疗Ⅰ~Ⅴ级原发性VUR的成功率分别为89%(Ⅰ级)、83%(Ⅱ级)、71%(Ⅲ级)、59%(Ⅳ级)和62%(Ⅴ级)。可见注射治疗成功率会随注射前VUR分级的增加而降低,但也并非呈线性关系,Ⅱ级注射失败的风险仅比Ⅰ级稍高,而Ⅴ级注射失败的风险并没有明显高于Ⅳ级。
此外,外科医生的操作经验也被认为是影响疗效的因素之一[19]。注射时进针部位的选择、进针的角度及深度、注射的路径及平面,注射材料的体积等操作技巧均会影响治疗效果[20]。Dalkiliç等[21]对同一中心134例接受注射治疗的VUR患儿进行回顾性分析发现,该中心的治疗成功率在一年半内从最初的60%提高到80%,可见内镜注射技术有明显的学习曲线。
近期,输尿管直径比(ureteral diameter ratio,UDR)被提出可作为预测疗效的新指标。UDR是指行VCUG检查时假骨盆内的最大输尿管直径与L1椎体底部至L3椎体顶部间距离的比值。Payza等[12]认为UDR的大小与疗效呈负相关,且较反流等级能更准确预测注射治疗成功率。该指标更客观的判断了输尿管扩张程度对预后疗效的影响,然而其可靠性仍需更多数据的验证。
自2001年Dx/HA被美国FDA批准后,一直受到国外医生和患儿家属的青睐,也是国内唯一报道应用于临床的注射剂[7,9,22]。目前报道的并发症有:VUR复发、对侧新发VUR、UTI、VUJO和输尿管钙化[6,8,23]。
VUR复发是注射治疗最常见的并发症,常因术后出现发热性UTI或行VCUG检查时发现,单次注射治疗5年内复发率为10%~26%[8,22]。复发的VUR患儿可行重复注射或输尿管膀胱再植术,重复注射的总成功率可高达85%~100%[14,17]。因此在选择手术治疗前考虑重复注射治疗具有临床意义。对侧新发VUR是注射治疗的另一常见并发症,在Molitierno等[24]的报道中,注射治疗后仅13%的患儿出现对侧新发VUR,低于传统开放手术(10%~32%)。
在降低UTI发生率方面,多家报道均提示注射治疗优于手术治疗[16,24]。甚至有学者研究指出,CAP治疗由于依从性差和易出现二重感染等问题,内镜注射治疗在预防UTI发生方面更具优势[3,25]。使用Dx/HA行注射治疗后VUJO发生率仅0.5%~1.05%[22],且不易引起输尿管周围纤维化,较易行输尿管膀胱再植术[6,7]。此外,输尿管注射部位发生钙化为注射治疗的罕见并发症,影像学表现与输尿管结石相似,需注意相互区别。若输尿管的注射部位钙化不引起肾功能减退,可暂不干预[6,26,27]。
随着注射剂的不断更替及注射技术的不断成熟,越来越多的VUR患儿家属倾向于选择注射治疗,也为临床研究及技术发展提供了大量数据支持。目前,对Ⅳ~Ⅴ级、有肾瘢痕形成和输尿管解剖结构异常的VUR患儿建议行外科手术治疗。对Ⅰ~Ⅲ级无肾瘢痕形成的原发性VUR患儿行注射治疗,其疗效理想、并发症发生率低。甚至对于无肾瘢痕形成及排尿功能障碍的Ⅰ、Ⅱ级原发性VUR患儿,由于注射治疗后无须行VCUG检查评估疗效,可减少部分患儿辐射暴露,减轻随访经济负担[16,18]。
综上所述,内镜下注射治疗创伤小、无瘢痕、恢复快、操作快捷甚至可在门诊开展、无须留置导尿管、治疗后镇痛止血药物使用率低、并发症发生率低、患儿家长满意度高,是替代预防性使用抗生素及外科手术治疗低级别原发性VUR患儿的一线治疗方法[11,15,19]。
所有作者均声明不存在利益冲突



























